不同毒力传染性支气管炎病毒诱导SPF鸡炎症反应的免疫机制
马得莹,范佳慧, ,任梦婷, ,谢晶晶, ,王芳芳,焦亚茹, ,韩宗玺
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室,哈尔滨 150001)
天然免疫系统是机体抵御病原微生物感染的第一道防线。病原入侵机体后,最初的相互作用是宿主细胞通过模式识别受体(Pattern recognition receptors,PRRs)识别病原体相关分子模式(Pathogen associated molecule patterns,PAMPs)[1]。目前,研究最深入的PRRs 是Toll 样受体(Toll-like receptors,TLRs),在禽体内,已发现 10 种 TLRs 基因[2]。TLRs 胞外区通过识别PAMPs 或受损细胞的分子向细胞内转导识别信号,募集相应接头蛋白,通过 MyD88(Myeloid differentiation factor 88,MyD88)和 TRIF(Toll-like receptor adaptor molecule,TRIF)依赖性途径激活诱导趋化因子、细胞因子及共刺激分子等信号转导途径,抵御入侵的病原体[3]。细胞因子具有免疫调节、细胞损伤修复及促进细胞生长等功能,在免疫系统发挥相互联系的介导作用[4]。白细胞介素(Interleukin,IL)具有免疫调节、细胞损伤修复及活化T 细胞、B 细胞等功能,在免疫系统发挥介导作用[5]。IL-1β、IL-6 和IL-8是促炎细胞因子,可诱导多种免疫细胞增殖、分化及不同靶基因转录[5]。淋巴细胞是主要免疫细胞之一,按照功能可分为T 细胞、B 细胞和NK 细胞。CD4分子主要在Th细胞表达[6],当外源病原体入侵机体,CD4T细胞通过T细胞受体(T cell receptor,TCR)识别多肽-MHC Ⅱ复合物,增强CD8T细胞清除病毒以及被病毒感染的细胞活性,间接发挥抗病毒作用[7]。
传染性支气管炎病毒(Infectious bronchitis virus,IBV)是一种正向单链RNA病毒,属于冠状病毒科(Coronaviridae)冠状病毒属γ-冠状病毒,基因组全长约27.6 kb[8]。IBV 基因具有5'帽子和3'poly(A)尾巴结构,基因组3'端编码4 种结构蛋白,包括纤突蛋白(S)、核衣壳蛋白(N)、膜蛋白(M)和小分子蛋白(E),4 种辅助蛋白(3a、3b、5a 和5b)[9]。1931年,Schalk和Hawn最早对IBV进行报道[10]。禽传染性支气管炎(Infectious bronchitis,IB)是由IBV引起的一种急性、高度传染性疾病,可引起各日龄鸡呼吸道疾病、间质性肾炎和生殖障碍。Kameka等发现,鸡感染IBV后,通过诱导TLR7 mRNA表达,启动宿主天然免疫反应[11]。De Silva等用TLR21配体CpG ODN预处理后,雏鸡感染IBV后发病率及死亡率显著降低,且气管和肺脏巨噬细胞、CD4T 细胞和CD8T细胞均有不同程度增加[12]。体外研究发现,鸡传染性支气管炎病毒M41株感染鸡巨噬细胞后,干扰素(Interferon,IFN-α)、IL-1β、IL-6 均显著增加,并由病毒复制触发细胞凋亡[13]。
IBV血清型众多,不同血清型疫苗交叉保护力低,易造成疫苗免疫失败,且野毒株和疫苗毒株可能出现病毒重组,产生“新”毒株,导致免疫失败,鸡群发病。本试验研究不同毒力IBVs 对鸡天然免疫和获得性免疫反应的影响,深入探讨IBV致鸡免疫炎症反应及机体内免疫因子通过信号转导机制的抗病毒作用。
1 材料与方法
1.1 材料
选取1日龄无特定病原体(SPF)的雌雄混合白来航鸡120只,由中国农业科学院哈尔滨兽医研究所提供,无菌饲养至7日龄。IBV 毒株:106EID50CK/CH/LDL/140520毒株(IBV强毒株)、104EID50γCoV/ck/China/I0718/17毒株(IBV弱毒株)均由中国农业科学院哈尔滨兽医研究所禽呼吸道病创新团队保存。
1.2 主要试剂及仪器
PrimeScriptTMOne-Step RT-PCR 试剂盒、One Step SYBR®PrimeScriptTMRT-PCR Kit Ⅱ试剂盒、RNAiso Plus 均购自TaKaRa(大连)公司,ELISA 试剂盒购自美国BioChek公司,所用试剂异丙醇、无水乙醇、苯酚、三氯甲烷和冰乙酸均为分析纯。LightCycler®480 II 荧光定量 PCR 仪、瑞士 Roche 酶标仪BioTek。
1.3 动物实验
将120 只7 日龄SPF 白来航鸡随机分为三组,分别为对照组和两个感染组,每组40 只。感染组分别通过滴鼻点眼途径接种IBV强毒株、IBV弱毒株0.1 mL·只-1,对照组接种同等剂量PBS。隔离饲养,自由采食和饮水。分别在攻毒后12、36 h 和3、7、14 d,每组随机选取5 只心脏采血处死,检测血清抗体水平。采集肾脏、气管、法氏囊和脾脏冷冻保存,用于RNA提取。
1.4 组织总RNA提取
采用TRIzol 方法提取组织样品总RNA。经鉴定后用100 μL DEPC处理水吹吸溶解混匀,超低温冰箱(-80 ℃)保存。
1.5 引物设计及合成
根据GenBank中已发表IBV序列、鸡内参基因18S rRNA、TLRs 基因、信号转导分子和细胞因子序列,利用Primer Premier 5.0 软件设计特异性引物,引物序列见表1。
1.6 实时荧光定量PCR
以各脏器组织提取总RNA 为模板,18S rRNA为内参基因,使用表1 特异性引物进行RT-qPCR检测,PCR 反应体系 25 μL:2X one step buffer 12.5 μL;RNA Free dH2O 7.5 μL;PrimeScript one step Enzyme Mix 1 μL;Forward Primer(2.5 μmol·L-1)1 μL;Reverse Primer(2.5 μmol·L-1)1 μL;RNA 2 μL。PCR 反应程序:42 ℃反转录 5 min;95 ℃预变性 10 s;95 ℃变性 5 s,60 ℃退火 30 s,共40 个循环;40 ℃延伸30 s。标准品为参考Woods等[14]方法制备的各基因重组质粒,标准品按照10 倍梯度稀释构建标准曲线。每个样品重复3 次,取其平均值。标准品拷贝数(copies·μL-1)=(6.023×1023copies·mol-1×质粒浓度g·μL-1)(/碱基数×660 g·mol-1)。基因相对表达量计算公式:基因相对表达量(校正值)=Lg(目标基因拷贝数/内参基因拷贝数)。

表1 荧光定量PCR引物序列及产物长度Table 1 Quantitative real-time PCR primer sequences and product length
1.7 数据分析
所有数据均以平均数±标准误表示。所得数据采用SPSS(24.0)软件进行方差分析,F检验显著性,P<0.05为统计显著性,以a、b、c表示。
在建设新工科这一宏伟蓝图之下,产教融合也具有了新的时代特征。从《国务院办公厅关于深化产教融合的若干意见》中可以总结出以下几点。
2 结果与分析
2.1 感染不同毒力IBVs后鸡的临床和剖检症状
对感染组进行病理剖解,观察IBV强弱毒株剖检病理变化差异(见图1)。由图1 可知,对照组未观察到临床症状和剖检病理变化,在IBV弱毒感染后,SPF鸡未表现出明显临床症状。剖解发现,肾脏未出现IBV感染后典型病理变化。IBV强毒株感染后3 d,病鸡出现甩头、精神沉郁、张嘴呼吸、翅膀下垂等临床症状,感染后13 d 症状消失;在强毒株感染后5 d出现死亡(两只),4、6、7、8和10 dpi 各死亡1 只,死亡率20%;剖解感染死亡的鸡,可见其肾脏苍白肿大,尿酸盐沉积,呈“花斑肾”样,呈现典型IBV病理剖解变化。
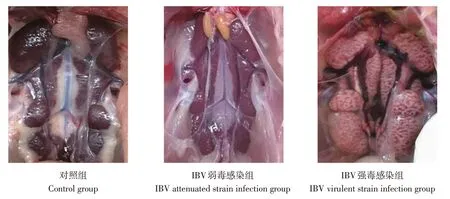
图1 鸡感染不同毒力IBV毒株肾脏剖检症状Fig.1 Autopsy symptoms of kidney levels in chickens infected with different IBV virulent strains
2.2 感染不同毒力IBVs后鸡组织病理变化
感染不同毒力IBVs后,采用4%福尔马林溶液固定部分气管和肾脏,选取感染IBVs后7 d的气管和肾脏组织作组织病理检测,组织病理切片结果如图2所示。结果显示,与对照组相比,IBV 弱毒株感染导致气管黏膜层完整性破坏,固有层可见少量炎性细胞浸润及炎性细胞坏死,肾脏髓质近皮质处可见炎性细胞浸润灶;IBV强毒株感染表现为更加严重病变,气管局部上皮细胞脱落,固有层增宽,内可见较多炎性细胞浸润,肾脏皮质局部可见大量炎性细胞浸润,浸润区肾小管部分上皮细胞变性坏死。
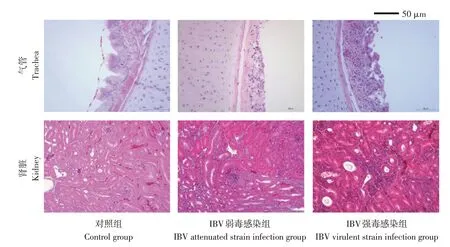
图2 鸡感染不同毒力IBV毒株肾脏和气管组织病理切片变化Fig.2 Histopathological changes of trachea and kidney in chickens infected with different IBV virulent strains
2.3 感染不同毒力IBVs后鸡血清抗体水平
感染不同毒力IBVs 后 12 h、36 h、3 d、7 d 和14 d,采集血清,ELISA 检测血清抗体水平,结果如图3所示,对照组各时间点血清抗体水平均为阴性,IBV 强毒株组和IBV 弱毒株组在感染14 d 时,可检测到感染鸡血清抗体水平呈阳性。

图3 鸡感染不同毒力IBV毒株血清抗体水平Fig.3 Serum antibody levels of chickens in response to IBV virulent strains
2.4 感染不同毒力IBVs后鸡组织病毒载量检测
分别使用不同毒力IBVs 感染不同时间点,通过RT-qPCR 方法,检测病毒在各脏器组织的病毒载量,如图4所示。结果显示对照组采集的所有脏器组织中,均未检测到病毒。在IBV弱毒株感染组中,法氏囊在7和14 dpi,肾脏和气管均在7 dpi检测到病毒;在IBV强毒株感染组中,法氏囊和脾脏在 7 和 14 dpi,气管在 36 hpi、3、7 和 14 dpi 均检测到病毒,且病毒拷贝数高于IBV 弱毒株感染组。上述试验结果说明各组均攻毒成功,鸡可感染不同毒力的IBV,且不同毒力IBVs 在不同器官中感染情况存在差异。
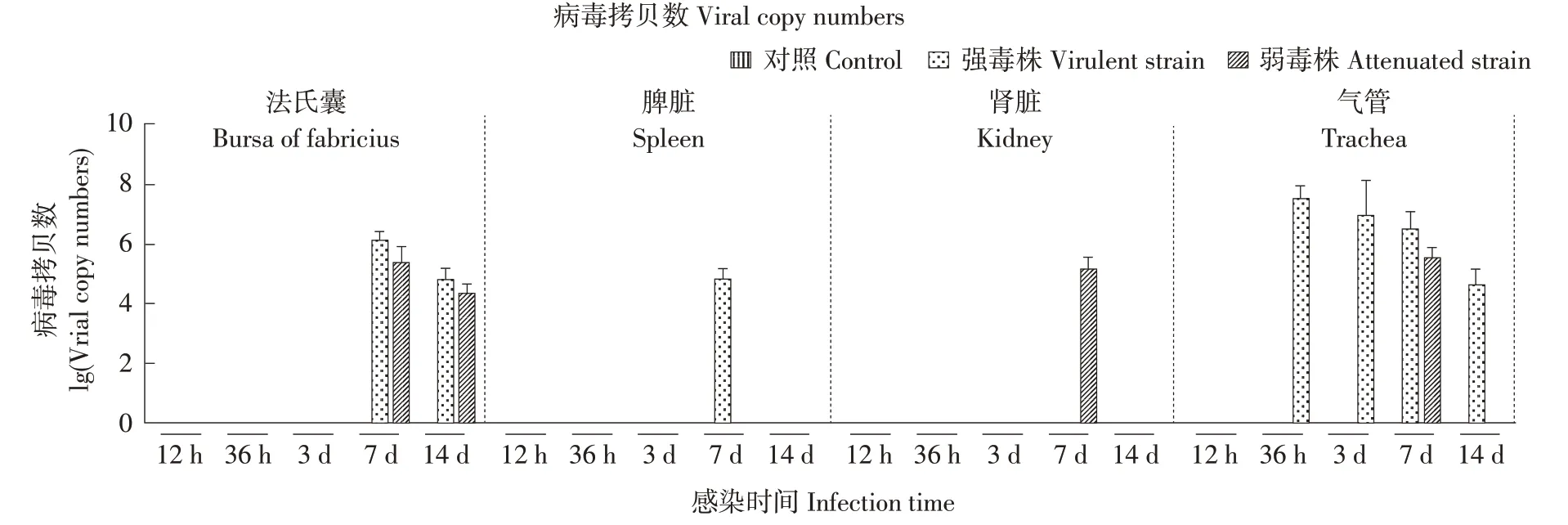
图4 感染不同毒力IBV后鸡各组织病毒载量Fig.4 Viral load in tissues of chickens in response to different virulence IBV infection
2.5 感染不同毒力IBVs 后鸡组织中TLRs 表达量
感染不同毒力IBV 后不同时间SPF 鸡组织TLRs 基因表达差异结果如图5 所示。与对照组相比,TLR7在强弱毒株感染组中法氏囊(12 hpi)和气管(14 dpi)基因表达量显著升高(P<0.05),TLR7在IBV强毒株组中脾脏(3 dpi)基因表达水平显著下调(P<0.05)。与对照组相比,TLR15 在强弱毒株感染组中法氏囊(12 hpi)基因表达水平显著升高(P<0.05),在IBV 弱毒株感染组中法氏囊和肾脏(12 hpi)基因表达水平显著高于IBV 强毒株组(P<0.05),在感染后期,IBV 强毒株诱导TLR15 在法氏囊和脾脏(14 dpi)的基因表达水平显著高于IBV弱毒株(P<0.05)。与对照组相比,TLR21在强弱毒株感染组中法氏囊(3 dpi)、肾脏和气管(14 dpi)的基因表达水平显著升高(P<0.05),IBV强毒株诱导TLR21 在法氏囊和脾脏(14 dpi)的基因表达水平显著高于 IBV 弱毒株(P<0.05),IBV 弱毒株诱导TLR21 在脾脏(3 dpi)的基因表达水平显著高于IBV强毒株(P<0.05)。
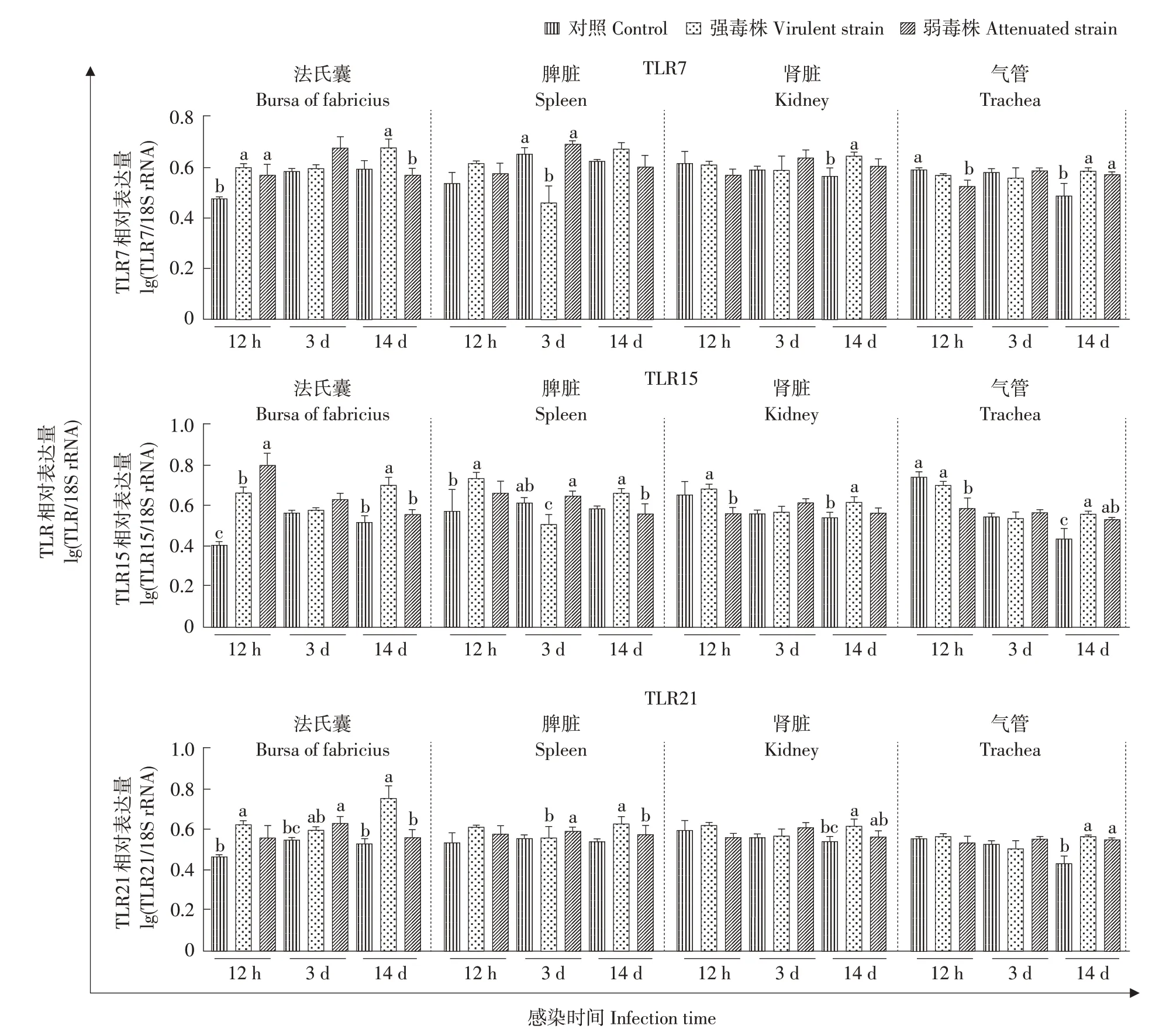
图5 感染不同毒力IBV后鸡各组织中TLR基因相对表达水平变化Fig.5 Relative expression of TLR in the tissue samples of chicken in response to different virulence IBV infection
2.6 感染不同毒力IBVs后鸡组织中信号转导基因的表达量
感染不同毒力IBV后不同时间SPF鸡组织信号转导基因表达水平差异结果如图6所示。与对照组相比,MyD88在两个感染组的法氏囊(12 hpi)基因表达水平显著高于对照组(P<0.05),IBV强毒株诱导MyD88在脾脏(12 hpi)的基因表达水平显著升高(P<0.05)。IBV 强毒株在法氏囊(14 dpi)和肾脏(3 dpi、14 dpi)诱导MyD88基因表达水平显著高于IBV 强毒株(P<0.05)。与对照组相比,P65 在强弱毒株感染组的法氏囊(12 hpi)基因表达水平显著升高(P<0.05),IBV 强毒株诱导P65 在肾脏(14 dpi)的基因表达水平显著升高(P<0.05),IBV强毒株在法氏囊(14 dpi)和肾脏(3 dpi)诱导P65 基因表达水平显著高于IBV 强毒株(P<0.05)。与对照组相比,Rel-B在强弱毒株感染组中法氏囊(12 hpi)基因表达水平显著升高(P<0.05),IBV 强毒株诱导Rel-B在肾脏(14 dpi)基因表达水平显著高于IBV 弱毒株(P<0.05)。C-Rel在强弱毒株感染组的肾脏和气管(14 dpi)的基因表达水平显著升高(P<0.05)。IBV 强毒株诱导C-Rel在脾脏和肾脏(3 dpi)的基因表达水平显著升高(P<0.05),对照组和IBV弱毒株组均未检测到表达。
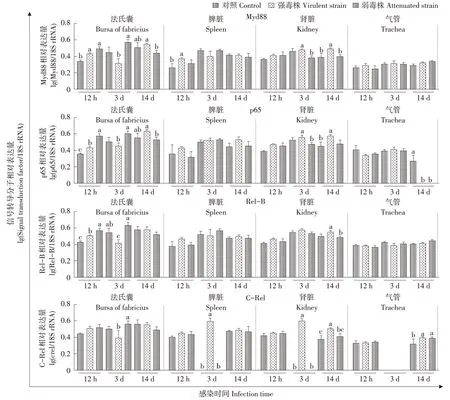
图6 感染不同毒力IBV后鸡各组织中信号转导因子基因相对表达水平变化Fig.6 Relative expression of signal transduction factor in the tissue samples of chicken in response to different virulence IBV infection
2.7 感染不同毒力IBVs后鸡组织中细胞因子的表达量
感染不同毒力IBVs 后不同时间SPF 鸡组织细胞因子表达差异结果见图7。与对照组相比,IL-1β在强弱毒株感染组中法氏囊(12 hpi)和气管(12 hpi、14 dpi)基因表达水平显著升高(P<0.05),其中IL-1β在IBV弱毒株组法氏囊(12 hpi)基因表达水平显著高于对照组和强毒株感染组(P<0.05)。与对照组相比,IL-6在强弱毒株感染组中法氏囊(12 hpi)基因表达水平显著升高(P<0.05)。IL-8在IBV弱毒株组中法氏囊(12 hpi、3 dpi)基因表达水平显著高于对照组和IBV强毒株感染组(P<0.05),在IBV强毒株组中肾脏(3 dpi)的基因表达水平显著高于对照组和IBV弱毒株感染组(P<0.05)。强弱毒株感染组在肾脏(14 dpi)和气管(14 dpi)的IL-8基因均未检测到表达。IBV弱毒株诱导IL-6、IL-8在脾脏(3 dpi)的基因表达水平显著高于IBV强毒株(P<0.05)。
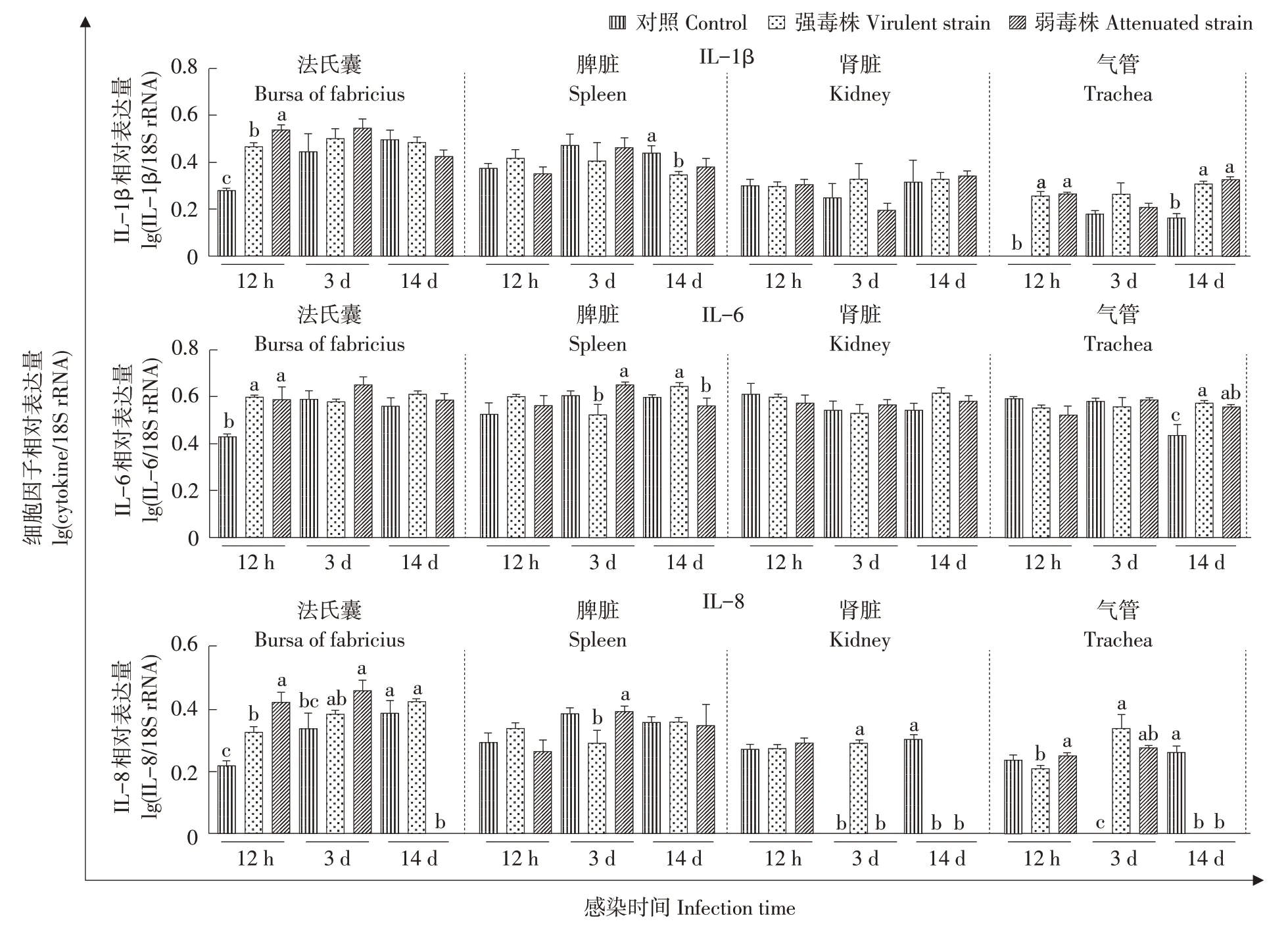
图7 感染不同毒力IBV后鸡各组织中细胞因子基因相对表达水平变化Fig.7 Relative expression of cytokine in the tissue samples of chicken in response to different virulence IBV infection
2.8 感染不同毒力IBVs后鸡组织中获得性免疫相关基因的表达量
感染不同毒力IBVs 后不同时间SPF 鸡组织CD4、CD8基因表达差异结果如图8所示。

图8 感染不同毒力IBV后鸡各组织中获得性免疫因子基因相对表达水平变化Fig.8 Relative expression of specific immune factor in the tissue samples of chicken in response to different virulence IBV infection
与对照组相比,CD4在强弱毒株感染组中法氏囊(12 hpi)基因表达水平显著升高(P<0.05),IBV弱毒株感染组表达更高水平的CD4基因表达(P<0.05),强弱毒株在气管(14 dpi)诱导CD4基因表达水平显著升高(P<0.05),IBV 弱毒株在脾脏(3 dpi)诱导CD4基因表达水平显著高于IBV 强毒株(P<0.05),IBV强毒株在脾脏(14 dpi)诱导CD4基因表达水平显著高于IBV弱毒株(P<0.05)。与对照组相比,强弱毒株感染组在法氏囊(3 dpi)的CD8基因表达水平均显著升高(P<0.05)。IBV 弱毒株诱导CD8 基因在法氏囊(14 dpi)的基因表达水平显著高于IBV 强毒株(P<0.05);CD8基因在IBV弱毒株法氏囊(12 hpi)的基因表达水平显著高于对照组和强毒株感染组(P<0.05)。
3 讨 论
传染性支气管炎严重威胁家禽健康,阻碍养禽业发展。本试验研究发现,IBV 强毒株感染SPF鸡后,出现明显临床症状,死亡率达20%,感染后死亡的SPF鸡剖检可观察到典型IBV诱导的病理变化,但在IBV弱毒株感染SPF鸡后,并无明显临床症状和剖检病理变化,与本研究结果相似。Gao等发现,1 日龄SPF 鸡感染肾型IBV 强毒株后,出现较明显临床症状,发病率100%,死亡率60%[15]。IBV 强毒株和弱毒株感染组14 d 均出现抗体转阳现象,但IBV强毒株组抗体阳性值更高,说明IBV强毒株诱导更强免疫反应。
TLRs 可启动细胞内信号级联反应和产生炎症介质如IL-6和TNF-α[16]。研究发现,感染IBDV 和AIV后,鸡体内TLR15基因表达水平显著上调,启动和诱导免疫反应[2,17]。本研究中,IBV 弱毒株感染前期,可诱导TLR15基因表达上调,与上述研究结果一致,表明IBV 弱毒株感染前期,通过诱导TLR15基因表达启动宿主天然免疫反应。进一步研究发现,在IBV强毒株感染组鸡其法氏囊、脾脏和肾脏的TLR7、TLR15、TLR21基因表达量显著高于IBV 弱毒株感染组鸡。Kapczynski 等发现,强毒株NDV 在禽类体内感染时间更长,可增强机体免疫力并增加免疫持续时间[18],与本研究结果类似,IBV强毒株在感染后期所诱导更强的免疫反应与其自身毒力关系密切,即IBV强毒株毒力更强,感染诱导激活的TLRs种类更多,导致感染后期TLRs表达上调,引起宿主持续免疫反应。
当病原体侵袭激活TLRs 信号后,MyD88 激活NF-κB信号通路,激活天然免疫应答和炎症免疫反应。赵文均研究发现,鸡感染FAdV-4 后TLR1、TLR4、TLR5、TLR15 和 TLR21 主要通过 MyD88 信号通路发挥免疫作用[19]。本研究中,IBV强毒株和IBV 弱毒株均可有效激活MyD88 信号通路,且MyD88 与P65、Rel-B 表达量变化趋势一致。说明其分别在感染前期和后期通过MyD88/P65/Rel-B途径,调控机体天然免疫。上述研究表明,IBV弱毒株和强毒株感染早期均可有效激活包括TLR7、TLR15 和TLR21 在内的天然免疫反应。但在感染早期,IBV 弱毒株相比于强毒株,可更强烈诱导TLR15激活;在感染后期,IBV强毒株可持续诱导活化TLR7、TLR15 和TLR21 信号以维持宿主持续免疫反应。弱毒株因其致病性差异,后期诱导TLR7、TLR15和TLR21活化能力显著减弱。
细胞因子IL-1β、IL-6、IL-8等的表达,在炎症天然免疫反应中发挥重要作用[20]。当天然免疫系统识别体内病原体时,会激活产生细胞因子,引发相应炎症反应,适度炎症反应有助于消除病原微生物。Zhao 等研究发现,当FAdV-4 感染鸡后,感染早期脾脏中IL-1β、IL-6基因表达上调,抑制病毒复制,法氏囊作为重要免疫器官,在病毒感染后期IL-1β、IL-6、IL-8 参与宿主抗病毒反应,快速清除病原体[21]。本研究发现IBV弱毒株在感染早期诱导法氏囊中IL-1β、IL-8 基因高表达,IBV强毒株在感染后期诱导脾脏中IL-6 基因高表达,上述细胞因子在宿主抗IBV感染过程中发挥重要作用。与此同时,在宿主获得性免疫反应过程中,T细胞免疫在禽类感染中发挥重要作用,CD4T细胞可直接产生抗病毒细胞因子,也可提高B 细胞活性,促进细胞毒性CD8T 细胞成熟和增殖[22]。本研究发现,CD4、CD8在强毒株感染鸡脾脏中基因表达量显著高于弱毒株感染;在弱毒株感染鸡法氏囊中CD4、CD8基因表达量显著高于IBV强毒株感染。说明在IBV强毒株感染所激活的获得性免疫反应主要由脾脏调控,弱毒株IBV感染所激活获得性免疫反应主要由法氏囊调控。综上,本研究发现不同毒力传染性支气管炎病毒诱导SPF鸡炎症反应的免疫机制存在差异,且强弱毒株感染宿主所诱导的获得性免疫反应发生由不同免疫器官介导。为进一步揭示IBV强弱毒株的致病性差异及诱导宿主不同免疫反应的激活机理提供新的参考依据。
4 结 论
本研究表明SPF 鸡人工感染IBV 强毒株CK/CH/LDL/140520 和 IBV 弱毒株 γCoV/ck/China/I0718/17后,IBV强毒株比IBV弱毒株诱导更强烈更持久的免疫反应,IBV 强毒株组在感染后期通过TLR7、TLR15、TLR21,IBV 弱毒株组在感染前期通过TLR15 经MyD88 途径活化促炎细胞因子和免疫因子发挥免疫作用,且强弱毒株感染宿主所诱导的获得性免疫反应发生由不同免疫器官介导。

