N-P配体在铱催化不对称烯丙基取代反应中的应用研究进展
孙海宙,鲁轶楠,傅瑶瑶,沈 磊,陆虹艳,蒋 敏
(杭州师范大学材料与化学化工学院,浙江 杭州 311121)
0 引言
不对称合成是有机合成的一个分支,旨在向反应物引入一个或多个手性中心,从而得到不等量的立体异构产物.不对称合成在天然产物全合成和药物合成中具有重要地位,例如2021年南方科技大学李闯创课题组[1]报道了天然抗癌药物紫杉醇的全合成方法,上海中医药大学郑昌武课题组[2]报道了天然产物大叶藤黄醇的全合成方法,2018年四川大学秦勇课题组[3]报道了天然产物Arborisidine四环骨架的不对称合成.

图1 过渡金属催化烯丙基取代反应的区域选择性Fig.1 Regioselectivity of transition metal-catalyzed allylic substitution reactions
不对称烯丙基取代反应作为不对称合成反应的一种,在实现碳碳键和碳杂键的不对称催化合成方面具有重要意义.自Trost课题组[4]于1977年报道钯催化不对称烯丙基反应以来,不对称烯丙基取代反应经过40余年的发展,各类过渡金属如铱[5]、钼[6]、钌[7]、镍[8]、铜[9]等催化不对称烯丙基化反应相继被报道并取得了巨大的成功.其中铱络合物催化的烯丙基不对称取代反应凭借其独特的支链区域选择性(图1),以及相对于其他过渡元素更优异的对映选择性,从而被国内外化学家广泛地关注和研究.
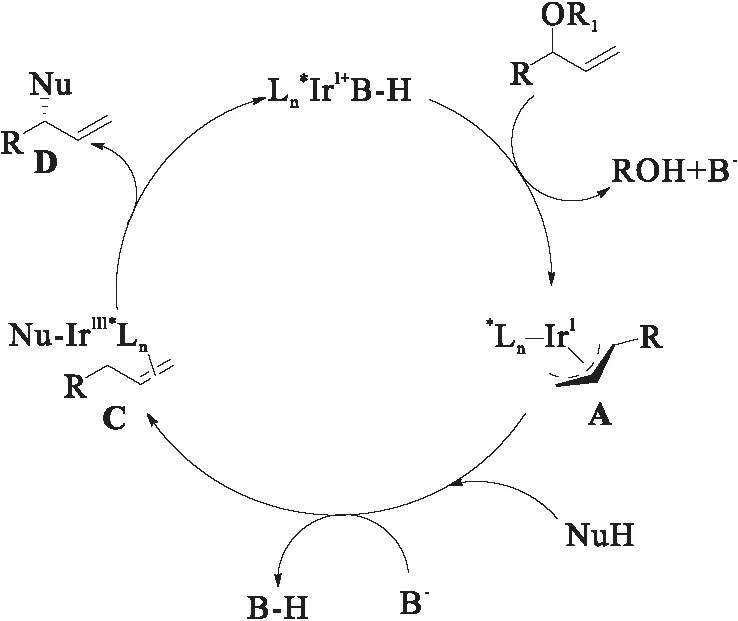
图2 亚磷酰胺配体作用的机理Fig.2 Mechanism of phosphoramidite ligand
自1997年Kashio和Takeuchi首次报道铱不对称烯丙基取代反应以来,凭借其独特的支链区域选择性,被国内外化学家广泛关注和研究.而其不对称化也是一个持续研究的热点.在铱催化的不对称烯丙基化取代反应中,不对称配体是控制立体选择性的主要因素,其中近年来发展起来的亚磷酰胺配体对于铱催化的烯丙基的不对称亲核取代取得了巨大进展.部分亚磷酰胺配体与铱的配合物催化烯丙基不对称亲电取代反应的机理如图2所示:首先在配体L作用下,一价铱在碱的作用下与烯丙醇或烯丙基酯发生金属插入反应,形成π-烯丙基金属络合物中间体A,该中间体A接下来在碱作用下与亲核试剂NuH形成中间体B,最后中间体B发生还原消除得到初始的一价铱催化剂.
基于N-P手性配体在铱催化不对称烯丙基取代的进展,本综述依据亲核试剂发生不同反应的原子,将其分为碳亲核试剂、氮亲核试剂、氧亲核试剂和其他亲核试剂4类进行综述介绍.
1 碳亲核试剂
铱催化的不对称烯丙基烷基化反应是有效构建碳-碳键的方法.碳亲核试剂在铱和手性配体络合形成的催化剂作用下易于进攻烯丙基衍生物,从而生成目标产物.碳亲核试剂的烯丙基取代反应在合成复杂药物和天然产物中间体方面有着积极的意义.例如该类反应在治疗Ⅱ型糖尿病的药物依格列汀中间体的合成[10]中起到了非常重要的作用,如图3所示.

图3 不对称烯丙基取代反应在依格列汀中间体合成中的应用Fig.3 The application of asymmetric allyl substitution in the synthesis of evogliptin intermediates
1.1 甲基亲核试剂
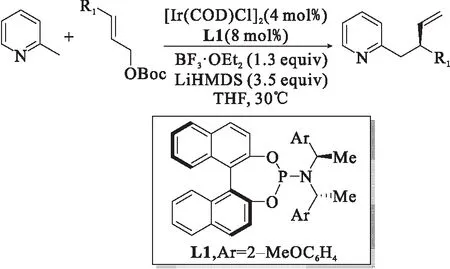
图4 2-甲基吡啶衍生物的铱催化不对称烯丙基烷基化反应[11]Fig.4 Ir-catalyzed asymmetric allyl alkylation of 2-methylpyridine derivatives
2017年,游书力课题组[11]首次报道了2-甲基吡啶衍生物的不对称烯丙基烷基化反应,如图4所示.该课题组以[Ir(COD)Cl]2为催化剂,通过对配体进行筛选,发展了一种手性N-P配体,在最优反应条件下能以71%的产率,97%的ee值实现2-甲基吡啶衍生物的不对称烯丙基烷基化.研究表明:BF3·OEt2试剂能够稳定吡啶上的N原子,增加甲基的酸度以提高碳负离子的稳定性,从而有利于反应的进行.
1.2 亚甲基亲核试剂
2012年,游书力课题组[12]研究不同的N-芳基亚磷酰胺配体与[Ir(cod)Cl]2络合形成催化剂对丙二酸二甲酯钠盐的不对称烯丙基取代反应的影响,如图5所示.研究显示:配体L2相对于其他配体能更好地促进反应的进行,反应的产率可达到99%,区域选择性可达到97/3,ee值为97%;配体中氮上的苯基在该反应中起重要作用,当其被脂肪烃基团取代时会导致产率的下降.这拓展了烯丙基取代反应的底物范围,为烯丙基取代反应机理的理解以及可能的配体设计提供了良好的基础.
1.3 次甲基亲核试剂
2013年,Hartwig课题组[13]报道了吖内酯的不对称烯丙基取代反应,如图6所示.该课题组使用亚磷酰胺配体与[Ir(COD)Cl]2的络合物催化吖内酯进攻烯丙基碳酸甲酯,得到了满意的产率(82%~83%)和对映选择性(84%~94% ee),提供了一种合成相邻叔和季碳中心烯丙基化合物的方法.研究表明:磷酸银盐对反应的产率和ee值都有较大的影响,当反应中没有加入磷酸银盐时,反应的产率和ee值比较低;而在加入磷酸银盐之后产率和ee值得到了较大的提高.
1.4 芳香烃亲核试剂
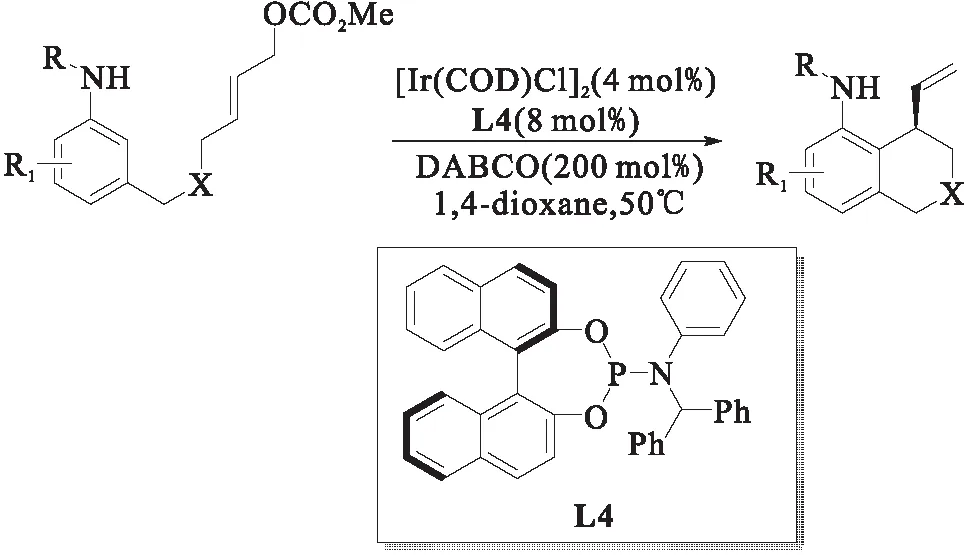
图7 铱催化苯胺衍生物的分子内不对称烯丙基取代反应[14]Fig.7 Ir-catalyzed intramolecular asymmetric allylic substitution of aniline derivatives
2017年,游书力课题组[14]报道了在温和反应条件下铱催化的苯胺类亲核试剂的分子内不对称烯丙基取代反应,如图7所示.该反应可在温和的反应条件下,以良好的产率、优异的对映选择性和区域选择性制得了各种四氢异喹啉-5-胺.值得注意的是,当苯环上引入给电子取代基时,烯丙基取代反应主要发生在邻位且产率良好,对映选择性优异;而在苯环中引入吸电子基团会导致产率下降,但仍保持优异的对映选择性.
同年,钟国富课题组[15]报道了手性铱络合物与磷酸协同催化体系下的2-萘酚不对称脱芳构化烯丙基化反应,如图8所示.该组以良好的收率(51%~87%)和优异的对映选择性(86%~99% ee)合成了一系列具有手性的β-萘酮衍生物.研究表明:手性铱配合物对手性物质的生成起到了关键作用;手性磷酸的存在可以降低反应能垒和提高对映选择性.
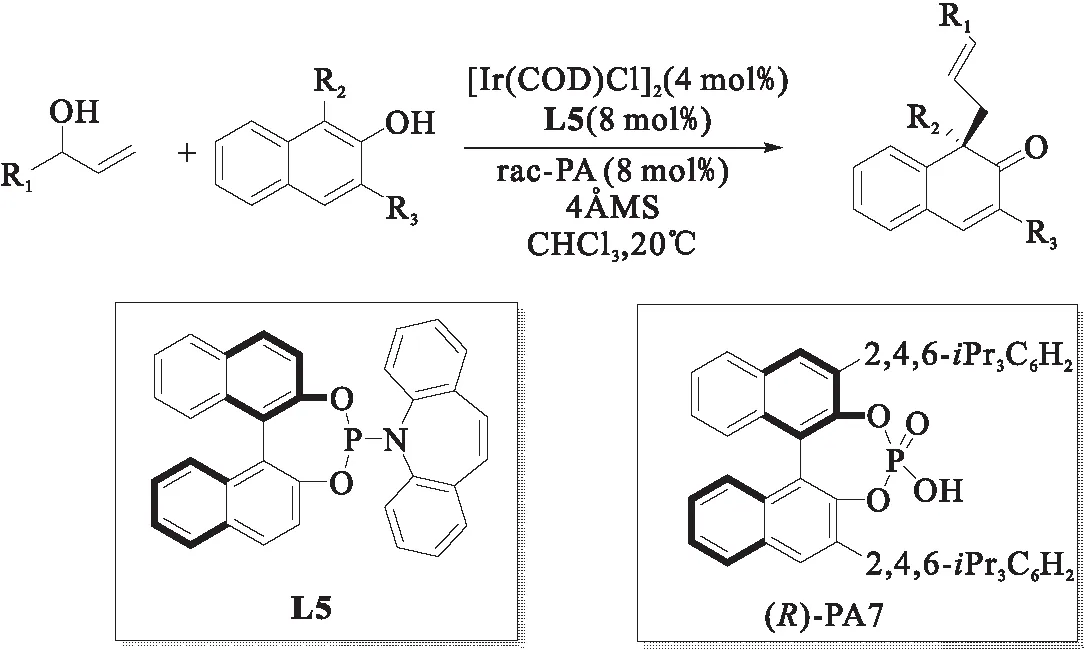
图8 铱催化萘酚的不对称脱芳构化烯丙基化反应[15]Fig.8 Ir-catalyzed asymmetric dearomatization allylation of naphthol
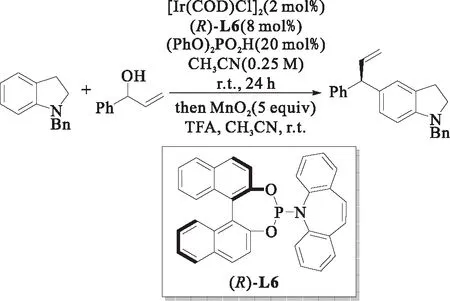
图9 C5-烯丙基吲哚的合成[16]Fig.9 The synthesis of C5-allyl indoles
2021年,钟国富课题组[16]使用N-烷基吲哚啉为亲核试剂,实现了在吲哚C-5位上的烯丙基取代,而后将产物进行氧化便可制得C-5位取代的烯丙基吲哚衍生物,如图9所示.研究表明:当吲哚啉的N位被甲基或苄基取代时能得到对映选择性优异的产物,而当其被乙酰基、Boc、Ts等吸电子基团取代时,反应不能进行,这可能是由于这些底物的亲核性比较低.该工作对于在C-5位上实现烷基化的含有吲哚结构药物合成具有非常重要的意义.
1.5 其他碳亲核试剂
2021年,钟国富课题组[17]报道了4-羟基香豆素及其衍生物的不对称烯丙基烷基化反应,如图10所示.该反应具有条件温和、底物范围广、官能团耐受性好、产率高、选择性好的特点.不论苯环上含有吸电子基团和给电子基团的反应底物均可以达到满意的区域选择性(b∶l>25∶1)和对映选择性(94%~99% ee),当含有给电子基团时可以得到更高的产率.该方法对于制备具有抗HIV活性的非肽源类HIV蛋白酶抑制剂药物有非常重要的研究价值.
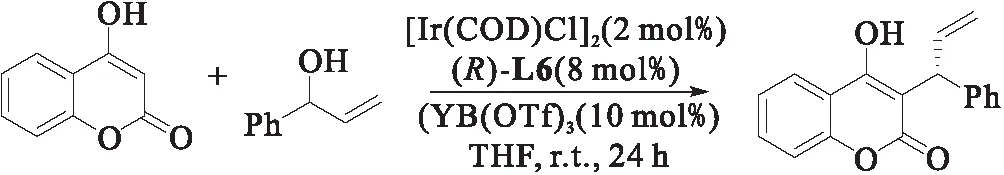
图10 4-羟基香豆素衍生物的铱催化烯丙基取代反应[17]Fig.10 Ir-catalyzed allyl substitution of 4-hydroxycoumarin derivatives[17]
2 氮亲核试剂
手性胺是一种重要的手性化合物,在天然产物、药物、精细化学品等化合物的合成中具有非常重要的地位.因而以简便快捷的方法实现碳-氮键的构筑对于制备含氮生物活性物质及含有α-氮原子的药物具有重要意义[18].铱催化的不对称烯丙基氨基化反应具有反应条件温和、产率高、对映选择性和区域选择性高的特点,能够很好地实现所需的手性胺产物的合成,反应所得的烯丙基胺产物也可作为后续合成反应过程的中间体,可以大大简化目标产物的合成.
2.1 伯胺亲核试剂
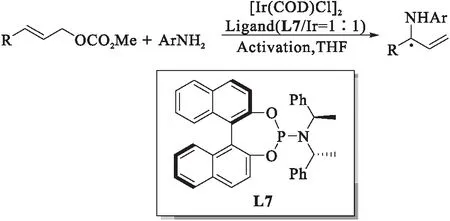
图11 铱催化芳香胺的不对称烯丙基化反应[19]Fig.11 Ir-catalyzed asymmetric allylic reactions of aromatic amines
2004年,Hartwig课题组[19]报道了苯胺的不对称烯丙基氨基化反应,如图11所示.该课题组认为苯胺的碱性不足导致苯胺的不对称烯丙基取代反应无法实现,因而他们向体系中加入一系列添加剂(挥发性伯胺或叔胺),实现了反应的进行.该反应有着反应产率高、区域选择性和对映体选择性高的特点.研究表明:脂肪族碳酸酯的反应速度比芳香族碳酸酯更快,使得部分底物能够在低催化剂负载下进行反应.
2.2 仲胺亲核试剂
2012年,游书力课题组[20]报道了一锅法实现了二氢吲哚N-1位上的不对称烯丙基取代反应,同时对后续产物进行氧化,实现了N-烯丙基吲哚啉的制备,如图12所示.该反应具有良好的产率(76%~92%)和对映选择性(82%~98% ee).相较于Stanley和Hartwig之前通过在吲哚环C-3位置引入吸电子基团,实现了吲哚在铱催化N-1位烯丙基烷基化反应的报道,游书力课题组的工作大大拓展了吲哚底物的范围,以简便、通用的方式实现了高对映选择性的N-烯丙基吲哚产物制备.
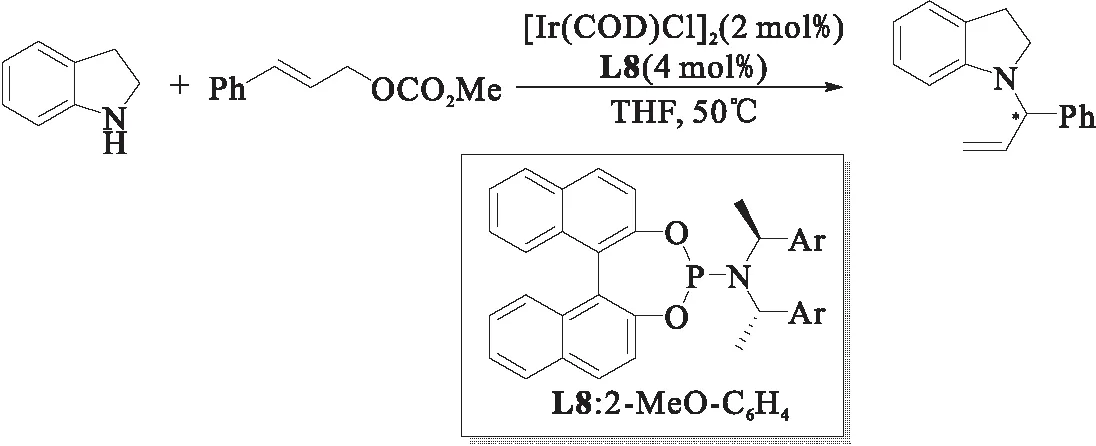
图12 吲哚啉的铱催化烯丙基烷基化反应[20]Fig.12 Ir-catalyzed allylic alkylation of indoline
2.3 酰胺亲核试剂
2007年,Hartwig课题组[21]报道了以三氟乙酰胺的碱金属盐为亲核试剂,[Ir(COD)Cl]2与亚磷酰胺配体的络合物为催化剂的不对称烯丙基氨基化反应,如图13所示.以良好的产率(59%~87%)和对映选择性(92%~98% ee)得到了不对称烯丙基化的产物.所得的产物在温和碱性条件下进行脱保护即可制得单烯丙基氨化合物,克服了氨的直接烯丙基化容易产生二烯丙基化合物的不足.同时研究表明:相较于三氟乙酰胺的锂盐和钠盐,三氟乙酰胺钾盐在反应中的产率更高.
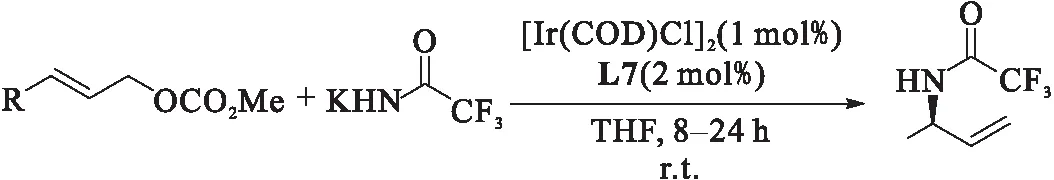
图13 铱催化三氟乙酰胺钾的烯丙基取代反应[21]Fig.13 Ir-catalyzed allyl substitution of potassium trifluoroacetamide
2.4 其他氮亲核试剂
2018年,何英课题组[22]报道了4-羟基吡啶在N位上的烯丙基取代反应,如图14所示.该课题组通过对亚磷酰胺配体、离去基团、碱、溶剂等条件进行筛选,确定在配体为L7、离去基团为OCO2Me、碱为DBU、反应溶剂为THF的条件下,能够制得良好产率和对映选择性的1-烯丙基-4-吡啶酮衍生物.研究表明:芳基上不管是给电子基团、吸电子基团都能得到优异的产率(76%~99%),但当芳基上有强吸电子基取代时(如硝基)会使产率下降(50%);DBU的存在会使烯丙基取代产物异构化为丙烯基产物;进一步对1-烯丙基-4-吡啶酮衍生物修饰可以得到一系列天然产物或具有生物活性的化合物.
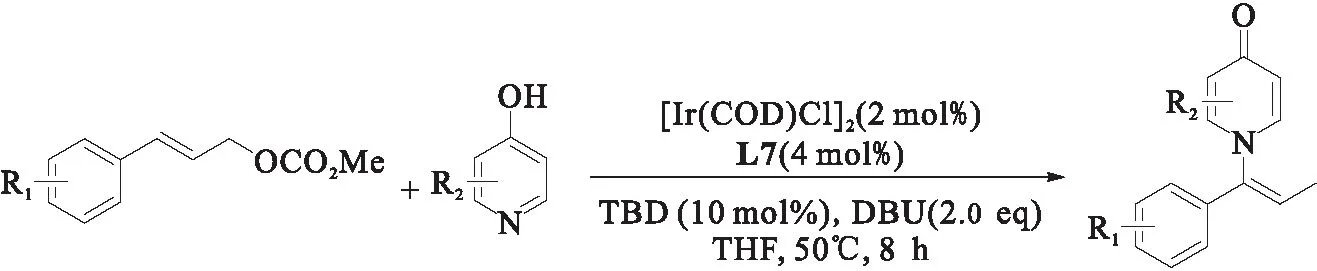
图14 铱催化烯丙基取代反应合成4-吡啶酮衍生物[22]Fig.14 Ir-catalyzed allyl substitution reaction for the synthesis of 4-pyridone derivatives
3 氧亲核试剂
手性醚化合物广泛存在于具有生物活性的药物分子和天然产物之中,是不对称催化合成反应的重要研究方向之一.铱催化的烯丙基取代反应克服了传统方式合成手性醚化合物中立体选择性差、反应条件苛刻的局限,为手性醚化合物的合成提供了一种反应条件温和、收率和立体选择性良好的方法,对于药物分子和天然产物的合成具有重要意义.
3.1 苯酚盐亲核试剂
2002年,Fernando课题组[23]报道了γ-取代烯丙基碳酸甲酯/乙酯与苯酚盐的不对称烯丙基取代反应,如图15所示.实验表明,苯酚盐作为亲核试剂的性能优于酚与有机碱的结合;溶剂对反应的速率、区域选择性和对映选择性有较大的影响,其中THF的效果最好.同时相对于苯酚钾和苯酚钠(产率40%~78%,92%~94% ee),碱性较低的苯酚锂有着最高的产率(86%)和对映选择性(96% ee).

图15 铱催化的酚盐烯丙基取代反应[23]Fig.15 Ir-catalyzed allyl substitution of phenoxides
3.2 醛、酮亲核试剂
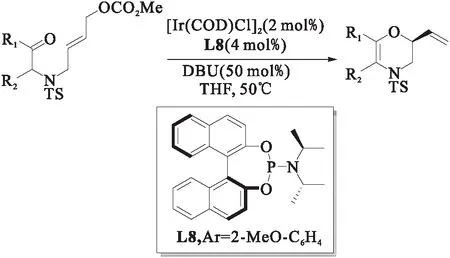
图16 酮和醛在铱催化的烯丙基取代反应中作为O-亲核试剂[24]Fig.16 Ketones and aldehydes as o-nucleophiles in ir-catalyzeda allylic substitution
2019年,游书力课题组[24]以醛和酮作为亲核试剂,合成了一系列手性2H-1,4-噁嗪骨架,如图16所示,收率高达94%,ee值为99%.研究表明:当K2CO3用作碱时,能使对映选择性更高(97% ee),但产率略低(65%);而当DBU用作碱时,能得到满意的产率(89%)和对映选择性(94% ee).该反应不仅可以实现克级规模的制备,同时当催化剂的用量低到0.5% mol 时,依然有良好的催化效果.该方法在(+)-chelonin A的对映选择性合成中得到了应用.
3.3 羧酸亲核试剂
2021年,唐生表课题组[25]报道了一种以游离羧酸为亲核试剂,铱催化外消旋仲烯丙基醇的不对称烯丙基酯化反应的方法,如图17所示.该方法反应条件温和,官能团耐应性好,具有良好的区域选择性和对映选择性.通过对添加剂、溶剂、配体进行筛选,发现在DCM为溶剂、HBr为添加剂、配体L9的条件下能达到较高产率(65%~81%)和极佳的对映选择性(93%~99% ee).实验结果表明:HBr的使用起到了非常重要的作用,有效提升了产率和对映选择性.

图17 铱催化的羧酸烯丙基取代反应[25]Fig.17 Iridium-catalyzed allyl substitution of carboxylic acids[25]
4 其他杂原子亲核试剂
除了被广泛报道的铱催化烯丙基取代反应实现手性碳、手性胺、手性醚、手性酯等化合物的合成之外,以其他元素为亲核试剂的铱催化烯丙基反应也有报道,例如硫、硒、氟等.具有手性碳-硫键、碳-硒键、碳-氟键的有机化合物具有独特的理化性质,其化合物在药物化学和有机合成中具有相当重要的作用.
4.1 苯硫醇钠亲核试剂
2012年,赵晓明课题组[26]报道了以[Ir(COD)Cl]2与配体络合的络合物为催化剂,催化γ-取代烯丙基碳酸酯与2-氨基苯硫醇钠的烯丙基取代反应,如图18所示,实现了手性C—S键的构建.研究表明:当苯环上有给电子基团或吸电子基团时,都能够以良好的产率,优异的区域选择性和对映选择性得到相应的支链产物;同时相较于DABCO、Cs2CO3,添加物KOAc能够使产物的产率和ee值都有所提高.
4.2 苯硒酚亲核试剂
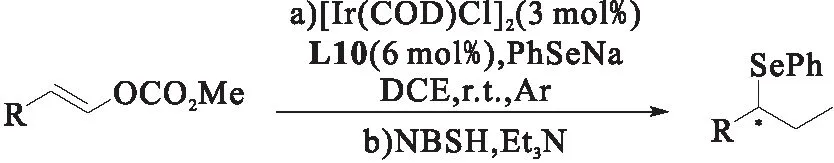
图19 苯基硒化钠的不对称铱催化烯丙基化反应[27]Fig.19 The asymmetric ir-catalyzed allylation of sodium phenyl selenide
同年,赵晓明课题组[27]还报道了以[Ir(COD)Cl]2与配体络合的络合物为催化剂,催化γ-取代烯丙基碳酸酯与苯基硒化钠的烯丙基取代反应,如图19所示,之后再使用邻硝基苯磺酰基肼(NBSH)进行还原,防止支链产物转化为线性产物,从而得到乙基取代的苯基硒化物,实现了手性C—Se键的构建.研究发现:在烯丙基碳酸酯的苯环上的取代基团不管是吸电子还是给电子基团都能获得良好的产率(51%~74%);DCE相较于THF、DCE、甲苯等溶剂能达到理想的产率和区域选择性.
4.3 Et3N•3HF亲核试剂
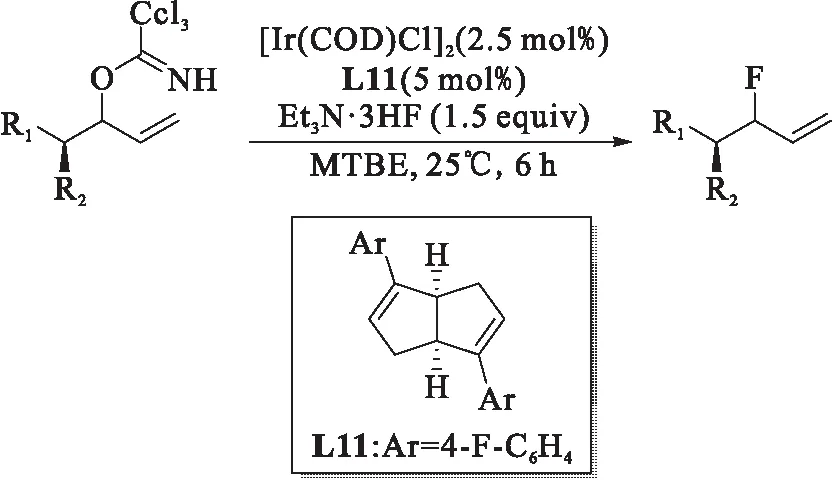
图20 铱催化区域选择性烯丙基氟化反应[28]Fig.20 Ir-catalyzed regioselective allylic fluorination
2017年,Hien M. Nguyen课题组[28]报道了以Et3N•3HF为亲核试剂、烯丙基三氯乙亚氨酸酯衍生物为底物的烯丙基取代反应,如图20所示,以良好的收率、出色的区域选择性和对映选择性成功制备了一系列支链烯丙基氟化物.研究表明:在该反应中,配体的苯环上连有吸电子基团相较于给电子基团,虽然无法提高产率,但能显著提高ee值.该工作对于合成含有烯丙基氟代物结构的生物活性分子具有积极的意义.
5 结论与展望
不对称烯丙基取代反应经过二十多年的发展,其铱催化的不对称烯丙基取代反应具有反应条件温和、底物范围广泛、产率良好、对映选择性和区域选择性优异的特点,能够简便地合成一系列所需的手性目标化合物,从而被广泛地应用于有机合成和药物合成之中.其中[Ir(COD)Cl]2金属与配体络合形成配合物重要的活性中心,在该反应中起到了非常重要的作用,配体的选择对于反应催化效率影响非常大.当前对N-P配体之外的其他配体的相关研究报道[29]比较少,因此,发展能够满足绝大多数乃至全部铱催化烯丙基取代反应、具有高催化效率、价格低廉的配体是接下来该反应的研究重点之一.对于不对称烯丙基取代反应来说,反应底物往往是烯丙基醇或者相关的酯,这大大限制了底物的适用性.近年来光催化、电催化等领域取得巨大的发展,其中光催化与电催化都能高效、高选择性活化烯丙位C—H键,得到相应的高反应活性的烯丙基自由基,结合铱催化不对称烯丙基化的发展,将大大拓展该领域的底物范围和反应普适性.

