bta-miR-1343-3p靶向NEDD8调控牛卵泡颗粒细胞增殖与凋亡机制初探
马晓燕,郭翔宇,贾凯琪,成 颖,吕丽华
(山西农业大学 动物科学学院,山西 太谷 030801)
在哺乳动物生殖过程中,颗粒细胞的增殖和凋亡在卵子发生、卵泡发育和闭锁中起到至关重要的作用。卵泡发育是一个有序复杂的过程,受到下丘脑-垂体-性腺轴的调控,并呈现周期性变化[1-2]。生长卵泡发育至有腔卵泡之前不依赖促性腺激素,有腔卵泡的发育则依赖促性腺激素的作用,同时受到卵母细胞—颗粒细胞—膜细胞三者的协同调控[3]。卵泡生长过程中卵母细胞以自分泌和旁分泌的方式与卵泡生态体系中的体细胞共同发挥作用,影响卵泡发育进程,并决定其最终命运。颗粒细胞是卵泡体系中数量最多的体细胞,在卵泡发育过程中发挥了至关重要的作用[4]。雌性哺乳动物从早期胚胎性腺发育到性成熟过程中,大量卵泡闭锁,调控卵泡闭锁的机制错综复杂,调控过程中的些许偏差都会导致卵泡发育阻滞和闭锁。雌性哺乳动物在生命早期形成的卵巢储备是相对固定的,卵子储备量随着动物排卵而不断减少。随着生存环境的改变,越来越多的哺乳动物包括人类都面临着由于卵泡生长调节异常导致的卵巢早衰致使生育年限缩短,因此,研究卵泡闭锁的发生机制将进一步解开卵泡闭锁的未解之谜。
目前,研究尚未揭开胚胎期卵泡闭锁的发生机制,而生长期卵泡闭锁的主要原因可归结为颗粒细胞过度凋亡[5-6]。miRNA是一种内源的非编码小RNA,目前,在人类中已鉴定出数百种 miRNAs[7-8]。由于这些miRNAs序列在不同哺乳动物间高度保守,因此,可推测哺乳动物体内绝大多数与发育和疾病相关的事件均与miRNAs的调控有关[9]。成熟的miRNA可与其靶基因的3′UTR结合并发挥调控作用[9],此外,miRNA可直接与蛋白质相互作用调控基因翻译过程[10]并影响表观遗传机制[11],也可通过抑制DNA转录或破坏mRNA分子的稳定性实现对靶基因的负调控[12]。哺乳动物中,30%以上的蛋白质编码基因受到miRNAs的调控[13]。目前,在雌性哺乳动物生殖领域对miRNA的研究主要与卵泡发育有关,如颗粒细胞增殖、凋亡和类固醇激素分泌等方面。
TU等[14]研究发现,miRNAs在卵母细胞、颗粒细胞、膜细胞和卵泡液中广泛表达。从原始卵泡形成,卵巢储备建立到初情期卵泡在促性腺激素作用下开始发育再到最终排卵,大量的miRNAs参与了上述过程[14-15]。近年来研究发现,多种miRNAs参与了颗粒细胞调控。ZHANG等[16]研究发现,miR-17-5p可通过靶向调控E2F转录因子1(Transcriptional factor,E2F1)可影响猪卵泡颗粒细胞的功能,在猪卵泡颗粒细胞中过表达miR-17-5p显著降低了转录因子E2F1的活性,促进了颗粒细胞生长和激素合成过程。蒋秀敏等[17]研究发现,miR-483-5p可通过调控细胞外信号调节激酶(Extracellular regulated protein kinases,ERK)的表达调控人卵泡颗粒细胞增殖和凋亡过程以及丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)在各种细胞反应中的作用[18]。
本研究基于前期在牛卵泡颗粒细胞中开展的全转录组测序结果,选择bta-miR-1343-3p为研究对象,进一步研究其在颗粒细胞增殖和凋亡中的调控作用,旨在初步揭示哺乳动物卵泡闭锁的调控机制。
1 材料和方法
1.1 试验材料
本研究所用的牛卵巢均来自山西省吕梁市文水县屠宰场,采集后采用75%酒精消毒并保存于4 ℃ DPBS中,2 h内运回实验室。
1.2 主要试剂
DMEM/F12基础培养基(HyClone公司,美国),胎牛血清(FBS)(赛澳美细胞(技术)有限公司,北京),无菌PBS缓冲液(博士德生物,武汉),MTT试剂盒(博士德生物,武汉),Lipofectamine 3000(Invitrogen公司,美国),E.Z.N.A.®Plasmid mini Kit I(Omega BioTek,美国),Mut Express II Fast Mutagenesis Kit(南京诺唯赞生物科技有限公司,武汉),Dual-Luciferase Reporter Assay System(Promega Co. Ltd,美国),ClonExpress®Ultra One Step Cloning Kit(南京诺唯赞生物科技有限公司,武汉),bta-miRNA-1343-3p模拟物与抑制物(汉恒生物科技有限公司,上海),2×Es Taq Master Mix(Dye)(康为世纪生物科技有限公司,江苏)。
1.3 卵泡颗粒细胞的收集与培养
采用眼科剪分离卵巢皮质中的有腔卵泡。将卵泡用眼科剪剪开,用细胞刮刀轻轻刮取卵泡内壁获取颗粒细胞并收集卵泡液,1 000 r/min下离心5 min,弃上清。得到的细胞沉淀用新鲜无菌PBS重悬,1 000 r/min下再离心3次,每次5 min,清洗沉淀中的血细胞等杂质。清洗后的细胞沉淀用完全培养基(含10%的FBS和双抗)重悬,置于10 cm细胞培养皿中,37 ℃、5% CO2下培养24 h后观察细胞状态和密度,更换新的完全培养基,待细胞密度达到80%~90%时传代培养。
1.4 靶基因预测
对高通量测序结果进行靶基因筛选分析,结合测序结果,进一步使用TargetScan(TargetscanHuman 7.1:predicted miRNA targets of miR-1343-3p)和miRanda(miRDB-miRNA Target Prediction Database)筛选bta-miR-1343-3p的靶基因。最终选择与卵泡颗粒细胞存活相关的基因NEDD8,使用RNA Hybird分析bta-miR-1343-3p与NEDD8基因UTR的结合位点。
1.5 NEDD8基因3” UTR双荧光素酶报告载体的构建
根据NCBI网站公布的牛NEDD8基因mRNA序列,寻找NEDD83” UTR的靶点位置。采用Primer 5.0设计NEDD83” UTR扩增引物,并在引物上下游加入酶切位点与双荧光素酶报告载体的同源序列。进一步使用CE Design软件(南京诺唯赞生物科技有限公司)设计同源重组及突变引物序列,如表1所示。颗粒细胞收集,RNA提取与反转录程序参考之前的研究[19]。以牛卵泡颗粒细胞cDNA为模 板 ,使 用 2×Es Taq Master Mix(Dye)扩 增NEDD8基因3” UTR,具体步骤参考之前的研究[20],PCR产物采用2%琼脂糖凝胶电泳鉴定,目的片段回收纯化后测序鉴定序列准确性。

表1 bta-miR-1343-3p荧光定量PCR引物序列Tab.1 Primer sequences for qRT-PCR of bta-miR-1343-3p
将目的片段与线性化的pmir-GLO载体用同源重组酶连接,具体步骤按照ClonExpress®Ultra One Step Cloning Kit说明书(南京诺唯赞生物科技有限公司,武汉)进行,重组产物转化感受态细胞。经转化的感受态细胞短暂离心后涂布到LB固体培养基上(含氨苄青霉素),37 ℃过夜培养,挑取单个菌落摇菌测序。将测序结果正确菌液进一步培养,使用E.Z.N.A.®Plasmid Mini Kit I提取质粒DNA,获得野生型重组质粒。
突变型双荧光素酶报告载体的构建采用Mut Express II Fast Mutagenesis Kit(南京诺唯赞生物科技有限公司,武汉)进行3” UTR miRNA预测靶点的突变,以连接成功的野生型载体为模板,使用点突变引物引入报告载体序列突变。突变质粒经PCR扩增,重组酶重组后转化感受态细胞,挑选单克隆菌株培养后测序,测序验证正确的菌液进一步培养质粒DNA,获得突变型质粒。
1.6 双荧光素酶活性检测
将293T细胞接种至24孔细胞培养板中,培养6~12 h,待细胞汇合度达到60%后转染。试验组分为3组:(I)wt载体+mimics NC,wt载体+mimics;(II)mut载体+mimics NC,mut载体+mimics;(III)空载体+mimics NC,空载体+mimics。将上述载体质粒 800 ng和 50 μm mimics使用 Lipofectamine 3000共转染293T细胞,反应6 h后更换培养基,继续培养48 h,检测293T细胞的双荧光素酶活性。转染48 h的293T细胞用无菌PBS清洗后加入100 μL 1×PLB,室温下裂解 15 min,吸取 20 μL 裂解液至96孔酶标板,加入100 μL LARⅡ后迅速在酶标仪中检测萤火虫荧光素酶活性,检测完毕后立即加入100 μL终止液,检测海肾荧光素酶的活性。
1.7 卵泡颗粒细胞中bta-miR-1343-3p mimics和inhibitors的转染
将卵泡颗粒细胞均匀接种于12孔细胞培养板中,培养6~12 h,待细胞汇合度达到60%时采用Lipofectamine 3000转染bta-miR-1343-3p mimics和inhibitors,6 h后更换完全培养基,继续培养48 h。试验组与对照组详细引物序列如表2所示。

表2 bta-miR-1343-3p 模拟物与抑制物序列Tab.2 Sequences for bta-miR-1343-3p mimics and inhibitors
1.8 MTT法检测颗粒细胞增殖率
将卵泡颗粒细胞均匀接种至96孔板,培养6~12 h。当细胞汇合度达60%时采用Lipofectamine 3000转染 bta-miR-1343-3p mimics和 inhibitors,继续培养24、48、72 h后移除培养液。每孔加90.0 μL的新培养基和10 μL MTT,37 ℃恒温培养箱内继续培养4 h,再次移除培养液,加入110.0 μL的Formazan溶解液,避光孵育15 min,490 nm波长下测定吸光值。
1.9 qRT-PCR
使用Primer 5.0设计qRT-PCR引物。其中,miRNA下游引物为M5 miRNA qPCR Assay Kit中自带引物,序列如表3所示。mRNA实时荧光定量流程按照TB GreenTMPremix Ex Taq TMⅡ试剂盒详细步骤进行。miRNA荧光定量使用M5 miRNA qPCR Assay Kit进行,反应体系为:cDNA 1.0 μL,M5 miRNA qPCR Mixture(2×)10.0 μL,bta-miR-1343-3p Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,加 ddH2O 20.0 μL。反应程序为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60.5 ℃ 1 min,45个循环;95 ℃ 15 s。

表3 荧光定量PCR引物序列Tab.3 Primer sequences of qRT-PCR
1.10 数据分析
miRNA实时荧光定量数据的处理以U6作为内参基因,采用2-ΔΔCt法计算miRNA相对表达量;靶基因表达量检测采用RPLP0作为内参基因,MTT 结果采用式(1)计算。

双荧光素酶报告基因检测数据以萤火虫荧光素酶的荧光强度与海肾荧光素酶的荧光强度比值作为荧光值。数据采用平均值±标准差表示,所有试验均重复3次,经SPSS 22.0进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 bta-miR-1343-3p靶基因预测结果
采用miRanda软件预测bta-miR-1343-3p的靶mRNA,为进一步证实预测的准确性,采用TargetScan、miRDB软件对miRanda预测结果进行验证,结合2个软件预测结果发现,NEDD8基因的3” UTR存在bta-miR-1343-3p的种子区结合位点(图1),RNA hybrid结果如图2所示。
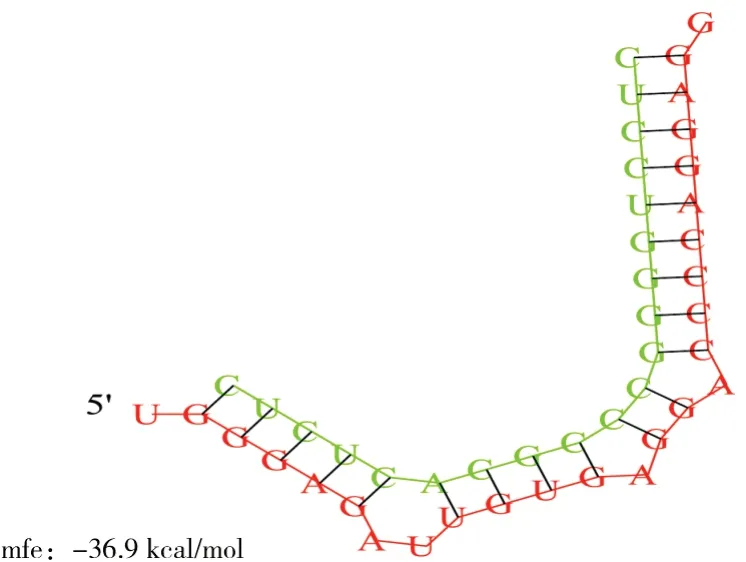
图1 bta-miR-1343-3p与NEDD8 mRNA 3'UTR 结合位点Fig.1 Binding sites between bta-miR-1343-3p and NEDD8 mRNA 3'UTR

图2 bta-miR-1343-3p与NEDD8 mRNA 3'UTR的杂交位点Fig.2 Hybridization site of bta-miR-1343-3p and 3'UTR of NEDD8 mRNA
2.2 双荧光素酶报告基因检测结果
双荧光素报告检测结果如图3所示。
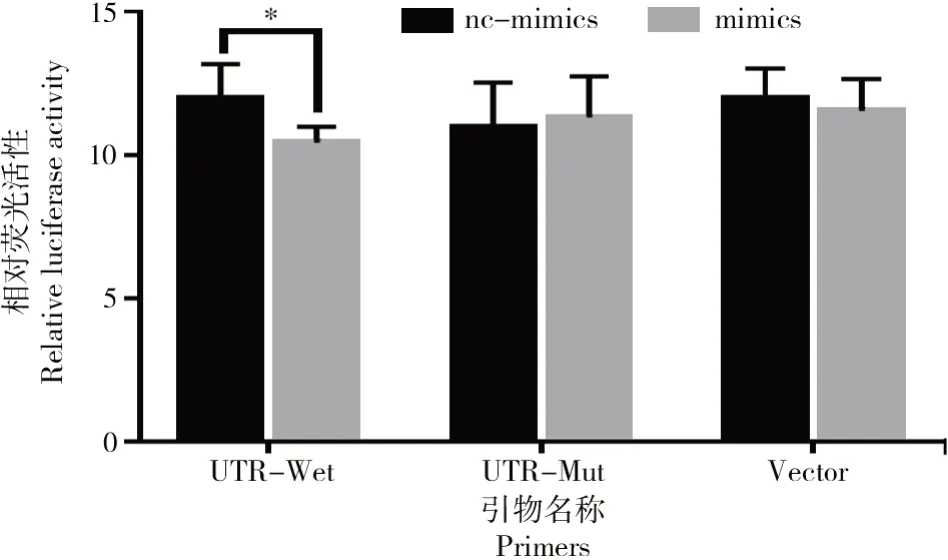
图3 双荧光素报告检测结果Fig.3 Results of dual luciferase reporter assay
共转染双荧光素酶报告基因载体与和bta-miR-1343-3p mimics后检测细胞内萤火虫荧光素酶和海肾荧光素酶的活性,结果表明(图3),在野生型报告载体+mimics组中,与对照组相比,bta-miR-1343-3p mimics组的荧光素酶活性显著低于对照组(P<0.05),而其他组中荧光素酶活性无显著差异。
2.3 bta-miR-1343-3p对卵泡颗粒细胞增殖的影响
在卵泡颗粒细胞中转染bta-miR-1343-3p mimics以及抑制物(inhibitors)并采用MTT法检测细胞增殖情况,结果如图4所示。
从图4可以看出,颗粒细胞中转染mimics后24、48、72、96 h后细胞增殖率显著下降(P<0.05);转染inhibitor后,细胞增殖率相比对照组显著上升(P<0.05)。
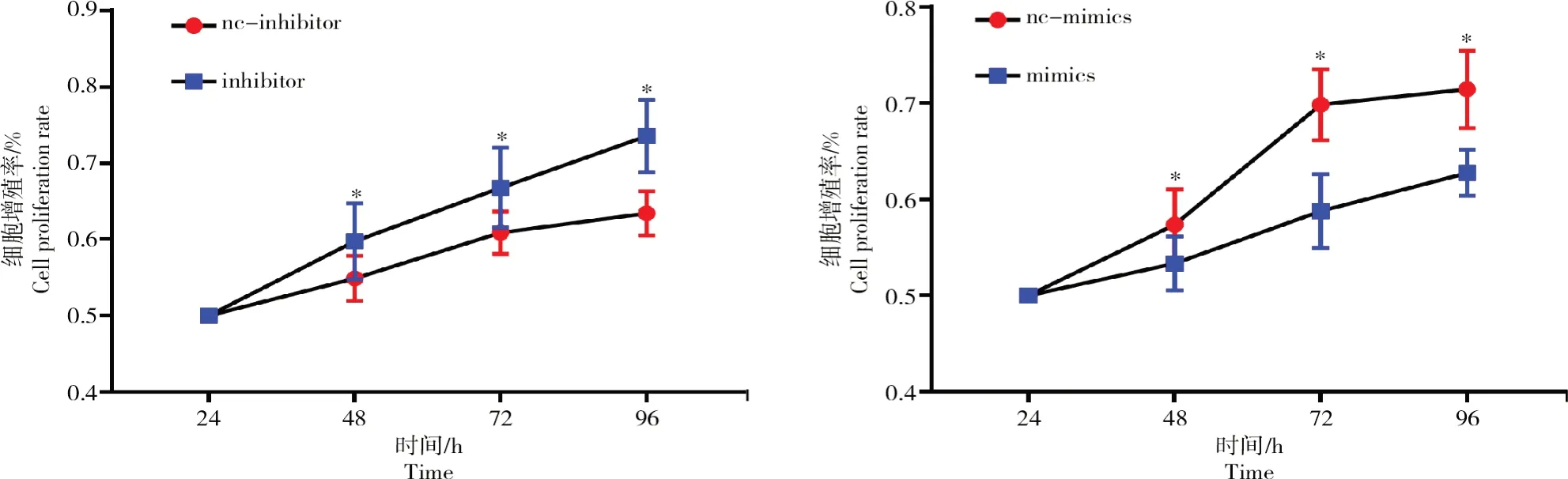
图4 bta-miR-1343-3p对牛卵泡颗粒细胞增殖率的影响Fig.4 Influences of bta-miR-1343-3p on proliferation rate of bovine follicular GCs
2.4 bta-miR-1343-3p对卵泡颗粒细胞增殖与凋亡相关基因的影响
在牛卵泡颗粒细胞中转染bta-miR-1343-3p mimics和inhibitors后bta-miR-1343-3p结果如图5所示。
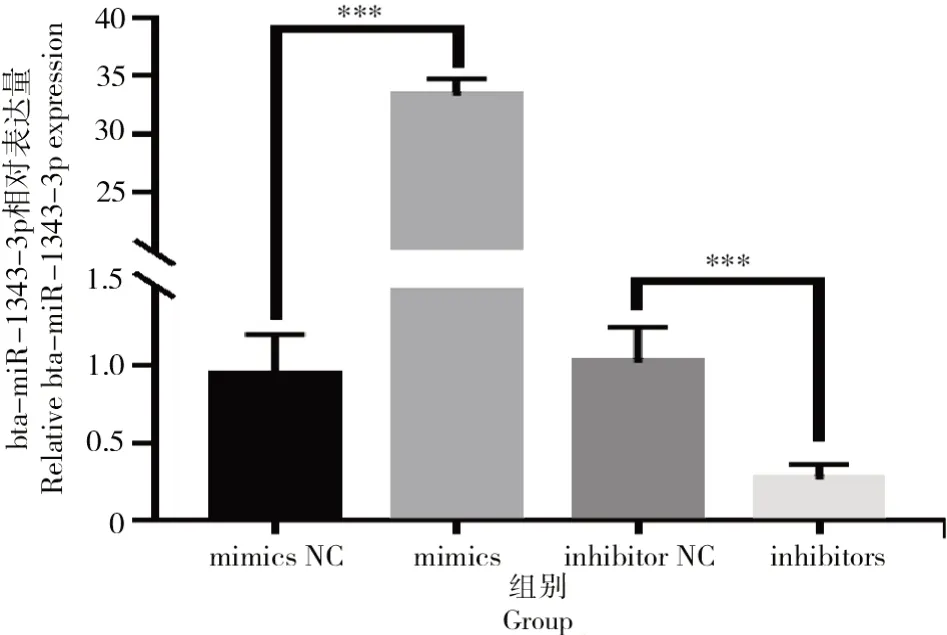
图5 转染mimics与inhibitors之后bta-miR-1343-3p相对表达量Fig.5 Relative expression level of bta-miR-1343-3p after mimics and inhibitors transfection
由图5可知,与NC相比,mimics组中bta-miR-1343-3p的表达量极显著高于对照组(P<0.001);转染 inhibitors后,相比对照组,试验组中bta-miR-1343-3p表达量极显著下降(P<0.001)。
采用qRT-PCR检测转染bta-miR-1343-3p mimics和inhibitors后,卵泡颗粒细胞中NEDD8基因的表达情况如图6所示。

图6 转染mimics与inhibitors之后NEDD8相对表达情况Fig.6 Relative expression level of NEDD8 after mimics and inhibitors transfection
由图6可知,相比对照组,转染mimics的细胞中NEDD8基因的表达量极显著下降(P<0.01),而转染inhibitors细胞的NEDD8基因的表达量显著上升(P<0.05)。
按照上述方法对细胞增殖与凋亡相关基因进行表达量的验证,结果如图7所示,转染bta-miR-1343-3p mimics和inhibitors后,细胞周期相关基因CDK1与CDK4在过表达bta-miR-1343-3p后表达量显著下降(P<0.05);相反,抑制bta-miR-1343-3p表达后,CDK1与CDK4基因的表达量显著上升(P<0.05)。检测细胞凋亡相关基因Bax与Fas后发现(图8),过表达bta-miR-1343-3p后Bax表达量显著上升(P<0.05),Fas表达量升高但差异不显著,但在抑制bta-miR-1343-3p表达后,试验组中Bax与Fas表达量均极显著下降(P<0.01)。
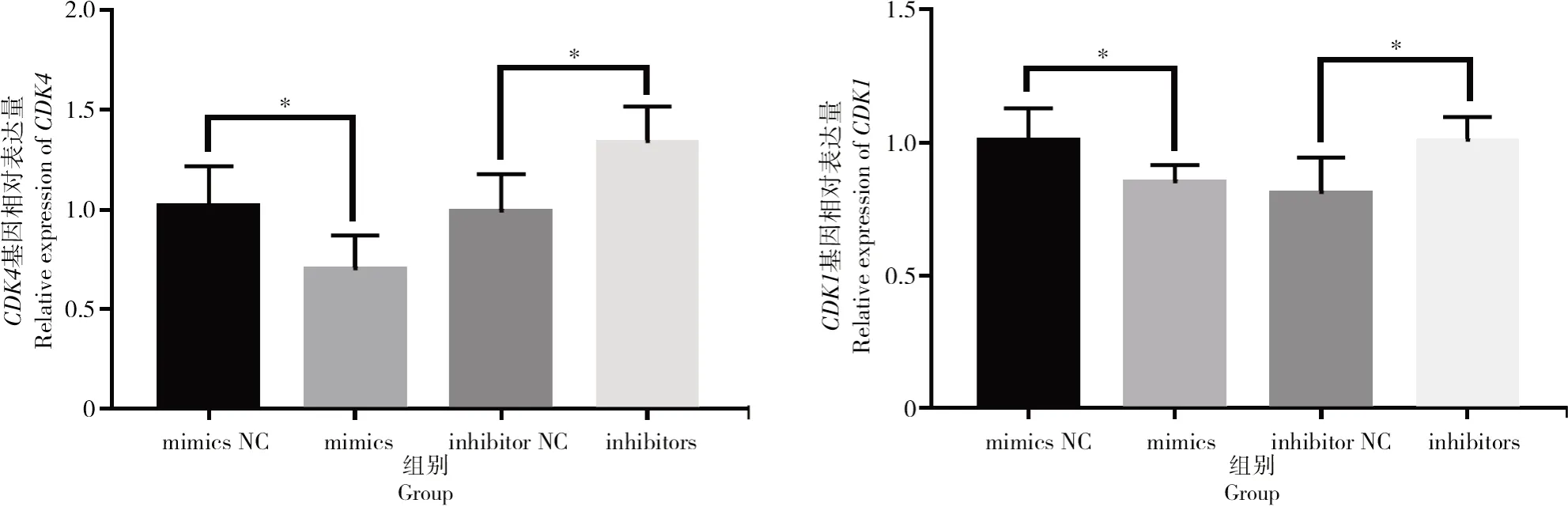
图7 转染mimics与inhibitors后细胞周期相关基因CDK1和CDK4的相对表达情况Fig.7 Relative expression level of cell cycle-related genes CDK1 and CDK4 after mimics and inhibitors transfection

图8 转染mimics与inhibitors后凋亡相关基因的相对表达情况Fig.8 Relative expression level of apoptosis-related genes after mimics and inhibitors transfection
3 结论与讨论
腔前卵泡的生长不依赖促性腺激素,而有腔卵泡的生长依赖FSH和LH[21-23]。卵泡生长过程中健康的卵母细胞以自分泌和旁分泌方式与卵泡生态体系中的颗粒细胞共同发挥作用,影响卵泡发育进程,并影响卵泡的最终命运。因此,本研究主要围绕有腔卵泡中bta-miR-1343-3p对卵泡颗粒细胞的影响开展,分离卵巢皮质中大小为4~8 mm的生长期有腔卵泡并进行体外培养。
采用miRanda软件对bta-miR-1343-3p的靶位点进行预测,发现其与NEDD8基因mRNA的3” UTR存在潜在的结合位点,bta-miR-1343-3p成熟序列在人和小鼠中完全保守。进一步采用TargetScan和miRDB数据库预测bta-miR-1343-3p的靶基因并得到相同的结果,因此,认为预测结果准确。成熟的miRNA可与Argonaute蛋白组装成miRNA诱导的沉默复合物(miRISC),并通过miRNA种子区域(2~8位核酸互补配对)和mRNA 3” UTR内的互补位点之间的配对与靶标mRNA结合[24],NEDD8mRNA与bta-miR-1343-3p RNA的分子杂交图显示,二者间存在靶向关系。通过构建NEDD8mRNA 3” UTR的双荧光素酶野生型载体以及种子区突变型载体,转染293T细胞后证实了bta-miR-1343-3p与NEDD8基因之间存在靶向关系。将bta-miR-1343-3p mimics与inhibitors转染至牛卵泡颗粒细胞中后,发现btamiR-1343-3p表达量极显著上升,而转染抑制物后bta-miR-1343-3p表达量极显著下降,证明可将bta-miR-1343-3p在卵泡颗粒细胞中过表达与沉默同时发现bta-miR-1343-3p在颗粒细胞中过表达后,NEDD8表达量显著降低。表明bta-miR-1343-3p与NEDD8基因之间存在负调控作用,btamiR-1343-3p在颗粒细胞中可通过调节NEDD8基因的表达影响卵泡颗粒细胞的功能。
作为一种新的泛素样蛋白,NEDD8蛋白在细胞中对蛋白质的分解与调控作用起着非常重要的作用[25]。NEDD8蛋白调控细胞中多种代谢途径的方式为Neddylation,与底物结合后可进行复杂的级联反应[26]。Neddylation激活Cullins的泛素E3连接酶活性后,NEDD化的Cullins蛋白构象发生变化并诱导底物发生泛素化,进而影响细胞内多种生命活动[27]。此外,Neddylation还可与泛素化过程竞争,p53和表皮生长因子(Epidermal growth factor receptor,简称为EGFR)上的某些赖氨酸残基既可以与NEDD8结合又可与泛素结合,抑制或降解底物。研究发现,Neddylation可通过诱导细胞凋亡、衰老和自噬抑制肿瘤细胞的生长[28-29]。卵泡闭锁过程不仅与卵泡内激素水平有关,也与卵泡颗粒细胞的凋亡高度相关。卵泡闭锁存在于卵泡发育的整个过程,由于闭锁卵泡发育阶段的不同导致其闭锁的具体过程存在差异,闭锁早期均出现卵泡颗粒细胞的凋亡[30]。研究发现,与正常卵泡相比,闭锁卵泡中凋亡相关基因p53表达量显著上升[31-32]。p53蛋白在细胞生存与凋亡过程中发挥作用依赖于泛素化、磷酸化、乙酰化等修饰过程[31,33]。此外,p53蛋白的活性由cullin-RING 泛素连接酶MDM2抑制,而MDM2可通过泛素-蛋白酶体途径降解p53。也有报道表明,MDM2可作为p53的NEDD8-E3连接酶[34],p53蛋白超家族中成员p73也能被NEDD化所抑制活性[35]。
在卵泡颗粒细胞中过表达与沉默bta-miR-1343-3p后检测细胞的增殖情况,MTT结果表明,bta-miR-1343-3p的过表达会抑制颗粒细胞的增殖,而bta-miR-1343-3p沉默会促进颗粒细胞增殖。这一结果表明,在卵泡颗粒细胞中bta-miR-1343-3p可通过抑制NEDD8的表达促进颗粒细胞的凋亡。这与其他研究中报道的NEDD8诱导细胞凋亡、抑制肿瘤细胞的生长的结果一致[36-37]。进一步在bta-miR-1343-3p过表达和抑制的细胞中检测CDK1与CDK4基因的表达量,结果发现,过表达bta-miR-1343-3p时细胞周期相关基因表达量显著下降,抑制bta-miR-1343-3p时表达量显著上升。细胞凋亡相关基因Bax则在过表达bta-miR-1343-3p后表达量显著升高,Fas基因表达量有所升高但差异不显著。上述结果可与之前的MTT结果相互印证,说明bta-miR-1343-3p通过靶向调节NEDD8基因的表达抑制了卵泡颗粒细胞的增殖。
综上所述,bta-miR-1343-3p靶向的NEDD8基因调控了牛卵泡颗粒细胞的增殖与凋亡,对卵泡发育起着重要的作用。

