壳损伤及海水酸化对厚壳贻贝脲酶和碳酸酐酶的影响
黄键锋, 王 莹, 祝塍轲, 范孝俊, 刘 菲, 李迎澳, 张晓林, 严小军, 廖 智
(浙江海洋大学 海洋科学与技术学院 海洋生物资源与分子工程实验室,浙江, 舟山 316022)
近年来,随着环境的变化,特别是海水酸化的日益严重,贝类养殖业开始显现各种问题,包括贝类大规模死亡[1-3]、疾病爆发[4]、生长和发育迟缓[5]等。自工业革命以来,大气中二氧化碳浓度已从280 ppm上升到380 ppm,导致海水的平均pH 值已下降了约0.1单位,继而导致海水中碳酸氢根离子浓度的升高以及碳酸根离子浓度的显著下降[6]。已知碳酸根离子是生物矿化过程中的关键分子,特别是对于以碳酸钙作为其生物矿化无机相的物种,例如贝类、珊瑚、藤壶、以及部分藻类等。碳酸根离子浓度的下降将导致其生物矿化速率受到明显抑制,从而直接影响其生存[7,8]。此外,海洋酸化还会导致贝类贝壳出现溶解速率加快,从而影响贝壳的发育与形成[9]。
贻贝(Mytilus)是一类全球广泛性分布且具有重要经济价值的双壳贝类,因其强繁殖能力、强环境适应性以及滤食性特征,在自然界能量流动、水质保护、环境监测等方面具有重要意义[10,11]。值得注意的是,尽管在实验室条件下,贻贝也表现出对海水酸化的敏感性[12,13],但在不同海域的调查分析中,贻贝通常表现出对于海洋酸化具有较强抗性[14,15],具体表现为:贻贝贝壳生物矿化速率并未明显受到海水二氧化碳浓度升高的影响;在食物充足的情况下,海水二氧化碳浓度升高也未降低贻贝的生存率[16]。上述特征导致贻贝成为部分高二氧化碳浓度海域的优势物种[14,16]。由此可见,贻贝贝壳的生物矿化过程对海洋酸化具有较强的耐受性,但这种耐受性的具体机制目前尚不清楚。
近年来,随着贻贝贝壳蛋白质组学研究的深入,从中已鉴定到与贻贝贝壳生物矿化过程直接相关的部分蛋白质,例如碳酸酐酶等[17,18]。此外,在厚壳贻贝中已发现存在鸟氨酸-尿素循环途径(ornithine-urea cycle,OUC)以及脲酶基因[19]。目前已知,碳酸酐酶在贝类贝壳生物矿化过程中与碳酸根的产生以及贝壳的形成具有重要关联[20,21];而在部分低等生物(例如珊瑚、细菌等)中,脲酶分解尿素所产生的碳酸根也已被证实与其生物矿化直接相关[22,23]。这一过程的关键步骤在于脲酶催化尿素的降解,产生碳酸和氨,氨的存在导致pH 值上升,进而促进碳酸分解,并为碳酸根离子与钙离子结合形成碳酸钙[24]。值得关注的是,已证实在细菌中,脲酶和碳酸酐酶通过协同作用共同促进了生物矿化过程[25]。综合以上结论,我们认为,碳酸酐酶和脲酶可能都在贻贝贝壳生物矿化过程中发挥了重要的碳酸根离子调控作用,且该作用可能与其对海洋酸化的耐受性具有关联。本文以厚壳贻贝(Mytiluscoruscus)碳酸酐酶和脲酶为研究对象,对其在海水酸化以及壳损伤条件下,2种酶在贻贝生物矿化相关组织中的表达谱以及酶活力开展分析,以期为了解碳酸酐酶和脲酶与贻贝生物矿化之间的分子关联提供新的科学认知。
1 材料与方法
1.1 厚壳贻贝碳酸酐酶和脲酶的序列分析
厚壳贻贝基因组数据目前已公布,其EBI(European Bioinformatics Institute)数据库编号为ERZ1292486[26];从其基因组数据库中可分别获得厚壳贻贝碳酸酐酶(CAC5401222.1)和脲酶(CAC5389250.1)基因序列;通过生物信息学手段,对厚壳贻贝碳酸酐酶和脲酶开展序列分析。其中,开放阅读框采用Lasergene软件(版本7.0)进行分析;二级结构采用NOVOPRO在线工具的PSIPRED模块(https://www.novopro.cn/tools/secondary-structure-prediction.html)进行预测;结构域预测采用TBtools(https://github.com/CJ-Chen/TBtools/releases)在线进行。
1.2 荧光定量PCR分析
成年厚壳贻贝采集自浙江舟山嵊泗海域,以洁净海水暂养于恒温水族箱中(温度22 ℃,盐度25 ‰)。首先,将厚壳贻贝分为2组,其中一组保持壳的完整状态,命名为CS(complete shell)组;另一组为壳损伤组,命名为DS(damaged shell)组,参照文献[27],采用1 mm直径钻头在贝壳上进行钻孔方式构建壳损伤模型贻贝。其中,CS组贻贝分别饲养于正常海水(pH值8.1,命名为CS-NW组,即complete shell in normal water)以及酸化海水(pH值7.3,命名为CS-AW组,即complete shell in acidic water)中。DS组分别饲养于正常海水,酸化海水,以及添加尿素的酸化海水中,分别命名为DS-NW(damaged shell in normal water)组,DS-AW(damaged shell in acidic water)组,以及DS-AW+Ur(damaged shell in acidic water with urea)组。酸化海水参照文献方法[28],采用稀盐酸(1 mol/L)进行调配,每2 h调节1次pH值,使其稳定在pH7.3。尿素添加浓度为1 mmol/L。以上5组贻贝在饲养过程中均采用螺旋藻粉作为饲料定时投喂。饲养时间均为5 d。
对上述5组贻贝分别收集其外套膜及血淋巴。其中,血淋巴采用内含抗凝剂(Alsever’s Solution, Sigma)的注射器从其后闭壳肌中抽取,抽取后经1 000 g,4℃条件下离心10 min,以获得血细胞。对外套膜和血细胞分别采用柱式RNA抽提试剂盒(上海生工)进行组织总RNA提取,并按照说明书操作;之后采用逆转录试剂盒(PrimeScriptTMRT reagent Kit, TaKaRa)进行逆转录;以逆转录后的cDNA作为模板进行荧光定量PCR扩增。针对厚壳贻贝碳酸酐酶和脲酶开放阅读框序列设计特异性引物;以厚壳贻贝EF-1α为内参基因;相关引物序列见Table 1;荧光定量PCR扩增的条件为95 ℃预变性3 min,95 ℃ 20 s,59 ℃ 20 s,72 ℃ 25 s,循环数为35,采用3次重复试验,参照文献[29],以最小二乘法(2-ΔΔCt法)处理数据并计算相对表达量。

Table 1 Primers sequence for qPCR analysis
1.3 酶活力分析
收集厚壳贻贝外套膜及血细胞后,经液氮速冻并研磨成粉末,进一步进行超声细胞破碎。之后,离心(8 000 g, 4 ℃, 15 min),上清液分别采用脲酶酶活力测试试剂盒(BC4115,索莱宝),参照其说明书进行脲酶活力测定;组织碳酸酐酶酶活力测试参照文献[30]方法进行。
1.4 贝壳内表面的显微观察
对厚壳贻贝贝壳在正常海水、酸化海水及壳损伤后的贝壳进行内表面显微观察。贝壳样品事先以5%氢氧化钠溶液进行浸泡和超声,以去除表面附着的污染物和杂质;再用去离子水清洗;经冷冻干燥后进行显微观察。其中,光学显微镜采用奥特光学(SZ810,重庆奥特)体式显微镜进行观察;进一步将贝壳样品经喷金处理后,置于扫描电子显微镜(SU8010,日立)进行观察,扫描电压为20 kV。
1.5 统计学分析
数据采用平均值±方差(mean±SD)展示。采用3次平行试验。利用 SPSS 25.0软件包中one-wayANOVA单因素方差检验进行统计学分析,P<0.05代表显著性差异。
2 结果
2.1 厚壳贻贝碳酸酐酶和脲酶具有不同的序列特征
厚壳贻贝碳酸酐酶基因开放阅读框长度为975 bp,编码一条324个氨基酸残基的前体蛋白质;二级结构预测结果表明,碳酸酐酶的二级结构含有21.60%的α-螺旋,23.15%的完全伸展区,以及5.86%的β-转角(Fig.1);碳酸酐酶序列中含有典型的信号肽序列(1~21号残基),表明厚壳贻贝碳酸酐酶可能是一种分泌蛋白质。此外,碳酸酐酶序列中含有1个典型的碳酸酐酶结构域(carbonic anhydrase domain),位于第26~278号残基(Fig.2)。厚壳贻贝脲酶基因开放阅读框长度为2 478 bp,编码一条由825个氨基酸残基组成的前体蛋白质;二级结构预测结果表明,脲酶序列中含有33.09% 的α-螺旋以及19.88% 的完全伸展区(Fig.1);其序列中具有真核生物脲酶所具有的典型5种结构域,包括Urease_alpha、beta和gamma结构域,以及2个酰胺水解酶结构域(amidohydro_1和3)(Fig.2)。

Fig.1 The predicted secondary structure of carbonic anhydrase and urease The secondary structure was predicted by PSIPRED of NOVOPRO (https://www.novopro.cn/tools/secondary-structure-prediction.html). Red spiral line represents α-helix, and blue arrow represents the extension region

Fig.2 Domain prediction of carbonic anhydrase (CA) and urease (URE) of M.coruscus The domain was predicted by TBtools (https://github.com/CJ-Chen/TBtools/releases). Carbonic anhydrase (CA) contains two domains including signal peptide and Carb_anhydrase domain; Urease (URE) contains five domains: urease_gamma, urease_beta, urease_alpha, amidohydro_1 and amidohydro_3
2.2 海水酸化及壳损伤均明显影响厚壳贻贝脲酶和碳酸酐酶的表达量
采用荧光定量PCR技术,以CS-NW组为对照,对不同条件处理后的贻贝开展外套膜和血细胞组织中脲酶和碳酸酐酶的基因相对表达量分析,结果见Fig.3和Fig.4。由图可见,在正常海水中,壳损伤后的厚壳贻贝(DS-NW组)外套膜组织的脲酶基因的相对表达量在1~2 d中,未出现明显变化(P>0.05),但是,在第3 d,其相对表达量明显上调(P<0.05),随后在第4和第5 d恢复正常水平(Fig 3A);而在酸化海水中,CS-AW组贻贝外套膜中的脲酶基因在第1 d出现明显上调(P<0.05),但是在第3 d出现明显下调(P<0.05),随后至第4和第5 d又出现明显上调,呈现出波动特征(Fig.3A);在DS-AW组中,脲酶基因的相对表达量在第1至第5 d均呈明显下调状态(P<0.05)(Fig.3A);添加尿素后的DS-AW+Ur组中,脲酶的表达量则在第3 d出现明显上调(Fig.3A)。碳酸酐酶则表现出与脲酶明显不同的表达量变化。结果如Fig.3B所示,相比于对照组,壳损伤贻贝在正常海水中(DS-NW组),其外套膜碳酸酐酶的相对表达量呈现先上调后下调状态,即在第1到第3 d呈现明显上调(P<0.05),而在第5 d出现明显下调;在CS-AW组中,碳酸酐酶的相对表达量同样出现先上调后下调的变化特征;在DS-AW组中,与对照组相比,外套膜中碳酸酐酶的相对表达量在第3至第5 d出现明显下调(P<0.05),表明酸化对碳酸酐酶的表达具有抑制作用;而在添加尿素后的DS-AW+Ur组中,外套膜碳酸酐酶的相对表达量也呈现出先上调后下调状态(Fig.3B)。
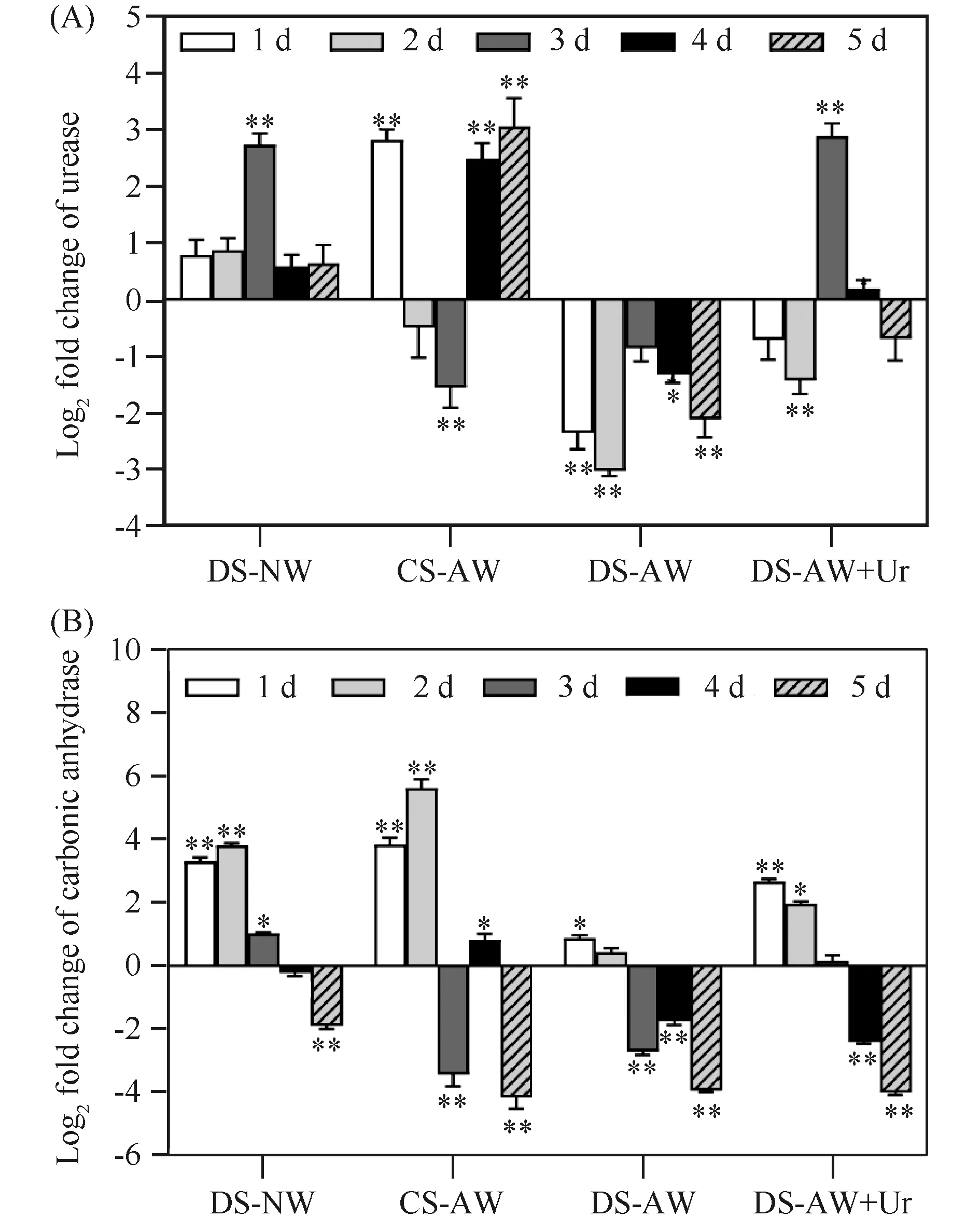
Fig.3 The log2 fold change of expression level of urease and carbonic anhydrase gene in mantle (A) The log2 fold change of relative expression level of urease in mantle of Mytilus coruscus; (B) The log2 fold change of relative expression level of carbonic anhydrase in mantle of Mytilus coruscus. M. coruscus’ mantle was collected respectively at post induction of 1, 2, 3, 4 and 5 days under different treating conditions: DS-NW, CS-AW, DS-AW, DS-AW+Ur. The relative expression levels of two genes were calculated by 2-△△Ct method and presented as mean ± SD (n=3). The statistical analysis of differences was performed by SPSS (v25. 0) with one-way ANOVA followed by Tukey’s multiple range test.* and ** represent the significance with P<0.05 and P<0.01, respectively, compared with that of control. DS-NW represents damaged shell in normal sea water; CS-AW represents complete shells in acidic sea water; DS-AW represents damaged shells in acidic sea water; DS-AW+Ur represents damaged shells in acidic sea water with urea
在血细胞中,与对照组相比,壳损伤以及海水酸化条件均明显抑制了脲酶基因的相对表达量,导致脲酶基因的相对表达量呈现明显下调;但是在酸化海水中,CS-AW组血细胞的脲酶基因在第4 d出现明显上调(Fig.4A)。此外,如Fig.4B所示,与对照组相比,血细胞中碳酸酐酶的相对表达量在DS-NW组中在第1至第5 d中均呈现明显上调趋势(P<0.05);在CS-AW组中,碳酸酐酶的相对表达量与对照组相比在第1 d出现明显下调(P<0.05),但是在第2至第4 d明显上调(P<0.05);在DS-AW组中,碳酸酐酶的相对表达量与对照组相比呈现逐渐上调趋势,在第5 d达到峰值;而在DS-AW+Ur组中,尿素的添加促进了血细胞中碳酸酐酶的相对表达量出现明显上调趋势(P<0.05)。

Fig.4 The log2 fold change of expression level of urease and carbonic anhydrase gene in hemocyte (A) The log2 fold change of relative expression level of urease in hemocyte of Mytilus coruscus; (B) The log2 fold change of relative expression level of carbonic anhydrase in hemocyte of Mytilus coruscus. M. coruscus’ mantle was collected respectively at post induction of 1, 2, 3, 4 and 5 days under different treating conditions: DS-NW, CS-AW, DS-AW, DS-AW+Ur. The relative expression levels of two genes were calculated by 2-△△Ct method and presented as mean ± SD (n=3). The statistical analysis of differences was performed by SPSS (v25. 0) with one-way ANOVA followed by Tukey’ s multiple range test.* and **represent the significance with P<0. 05 and P<0. 01, respectively, compared with that of control. DS-NW represents damaged shell in normal sea water; CS-AW represents complete shells in acidic sea water; DS-AW represents damaged shells in acidic sea water; DS-AW+Ur represents damaged shells in acidic sea water with urea
2.3 海水酸化及壳损伤明显影响厚壳贻贝脲酶和碳酸酐酶的酶活力
进一步采用相同的处理条件,分析了脲酶和碳酸酐酶在外套膜和血细胞中的活力变化,结果如Table 2和Table 3所示。在正常海水中,与对照组(CS-NW)相比,壳损伤后的厚壳贻贝外套膜组织中,其脲酶活性并无明显变化(P>0.05);但在酸化海水中,CS-AW组贻贝外套膜组织中的脲酶活力相比对照组出现明显上升(P<0.05),在第5 d达到峰值;而在DS-AW组中,外套膜组织中的脲酶活力相比对照组仅在第1 d出现轻微上升(P<0.05);在添加尿素的DS-AW+Ur组中,外套膜组织中的脲酶活力相比对照组在第3 d出现下降,但在第5 d出现了明显上升(P<0.05)(Table 2)。对碳酸酐酶而言,其酶活力值相比对照组,在DS-NW组中主要呈现下降趋势,特别是在第2和第5 d,外套膜中碳酸酐酶活力相比对照组明显下降(P<0.05);但是在酸化海水中,CS-AW组外套膜中的碳酸酐酶活力呈现明显上升趋势,其峰值出现在第1 d(P<0.05);在DS-AW组中,外套膜中碳酸酐酶活力相比对照组(CS-NW)多呈下降趋势,且在第2 d下降幅度为最大(P<0.05);而在添加尿素后的DS-AW+Ur组中,外套膜中碳酸酐酶活力相比对照组在第2 d出现明显上升(Table 2)。

Table 2 Urease (UA) and carbonic anhydrase (CA) activity in mantle

Table 3 Urease (UA) and carbonic anhydrase (CA) activity in hemocyte
在血细胞中,与对照组相比,脲酶活力在DS-NW组中主要在第4 d出现明显下降(P<0.05);在CS-AW组中,脲酶活力在第4 d呈明显下降趋势(P<0.05);在DS-AW组中,脲酶活力则同样在第4和第5 d出现明显下降(P<0.05);而在添加尿素的DS-AW+Ur组中,脲酶活力在第2 d出现明显上升(P<0.05),随后在第4和第5 d中出现明显下降(P<0.05)(Table 3)。此外,血细胞中碳酸酐酶的活力在各实验组中呈现与外套膜中不一样的变化特征。其中,在DS-NW组中,血细胞碳酸酐酶的酶活力相比对照组在第1 d和第3 d(P<0.05)有轻微上升;在CS-AW组中,血细胞碳酸酐酶的酶活力相比对照组在第1 d有轻微上升(P<0.05),但随后在第3和第4 d出现明显下降(P<0.05);在DS-AW组中,碳酸酐酶活力变化呈现与CS-AW组类似的趋势,即先上升后下降模式;而在DS-AW+Ur组中,尿素的添加促使血细胞中碳酸酐酶的酶活力在第4和第5 d呈现明显上升趋势(P<0.05)(Table 3)。
2.4 海水酸化及壳损伤对厚壳贻贝贝壳表面微观结构产生影响
首先,采用光学显微镜对3组壳损伤5 d后的厚贻贝贝壳损伤部位进行观察,设置了3组平行样品,结果见Fig.5。由图可见,经打孔方式构建的壳损伤模型的贻贝,正常海水中饲养5 d(DS-NW组),其贝壳内表面在其打孔部位可观察到一圈白色质地的表面结构;而在酸化海水中(DS-AW组),该白色表面层不明显;但在添加尿素后,即DS-AW+Ur组中,其贝壳内表面打孔部位附近重新出现了白色表面层(Fig.5)。

Fig.5 The photos of light microscopy observation of the inner surface around damaged shell After shell damage, mussels were fed in normal sea water (DS-NW), acidic sea water (DS-AW) and acidic sea water with urea (DS-AW+Ur), respectively. 5 days later, the shell inner surface was observed with light microscopy. The white layer newly formed in DS-AW+Ur group was denoted by a black arrow. The test was repeated three times, and the scale bar is 1 000 μm for each photo
进一步采用扫描电镜对白色表面层进行观察,结果见Fig.6。由图可见,在正常海水中饲养且壳正常的贻贝(即CS-NW组),其贝壳内表面呈现出方格状纹理结构(Fig.6A);而在酸化海水中的贻贝(CS-AW组)贝壳内表面,未见方格状纹理结构(Fig.6B);打孔后且饲养于正常海水中的贻贝(DS-NW组),其贝壳内表面在打孔部位附近出现波浪状的纹理结构(Fig.6C);而打孔后且饲养于酸化海水中的贻贝,其贝壳内表面打孔部位附近,其波浪状纹理结构不明显(Fig.6D);而在海水中添加尿素后的DS-AW+Ur组贻贝中,其打孔部位的贝壳内表面出现类似于DS-NW组中的波浪状纹理结构(Fig.6E)。

Fig.6 SEM observations of the shell inner surface from mussel with complete or damaged shell in normal or acidic sea water CS-NW: surface of complete shell in normal seawater; CS-AW: surface of complete shell in acidic sea water; DS-NW: surface of damaged shell in normal water; DS-AW: surface of damaged shell in acid water; DS-AW+Ur: surface of damaged shell in acidic water with 1mmol/Lurea
3 讨论
贝类的生物矿化不仅赋予了贝类具有重要保护意义的贝壳组织,其矿化过程涉及的分子机制也成为当前针对贝壳的仿生学和材料学研究的重要领域。目前,海洋酸化已对贝类的生存带来重大影响,其影响机制包括降低海水中碳酸根离子的浓度[3],加速贝壳中碳酸钙晶体的溶解速度[9, 31],以及改变贝壳中碳酸钙晶体晶型[32]等。海水中的碳酸根离子是贝壳形成的无机碳来源,主要包括外源性碳酸根(例如海水中溶解的碳酸根),以及内在的碳酸根(通过代谢产生的碳酸根离子)[33]。对贝类而言,其生物矿化是一个极为复杂的合成过程。目前,已发现海洋酸化会对贝类的多种代谢途径产生明显的影响[34]。其中,碳酸酐酶负责贝类生物矿化过程中碳酸根离子的调节,因而被认为是生物矿化过程中最重要的蛋白质之一[35]。此外,脲酶也是一种生物矿化相关蛋白质,但主要在微生物以及部分藻类中被发现具有生物矿化辅助作用[36],而在软体动物中尚不清楚脲酶对生物矿化的贡献。本文的研究结果显示,首先注意到脲酶和碳酸酐酶在贻贝外套膜和血细胞中,和在壳损伤与海水酸化等不同处理条件下,其基因表达量和酶活力变化呈现较为复杂的变化特征,体现出脲酶和碳酸酐酶在贻贝生物矿化过程中,具有较为复杂的组织特异性和生理过程的特异性。
在正常海水中,壳损伤处理对外套膜中的脲酶和碳酸酐酶的基因表达量均表现出明显的激活作用,特别是脲酶基因表达量呈现持续上调的趋势。表明脲酶和碳酸酐酶可能在外套膜中均参与了壳损伤的修复过程。酶活力的测试结果虽然也表现出类似的变化趋势,但相比对照组,差异不明显。可能的原因在于从基因到成熟蛋白质发挥功能,需要经历转录后修饰、翻译以及翻译后修饰等一系列复杂过程,因而基因表达量的测试结果和酶活测试结果存在不完全对应的现象。此外,在前期研究中,已发现厚壳贻贝各组织中均存在较高浓度的尿素分子,且稳定性同位素标记检测证实了尿素的碳元素可转移至贝壳,但存在一定的饱和性,表明尿素分子在一定程度上参与了贝壳的形成[19]。本文研究结果进一步表明,外套膜中的脲酶基因表达量在壳损伤后明显上升,推测其可通过催化尿素的分解产生碳酸根离子,从而参与了壳损伤的修复,但具体机制仍有待进一步研究。而在血细胞中,正常海水中的壳损伤同样诱导了碳酸酐酶的表达量明显上调,但脲酶基因表达受到抑制;酶活力测试数据也得到了类似结果。从整体水平呈现出碳酸酐酶活力呈上升趋势,而脲酶活仅在第2 d出现上升,之后呈现明显下降趋势。这表明,贻贝血细胞可能主要通过碳酸酐酶参与了正常海水条件下的贝壳损伤的修复。目前,已知贝壳的修复与贝壳的生长具有不同的生物矿化机制[37]。尽管此前外套膜被认为是贝类贝壳生长和修复的主要组织,但贝类血细胞在贝壳修复过程中的作用也已被证实[38]。本文数据表明,贻贝贝壳损伤的修复中,外套膜中的脲酶以及血细胞中的碳酸酐酶可能分别发挥了不同的作用。
而在贝壳完整的情况下,海水酸化可诱导外套膜组织中的脲酶和碳酸酐酶的基因表达量均出现上调趋势,且脲酶和碳酸酐酶活力也呈现类似的上升趋势。考虑到脲酶对尿素的分解作用所产生氨可导致局部的碱性环境[24],以及碳酸酐酶对二氧化碳的调控作用[35],脲酶和碳酸酐酶的基因表达量在酸化条件下有明显上调,意味着2种酶可能均在贻贝对抗海水酸化的过程中发挥了重要作用。值得关注的是,碳酸酐酶不仅是贝壳生物矿化过程中的关键酶之一,目前也是衡量海水酸化对生物矿化抑制作用的主要靶标分子[20],但其表达量在不同物种中呈现不同的特征。例如,在珊瑚的生物矿化研究中,发现海水酸化能强烈抑制碳酸酐酶基因的表达和酶活性[39]。而在已适应海洋酸化的物种,例如牡蛎中,其碳酸酐酶的表达量则不受影响[34]。而本文研究中,贻贝碳酸酐酶和脲酶的基因表达量在酸化条件下,均表现出上调,表明贻贝可能通过脲酶和碳酸酐酶来产生对海洋酸化的适应,这可能是贻贝对抗海洋酸化的一种耐受性机制。另外,酸化叠加壳损伤处理,导致贻贝外套膜的脲酶和碳酸酐酶以及血细胞中的脲酶基因表达量均呈下调状态,其酶活性也呈现类似特征,表明海水酸化可能抑制了贻贝外套膜对壳损伤的修复。但同样条件下,血细胞中碳酸酐酶表达量却呈现上调趋势,其酶活力也在第1 d明显上升。一方面,表明血细胞中碳酸酐酶可能参与了酸化海水条件下的二氧化碳调节,另一方面,也表明血细胞中的碳酸酐酶可能参与了酸化条件下对于壳损伤的修复。但上述推测尚需进一步的研究。
本文进一步的研究表明,酸化海水中添加尿素可诱导壳损伤后贻贝外套膜中的脲酶和碳酸酐酶的基因表达量的明显上调,但呈现不同的波动特征。而在血细胞中,同样条件下,碳酸酐酶的基因表达量受尿素诱导也明显上调,但脲酶的表达量与添加尿素前相比未受影响。上述结果表明,尿素在外套膜和血细胞中对于在酸化条件下的壳损伤修复具有不同的激活机制。对外套膜而言,尿素添加可能通过激活脲酶和碳酸酐酶参与酸化海水中壳损伤的修复,而在血细胞中,尿素可能仅通过激活碳酸酐酶来参与贝壳在酸化海水中的修复。
贝壳显微观察结果也初步证实,酸化对贝壳损伤的抑制以及尿素在酸化海水中对贝壳损伤过程的激活作用。光学显微镜的结果显示,贝壳打孔后在正常海水和酸化海水中,在打孔部位附近的纹理质地有明显区别。在正常海水中,打孔部位附近的白色质地层,可视为贻贝在壳损伤后,在其损伤部位出现的修复层。该修复层主要涉及贝壳内表面的有机质膜。该有机质膜已被证实与贝壳的形成有关[40]。而在扫描电镜观察中,正常贝壳在正常海水和酸化海水中表现出不同的表面结构,在酸化海水中,其贝壳内表面出现不规则片状结构,推测是无定型碳酸钙晶体(amorphous calcium carbonate,ACC)。已有文献报道,海水酸化会导致贝壳的碳酸钙晶体从有序向无序状态改变,从而导致ACC增加[32]。此外,打孔部位的白色修复层在扫描电镜观察中表现为较为规则的波浪状结构,而在酸化海水中,相同部位未出现规则波浪状结构。但是尿素的添加会诱导该结构重新出现,表明尿素对于在酸化海水条件下的贝壳修复具有某种激活作用。
通过以上研究,本文初步得出以下结论:脲酶与碳酸酐酶均在贻贝贝壳的损伤修复以及对海洋酸化的适应性方面具有重要作用,但两者在不同组织以及不同处理条件下,其基因表达量和酶活性有着不同的响应过程。尽管其具体过程和分子机制尚不明确,但根据已有文献报道,在巨大芽孢杆菌的生物矿化过程中,脲酶和碳酸酐酶已被证实存在协同作用[25]。但该研究基于的证据是体外实验,其协同作用的机制推测为脲酶催化尿素形成碱性环境,该碱性环境进一步促使碳酸酐酶分解碳酸产生的碳酸氢根转化为碳酸根离子。本文的结果表明,脲酶和碳酸酐酶仅在外套膜中表现出不同实验条件下具有响应同步性,但在血细胞中并无这一趋势,推测有较为复杂的调控机制。此外,贻贝的生物矿化过程对海洋酸化的耐受性必然有其内在机制,而脲酶和碳酸酐酶很可能是贻贝对酸化耐受的关键分子;此外,尿素对于贻贝贝壳的壳损伤修复具有促进作用,而该作用很可能与脲酶有关,其机制类似于细菌中脲酶参与生物矿化的机制。
致谢感谢浙江大学电镜中心宋丹丹老师在扫描电镜观察中的帮助。

