天然抗肿瘤环肽的研究进展
梁冰馨,唐 铭,黎 容,李林吉,马艾琳,许科浩,廖洪利
(成都医学院药学院,四川 成都 610500)
恶性肿瘤细胞分裂速度很快,会不断侵蚀周围的组织和器官,难以得到有效的控制和治疗,已成为严重影响人类生活质量、威胁生命的重大疾病[1],是当今医学界最棘手的疾病之一,也是全世界公认的医学难题[2]。当前,恶性肿瘤的治疗方法主要有化学治疗、手术治疗、放射治疗,这些方法均存在不同的缺陷[3],临床上迫切需要高效低毒的新结构抗肿瘤药物。
相比于小分子药物难以和靶标结合以及毒性蓄积的缺点,多肽类化合物毒副作用小、靶向性强,特别是环肽,它们结构更稳定,具有更好的亲和力和靶向性以及更低的毒性,是抗肿瘤药物的热门选择。近20年来,天然抗肿瘤环肽受到广泛关注,共有18款环肽药物上市,多数是从天然环肽改造而来,通过保持整体的环肽结构来维持对目标蛋白的亲和力[4]。作者在此对植物来源、海洋来源、微生物来源的抗肿瘤环肽研究进展进行综述,以期为深入研究新型抗肿瘤环肽提供参考。
1 植物来源的抗肿瘤环肽
1.1 堇菜科
Vitri、Varv、Cycloviolacin O2(cO2)是从三色堇菜(Violatricolor)中提取得到的具有细胞毒作用的环肽,它们对多种人癌细胞系都具有抑制作用;并且Bracelet亚家族环肽Vitri A、Vitri F和cO2对5种癌细胞人胶质瘤细胞U251、人乳腺癌细胞MDA-MB-231、人非小细胞肺癌细胞A549、人前列腺癌细胞DU145和人肝癌细胞BEL-7402的细胞毒作用最强,IC50值约为2.74~17.05 μg·mL-1,而Möbius亚家族环肽Varv A、Varv F等的IC50值约为Bracelet亚家族环肽的10倍。Herrmann等[5]用一种淋巴瘤细胞系对从双花堇菜(Violabiflora)中提取得到的环肽进行了荧光微量培养细胞毒试验,其中Bracelet亚家族环肽Vibi E、Vibi G、Vibi H的IC50值在0.96~5.00 μmol·L-1之间,而Möbius亚家族环肽Vibi D在30 μmol·L-1时仍无细胞毒作用。Tang等[6]研究发现,Bracelet和Möbius亚家族的疏水氨基酸残基的比例相近,但Möbius亚家族的疏水氨基酸在表面更分散,所以推测疏水氨基酸分布的集中程度可能对抗肿瘤活性至关重要。
Hyen D是从Hybanthusenneaspermus中提取得到的环肽,它与环肽cO2的细胞毒作用相当。Du等[7]从一种用作性欲增强剂的印度草本植物中分离得到了5个具有较强细胞毒作用的新植物环肽Hyen C、Hyen D、Hyen E、Hyen L、Hyen M;并通过一系列机理研究证实植物环肽与含有脑磷脂(PE)的脂质相互作用,聚集在细胞膜上,产生导致坏死的气泡,使细胞死亡;与TAT(一种细胞穿膜肽)相比,环肽Hyen D能更好地被人宫颈癌细胞HeLa内化,并以无毒浓度定位于核内体。Svangard等[8]研究发现,膜结合和破坏有助于植物环肽发挥细胞毒作用;人淋巴瘤细胞U-937GTB在环肽cO2中暴露5 min即出现细胞膜解体;钙蛋白负载的人宫颈癌细胞HeLa和脂质体的内容物迅速释放,呈浓度依赖性。
从堇菜科中分离得到的环肽还有Viphi、Viba[9]等,环肽Viphis A~H是第一次从紫花地丁(Violaphilippica)中分离得到[10]。采用还原、酶切和串联质谱测序的方法,初步确定了这些环肽的序列,并第一次成功分离出了环肽Viba 17和Mram 8。细胞毒试验表明,Viphi A、Viphis D~G、Viba 17和Mram 8对癌细胞(人黑色素瘤细胞MM96L、人宫颈癌细胞HeLa、人胃癌细胞BGC-823)和非癌细胞(人皮肤成纤维细胞HFF-1)具有细胞毒作用。
Yeshak等[11]从海拔3 400 m的Violaabyssinica中分离得到6个新的环肽Vabys A~E和Varv E,并用高效液相色谱、质谱和氨基酸定量分析对其结构进行了表征,发现环肽Vabys A~E有新的序列,Vabys A~C在序列中有更新的特征,Vaby A和Vaby D在荧光微量培养细胞毒试验中显示出细胞毒作用,对人淋巴瘤细胞U-937GTB的IC50值分别为7.6 μmol·L-1、2.8 μmol·L-1。证实了对不同生长环境紫罗兰环肽的研究可扩展我们对环肽结构和生物多样性的认识。
1.2 茜草科
RA-Ⅻ是从紫参(RubiayunnanensisDiels)中分离得到的具有抗炎和抗肿瘤活性的双环六肽,其抗肿瘤活性不依赖于细胞凋亡,并通过调节人结肠癌细胞SW620和HT29中的mTOR和NF-κB通路抑制保护性自噬。这表明RA-Ⅻ是癌症治疗的关键活性成分,作为结肠癌细胞自噬抑制剂具有很好的应用前景[12]。
Rubipodanin B是从柄花茜草(RubiapodanthaDiels)的根和茎中获得的一种新环六肽。使用TLC环肽原位法还检测到其它11种已知的茜草科环肽(RAs),其中RA-Ⅹ-OMe首次被鉴定为天然产物,RA-Ⅳ、RA-Ⅺ、RA--OMe和Rubiyunnanin C首次从该科中分离得到。细胞毒作用和 NF-κB信号通路活性评估结果表明,Rubipodanin B、RA-Ⅹ-OMe、RA-Ⅺ、Rubiyunnanin C、RA-Ⅰ、RA-Ⅴ对3种人肿瘤细胞MDA-MB-231、SW620和HepG2均显示出细胞毒作用,IC50值在0.015~10.270 μmol·L-1之间,并且RA-Ⅰ和RA-Ⅴ具有NF-κB抑制活性,IC50值分别为2.420 μmol·L-1和0.046 μmol·L-1,这表明2位丙氨酸在维持RAs生物活性方面起着关键作用[13]。
1.3 石竹科
Dianthins C~F、Longicalycinin A是从瞿麦中分离得到的环肽,它们对人肝癌细胞HepG2的增殖有一定的抑制作用,其中Dianthin D的细胞毒作用最明显,IC50值为2.37 μg·mL-1[14]。
Morita等从石竹科的叉歧繁缕中分离鉴定出了10种环肽,其中Dichotomin A、Dichotomin B、Dichotomin C、Dichotomin E、Dichotomin H、Dichotomin I对淋巴癌细胞P388的生长具有抑制作用,Dichotomin F和Dichotomin G对环氧化酶具有很强的抑制作用[15-17]。
1.4 菊科
Astins是从紫菀中分离得到的环五肽,是植物中唯一的氯化环肽。在现已发现的Astins中,环肽Astins A~C(图1)含有氯原子,其中Astin A、Astin B均含有别苏氨酸,具有抗肿瘤活性;有人对Astins A~C进行脱氯处理,并通过细胞毒试验研究其活性,结果发现所有的脱氯衍生物在一定剂量下均未表现出抗肿瘤活性。这证实了自然界中罕见的别苏氨酸是肽产生生物活性的重要组分。

图1 Astins A~C的结构式Fig.1 Structural formulas of Astins A-C
Xu等[18]对环肽Astins A~H、Astins K~P进行细胞毒试验,发现Astin B对BGC-823细胞的IC50值为19.2 μg·mL-1,Astin C对HCT116细胞和BGC-823细胞的IC50值分别为13.4 μg·mL-1和3.3 μg·mL-1。表明顺式二氯脯氨酸残基和侧链上的羟基数目对细胞毒作用起着重要作用[18-19]。
2 海洋来源的抗肿瘤环肽
2.1 海鞘
Didemnins是从Didemshnide科Trididemnumsolidum中成功分离得到的具有抗肿瘤细胞毒作用的环肽,其中活性最强的是Didemnin B。Didemnins既能抑制蛋白质的合成,也能抑制核酸的合成;可杀伤处于各周期的黑色素瘤细胞B16,尤以G1至S期细胞敏感。临床试验中,Didemnin B对非何杰金淋巴瘤和脑胶质母细胞瘤有一定疗效,但对变态前列腺癌、子宫颈鳞状细胞癌、小细胞肺癌、骨髓瘤和卵巢癌等疗效欠佳且有一定副作用。在对Didemnins同系物进行结构与功能对比时发现,脱氢Didemnin B的体内外抗肿瘤活性明显强于Didemnins,Didemnins亲脂取代后会显著降低其细胞毒作用。因此对侧链进行化学修饰会显著影响其活性[20-22]。Didemnin B因体内代谢半衰期短、毒副作用大而退出临床研究,而脱氢Didemnin B的毒副作用小且生物活性更高,2004年被FDA 指定用于罕见病多发性骨髓瘤和急性淋巴性白血病的治疗,2018年12月获批上市[21]。
Cycloxaoline是来自L.bistratum的环六肽。Shioiri课题组[23]研究发现,噁唑啉环是影响细胞毒作用的重要因素,无噁唑啉环的Tawicyclamides对人结肠癌细胞的细胞毒作用较弱,IC50值约为30 μg·mL-1,而Cycloxaoline对成纤维细胞MRC5CVI和膀胱癌细胞T24的细胞毒作用十分显著,IC50值为0.5 μg·mL-1[20,24-25]。
2.2 海绵
Pipecolidepsins A和B(图2)是从马达加斯加近海采集的片叶海绵中分离得到的2个新环肽,通过核磁共振、氨基酸片段(用Marfey试剂水解和衍生化得到)、LC-MS分析确证了它们的结构:除了几种常见的氨基酸外,还含有不常见的残基,包括2-氨基-3-羟基-4,5-二甲基己酸、3-乙氧基天冬酰胺、3,4-二甲基谷氨酰胺、4,7-二氨基-2,3-二羟基-7-氧代庚酸、3-羟基天冬氨酸及末端的3-羟基-2,4,6-三甲基庚酸。Pipecolidepsins A和B对3种人肿瘤细胞具有显著的细胞毒作用(表1)。Coello等[26]用Pipecolidepsin B中的HOAsp氨基酸取代Pipecolidepsin A中的Asp2残基后,Pipecolidepsin A的细胞毒作用提高了10倍(对于HT-29细胞系是100倍),可能与C3位的取代及氨基酸残基的亲水性有关。

图2 Pipecolidepsin A和Pipecolidepsin B的结构式Fig.2 Structural formulas of Pipecolidepsin A and Pipecolidepsin B

表1 海绵来源抗肿瘤环肽的半抑制浓度/(μmol·L-1)Tab.1 Half maximal inhibitory concentration of sponge-derived anti-tumor cyclic peptide/(μmol·L-1)
Phakellistatins是一类富含脯氨酸的环七肽。Phakellistatin 13、Phakellistatin 15~18[27-28]是从我国永兴岛海绵Phakelliafusca中分离得到的具有细胞毒作用的环肽。研究者采用丙氨酸扫描法研究各氨基酸残基对Phakellistatin 13环化的影响,并对合成的Phakellistatin 13衍生物进行体外细胞毒作用检测,发现Phakellistatin 13衍生物对人肝癌细胞、人乳腺癌细胞、人结肠癌细胞和人宫颈癌细胞均没有明显的细胞毒作用[28]。
Nazumazoles A~C(图3)[29]是从海洋海绵Theonellaswinhoei中分离得到的抗肿瘤环肽,对小鼠白血病细胞P388具有细胞毒作用。当Nazumazoles A~C中酮类降低时,细胞毒作用减弱;将硫醇基团进一步还原和烷基化后,则会直接丧失细胞毒作用。

图3 Nazumazoles A~C的结构式Fig.3 Structural formulas of Nazumazoles A-C
同是从海洋海绵Theonellaswinhoei中分离得到的抗肿瘤环肽Nazumazoles D~F(图4)在浓度为50 μmol·L-1时却并未对小鼠白血病细胞P388显示细胞毒作用。

图4 Nazumazoles D~F的结构式Fig.4 Structural formulas of Nazumazoles D-F
Theonellamide J、Theonellamide K和5-cis-apoa-Theopalauamide(图5)也是从海洋海绵Theonellaswinhoei中分离得到的双环糖肽。在细胞毒试验中,与Theonellamide(图5)相比,上述新发现的3种双环糖肽对HCT116细胞的细胞毒作用较弱,Theonellamide J几乎没有活性,5-cis-apoa-Theopalauamide的IC50值与Theonellamide[(2.8±0.9) μmol·L-1]相比也高了一个数量级。这表明非蛋白生成氨基酸3-氨基-4-羟基-6-甲基-8-苯基-5E,7E-辛二烯酸(apoa)是其发挥细胞毒作用的必需基团[30]。

图5 Theonellamide J、Theonellamide K、5-cis-apoa-Theopalauamide和Theonellamide的结构式Fig.5 Structural formulas of Theonellamide J,Theonellamide K,5-cis-apoa-Theopalauamide,and Theonellamide
Callipeltins N~Q(图6)是从所罗门岛海洋海绵Asteropussp.中分离出的4种新脂肽,是Callipeltin A的衍生物。Marc等[31]评估了Callipeltins N~Q对肿瘤细胞A2058、HT29、MCF-7以及非恶性成纤维细胞MRC-5的细胞毒作用,发现Callipeltin P和Callipeltin Q是直链脂肽,对肿瘤细胞无细胞毒作用;而Callipeltin N和Callipeltin O是环肽,细胞毒作用明显,IC50值低至0.16 μmol·L-1,证实了环状构型对生物活性影响显著;含有3,4-二甲基谷氨酰胺的Callipeltin N的细胞毒作用比含有3-甲基谷氨酰胺的Callipeltin O的细胞毒作用高6倍,表明该位置是发挥生物活性的重要位点。

图6 Callipeltin N和Callipeltin O的结构式Fig.6 Structural formulas of Callipeltin N and Callipeltin O
Carteritin A[32]是从Stylissacarteri中分离得到的环七肽,对人宫颈癌细胞HeLa、人结肠癌细胞HCT116和鼠巨噬细胞RAW264具有细胞毒作用。
2.3 海藻
从羽藻中分离得到的Kahalalide F(KF)对前列腺癌细胞和乳腺癌细胞具有强烈的细胞毒作用(IC50值为0.07~0.28 μmol·L-1),而且KF的细胞毒作用与多药耐药MDR1和酪氨酸激酶HER2/NEU的表达水平无关,仅与抗凋亡Bcl-2蛋白的表达水平有关[33]。
Dolastatin 3最初是从截尾海兔中分离得到的,后来发现从巨大鞘丝藻中也可以分离得到。Dolastatin 3对小鼠白血病细胞P388的GI50值低于1 μmol·L-1[34]。
Galaxamide(图7)是从海洋藻丝状乳节藻Galaxaurafilamentosa中分离得到的一种具有抗增殖活性的环五肽。Galaxamide包括2个N-甲基亮氨酸和3个亮氨酸[35],对人癌细胞U87和MCF-7有明显的细胞毒作用,IC50值分别为10.6 μg·mL-1和14.9 μg·mL-1[36]。陈萌等[37]、邱少玲等[38]发现D型氨基酸(D-AA)可以提高Galaxamide的抗肿瘤活性;后来有人通过修饰改造设计并合成了Galaxamide类似物,如改变α-氨基甲基化数量、引入其它氨基酸(D型氨基酸、其它天然氨基酸)、变换不同氨基酸残基在环中的位置;并通过MTT法进行细胞毒试验。结果显示,多个类似物对多种肿瘤细胞具有明显的细胞毒作用,且有明显的选择性,氨基酸构型完全不一样的类似物表现出相反的趋势。进一步说明了空间构象与Galaxamide及其类似物的抗肿瘤活性密切相关。

图7 Galaxamide及Analog-6的结构式Fig.7 Structural formulas of Galaxamide and Analog-6
通过AnnexinV-FITC/PI复染法、PI单染法、Hoechst 33342荧光染色法和Western blotting法发现,类似物Analog-6(图7)可能通过抑制HepG2细胞在细胞周期Sub-G1期的生长及诱导细胞染色质收缩使HepG2细胞早凋,且可能是通过线粒体介导的途径[39]。
Samoamide A是从束藻菌属藻青菌中分离得到的天然环八肽。Samoamide A在体外对包括人非小细胞肺癌细胞NCI-H460和人结直肠癌细胞HCT-116在内的一系列肿瘤细胞均有细胞毒作用,IC50值低于10 μmol·L-1;对人肺腺癌细胞H125、人乳腺癌细胞MCF7、人前列腺癌细胞LNCaP、人卵巢癌细胞OVC5、人胶质母细胞瘤细胞U251、人胰腺癌上皮样细胞PANC-1、人急性淋巴母细胞白血病细胞CEM、人粒细胞CFU-GM和单核细胞系祖细胞等均具有细胞毒作用,IC50值在1.1~4.5 μmol·L-1之间。虽然Samoamide A对以上几种癌细胞都具有细胞毒作用,但没有任何显著的选择性[40]。
3 微生物来源的抗肿瘤环肽
Chlamydocin(图8)是从Diheterosporachlamydosporia中分离得到的天然环四肽,已被证实具有很高的体外抗肿瘤活性,IC50值为1.3 nmol·L-1[41-42]。Chlamydocin是一种环氧酮类HDACs,除含有L-苯丙氨酸、D-脯氨酸、2-氨基异丁酸外,还有一种特殊氨基酸——2-氨基-8-氧代-9,10-环氧癸酸(AOE),该氨基酸的环氧酮结构构成与酶作用的结合区,是Chlamydocin体外抗肿瘤活性的主要贡献者。
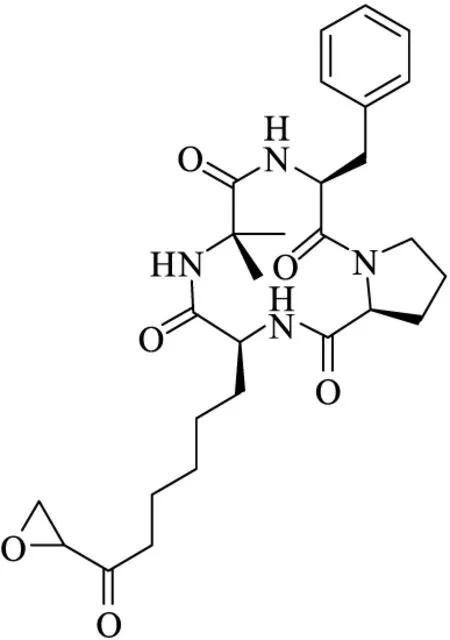
图8 Chlamydocin的结构式Fig.8 Structural formula of Chlamydocin
NW-G01是从陕西省土壤放线菌株No.313发酵液中分离得到的环六肽,对耐甲氧西林金黄色葡萄球菌(MRSA)等革兰氏阳性菌有较强的抑制作用,但对革兰氏阴性菌无明显抑制作用。王丽丽等[43]通过显微拍照法和MTT法检测,发现NW-G01对人宫颈癌细胞HeLa、人卵巢癌细胞SKOV3、人乳腺癌细胞MCF-7、人胃癌细胞SGC-7901和人胶质瘤细胞U251的生长都具有较强的抑制作用,其中对人胶质瘤细胞U251最为敏感,IC50值约为10 μmol·L-1。其作用机制可能是通过降低S期肿瘤细胞的比例、抑制肿瘤细胞的克隆形成能力来阻断肿瘤细胞的增殖。
芽孢杆菌脂肽主要用于抗菌研究,也具有抗肿瘤活性[44]。根据特定的肽链和脂肪酸结构,可将芽孢杆菌脂肽分为Surfactin、Iturin和Fengycin三类[45]。Surfactin和Iturin是环脂七肽;Fengycin(图9)的肽链部分由10个氨基酸构成,其中第3位的Tyr通过内酯键与第10位的Ile键合形成环肽[46]。芽孢杆菌脂肽的抗肿瘤机制包括诱导凋亡和细胞周期停滞[47]。

图9 Fengycin的结构式Fig.9 Structural formula of Fengycin
Surfactin可以通过诱导促凋亡活性和阻滞细胞周期来抑制人结肠癌细胞LOVO的增殖。经Surfactin治疗后,ERK和PI3K/Akt活化受到抑制,p21、p53、Fas及其配体水平明显升高,Caspase-3和PARP裂解活性明显升高,Cyclin E和CDK2表达降低[48]。Surfactin可以通过引起ROS的产生、ERK1/2和JNK磷酸化的持续激活来杀死人乳腺癌细胞MCF-7;此外,还能触发线粒体/Caspase凋亡途径,诱导MCF-7细胞凋亡,表现为Bax-to-Bcl-2表达增加、线粒体膜电位丧失、细胞色素C释放和Caspase级联反应[49]。
Iturin A可通过阻断Akt通路、失活MAPK和Akt激酶、促进FoxO3a向细胞核转位显著抑制乳腺癌细胞MDAMB-231和MCF-7的增殖并诱导其凋亡。在异种移植模型中,Iturin A可以通过降低Ki-67和CD-31的表达以及Akt、GSK3β、FoxO3a和MAPK的磷酸化来抑制肿瘤生长[50]。
Fengycin可以阻断非小细胞肺癌细胞95D的生长,抑制裸鼠体内移植的95D细胞的生长,诱导ROS爆发、Ca2+摄取、LDH释放和线粒体膜电位丧失。Fengycin通过下调Cyclin D1和细胞周期蛋白依赖性激酶4(CDK4)的表达,使细胞周期阻滞在G0/G1期。此外,Caspase活性、Bax/Bcl-2表达比值和细胞质中细胞色素C水平也发生了变化。表明Fengycin通过线粒体途径诱导95D细胞凋亡[51]。
4 展望
随着自然界中越来越多的抗肿瘤环肽被发现,包括从海洋蓝藻Caldorasp.中分离得到的具有细胞毒作用的环肽Portobelamides A and B[52]、从棒束孢属的发酵液中分离得到的抗胰腺癌细胞增殖和抗迁移的环肽Beauvericin[53]以及从植物内生真菌哈茨木霉(Trichodermaharzianum)中分离得到的4个新环肽Trichodestruxins A~D[54]等,对其抗肿瘤活性的研究也越来越深入,然而,诸多因素限制了这些抗肿瘤环肽的临床应用。如,多数天然环肽能被提取出来的量极少,不足以支持后续研究;一些环肽的活性研究仅局限于体外测试,缺乏对活性的深入研究及机制探讨;某些环肽的毒性较大,难以应用于临床。因此,今后应投入更多精力对环肽进行高效提取、人工合成、结构改造及深入的抗肿瘤机制研究,以改善天然抗肿瘤环肽的成药性。相信随着研究的逐步深入、更多新手段和新方法的应用,天然抗肿瘤环肽必将拥有更广阔的应用前景。

