发根农杆菌介导的细茎柱花草毛状根转化体系的建立
赵兴坤, 孙 昊, 杨丽云, 罗丽娟*, 刘攀道
(1.海南大学热带作物学院, 海南 海口 570228; 2.中国热带农业科学院热带作物品种资源研究所, 农业部华南作物 基因资源与种质创制重点实验室, 海南 海口 571101)
柱花草属(StylosanthesSw.)植物属于豆科蝶形花亚科,全属约有50个种,遗传多样性丰富,分布于美洲、非洲和东南亚,其起源中心为巴西和墨西哥[1]。圭亚那柱花草(S.guianensis)是目前世界范围内栽培面积最大的柱花草属植物,在热带与亚热带地区,既可作为物草种植,也可作为绿肥作物种植,用于提升土壤肥力和防止水土流失[2]。圭亚那柱花草最早由中国热带农业科学院于20世纪八十年代引入我国,主要用作幼龄橡胶园的覆盖作物[3]。随后,中国热带农业科学院又陆续从国际热带农业中心(CIAT)引进了圭亚那柱花草种质200余份,并利用这些种质为亲本培育了11个圭亚那柱花草的国家审定牧草品种,这些品种在海南、云南、贵州、广西、广东等省区已累计推广30多万公顷,圭亚那柱花草已成为我国最重要的热带豆科牧草之一[4]。圭亚那柱花草相较于其他柱花草属植物具有产量高、粗蛋白含量高、饲用品质好、对酸性土壤逆境胁迫(低磷、铝毒害、锰毒害)的适应性好等优点[5-6],也存在茎秆匍匐、抗寒性低、落粒性强缺点,因此,利用与近缘种杂交的方式对圭亚那柱花草进行改良是今后柱花草育种的主要目标[7]。
细茎柱花草(S.gracilis)在植物分类学上原被归为圭亚那柱花草的变种(S.guianensisvar. gracilis),后来被认定为一个新种[8]。细茎柱花草与圭亚那柱花草在基因组分型上均为GG型二倍体种,在目前发现的柱花草属植物中两者亲缘关系最近,可种间杂交(无生殖隔离)[9]。作为圭亚那柱花草的野生近缘种,细茎柱花草因产量低、易感炭疽病、木质化程度高等缺点,未被驯化选育成牧草品种用于生产利用。但是,细茎柱花草也具有明显的优点,如抗旱能力较强、种子产量高(落粒性低)、茎秆直立利于机械化收割等特点。因此,细茎柱花草可作为改良现有柱花草品种的理想材料。
发根农杆菌(Agrobacteriumrhizogenes)是一种革兰氏阴性菌,广泛分布于土壤中,早在20世纪初科学家就发现其能诱导一部分植物产生毛状根,其携带Ri质粒中的T-DNA片段进入植物细胞并整合进植物基因组中,能刺激植物产生大量的毛状根,且产生的毛状根均由单个的细胞发育而来,遗传性状稳定,无嵌合体[10-11]。毛状根转基因技术已经在多种植物中被广泛应用,本文旨在利用发根农杆菌介导,建立一种适用于细茎柱花草的转基因毛状根体系,为今后的柱花草属植物的基因功能研究及生物育种提供技术储备。
1 材料与方法
1.1 试验材料
1.1.1植物材料与试剂 本研究使用的细茎柱花草种子材料由中国热带农业科学院热带作物品种资源研究所提供。GFP抗体、山羊抗兔IgG-HRP抗体均采购于美国Cell Signaling Technology公司。
1.1.2菌株与质粒 发根农杆菌ArQua1,K599,MSU440,C58C1和大肠杆菌DH5α均采购于上海唯地生物技术有限公司;pEGAD为常见的双元载体,该载体含有绿色荧光蛋白报告基因(GFP),由本实验室保存并提供。
1.2 试验方法
1.2.1菌株的选择和活化 选取4种发根农杆菌菌株ArQua1、K599、MSU440、C58C1进行试验。将4种发根农杆菌在含有50 mg·L-1链霉素的LB固体培养基上划线,28℃培养箱中培养2 d。挑取单菌落分别接种于含有链霉素的LB液体培养基中,28℃下200 r·min-1培养12 h。取500 μL菌液转移至50 mL含有链霉素的LB液体培养基中,200 r·min-1培养菌液OD600至0.9,5 000 r·min-1离心10 min,弃上清,使用不含抗生素的YEB液体培养基重悬菌体,菌液用于侵染细茎柱花草外植体。
1.2.2载体质粒转入发根农杆菌 采用冻融法将pEGAD质粒转入发根农杆菌MSU440感受态。取500 ng质粒加入50 μL感受态中混匀,冰上静置5 min、液氮5 min、37℃水浴5 min、冰浴5 min,加入500 μL无抗生素的LB液体培养基,28℃震荡培养2 h,吸取100 μL菌液涂布于含有50 mg·L-1链霉素和50 mg·L-1卡那霉素的LB固体平板上28℃培养48 h,挑取单克隆菌落,进行PCR鉴定,选择阳性克隆菌落保存,用于下一步转化柱花草。
1.2.3柱花草无菌苗的培育 取适量的细茎柱花草种子去除外种皮,挑选完整饱满的种子放置于2 mL离心管中,加入1 mL去离子水,80℃水浴3 min打破种子的休眠,于无菌工作台中吸取去离子水,75%的酒精浸泡90 s,无菌水洗涤3次,0.1%氯化汞溶液浸泡10 min,无菌水洗涤6次,置于无菌滤纸上吸干。将灭菌后的种子使用无菌的镊子接种于MS培养基上进行萌发。
1.2.4外植体的获得及毛状根的诱导 使用已灭菌的镊子将萌发2 d的无菌苗从培养基上取出,置于铺有无菌水浸湿滤纸的无菌培养皿上,使用无菌手术刀从柱花草子叶节下约1 mm处切去下胚轴,再沿子叶节将两片子叶切开,同时在子叶上划出3个伤口,即获得侵染所需的子叶外植体。将子叶外植体放入侵染液中侵染15 min,用镊子将侵染后的外植体放至无菌滤纸上吸干多余菌液,置于MS固体培养基上25℃暗培养2 d;暗培养结束后使用1/2 MS+特美汀(200 mg·L-1)液体培养基清洗外植体,最后将外植体置于1/2 MS+特美汀固体培养基上25℃、12 h·d-1光照条件下培养。

图1 细茎柱花草子叶毛状根的诱导Fig.1 Hairy roots of Stylosanthes gracilis induced from its cotyledon注:A~B,待转化细茎柱花草幼苗;C~G,子叶外植体获取;H,发根农杆菌侵染;I,共培养;J~K,毛状根诱导培养;L,毛状根脱菌培养Note:Panel A~B display the seedings to be transferred;Panel C~G the acquisition of cotyledon explants;Panel H the Agrobacterium rhizogenes infection;Panel I the co-culture duration;Panel J~K the induced root;Panel L the sterilized culture
1.2.5不同发根农杆菌侵染实验 利用OD600=0.6的4种发根农杆菌菌液分别侵染细茎柱花草的子叶外植体,诱导培养20天后统计毛状根的诱导率。本试验共3个重复,每个重复20个子叶外植体。

1.2.6菌液浓度、侵染时间及共培养时间正交试验 基于菌液浓度、侵染时间、共培养时间开展L9(34)正交实验,菌液浓度分别设置为OD600=0.3,0.6,0.9;侵染时间设置为10 min,15 min,30 min;共培养时间设置为2 d,3 d,4 d。诱导20天后对毛状根进行形态检测,使用双波长便携式荧光蛋白激发光源(LUYOR-3415RG)观察并统计发绿色荧光的毛状根数目,计算毛状根转化率,同时对发绿色荧光的毛状根进行继代培养。

1.2.7转基因毛状根的DNA分子鉴定 使用双波长便携式荧光蛋白激发光源观察GFP的表达情况,初步筛选出阳性毛状根。取0.1 g毛状根样品,液氮研磨,通过CTAB法[12]提取DNA。以DNA为模板,通过四对基因特异引物进行PCR验证,其中rolB为发根农杆菌Ri质粒T-DNA插入区内的毛状根诱导基因,其上游引物为GCTCTTGCAGTGCTAGATTT(引物方向5′→3′,下同),下游引物为GAAGGTGCAAGCTACCTCTC,PCR产物长度为423 bp;GFP为pEGAD载体上T-DNA插入区内的绿色荧光蛋白基因,其上游引物为TCGTGACCACCCTGACCTAC,下游引物为GACCATGTGATCGCGCTTCT,PCR产物长度为478 bp;Bar为pEGAD载体上T-DNA插入区内的抗除草剂基因,其上游引物为GGTCTGCACCATCGTCAACC,下游引物为CCCACGTCATGCCAGTTCC,PCR产物长度为426 bp;UBCE1(ubiquitin-conjugating enzyme 1)为柱花草内参基因,其上游引物为CAGATCAAGCTGCTGACGAA,下游引物为GAACAAGCGATCATCAGGTTT,PCR产物长度为127 bp。
1.2.8蛋白质印迹法(Western blot) 取0.5 g柱花草毛状根样品,液氮研磨后加入50 μl 2.5×SDS-PAGE loading buffer,65℃水浴7 min,12 000 r·min-1离心10 min,取上清即为蛋白样品。取10 μl样品进行SDS-PAGE电泳,浓缩胶恒压80V约60 min,分离胶恒压120V,通过预染蛋白Marker确定电泳终止时间。采用湿转法将蛋白转移至PVDF膜,恒压60V约120 min。转膜结束后,PVDF膜用1× TBST清洗4次,每次10 min,清洗后加入2%的脱脂牛奶封闭60 min。按照1∶1 000的比例将10 μl GFP抗体加入到10 ml的2%脱脂牛奶中,4℃摇床孵育过夜。用1× TBST清洗4次,每次10 min以洗去未结合的抗体,按照1∶10 000的比例稀释二抗,室温孵育60 min后用1× TBST清洗4次。加入等比例显色液A和B,利用Image Quant LAS 4000 mini (Cytiva美国) 在化学发光下采集图像。
1.2.8数据处理 采用Microsoft Office 2016软件进行数据分析。
2 结果与分析
2.1 不同发根农杆菌毛状根诱导效率的比较
发根农杆菌K599在侵染细茎柱花草子叶后,无法诱导产生毛状根(图2)。发根农杆菌C58C1和Arqua1的诱导效率均低于60%,而MSU440的诱导效率高于80%。因此,发根农杆菌MSU440是诱导细茎柱花草产生毛状根的最佳菌株,本研究选取该菌株进行后续试验。
2.2 不同侵染条件对细茎柱花草毛状根转化率的影响
在毛状根诱导20天后,将外植体在绿色荧光蛋白激发光源下观察发光情况并记录。图3所示,新生的毛状根在激发光下观察到绿色荧光,证明外源基因成功转入。对正交试验结果(表1)进行分析可知,在试验处理水平的选择范围内,菌液浓度对于转化效率的影响最大,极差为17.63,其次为共培养时间,而农杆菌侵染时间对于转化效率的影响最小。最优组合菌液浓度为0.3,侵染15 min,共培养4 d,转化效率最高为34.72%。

图2 不同发根农杆菌菌株毛状根诱导效率的比较Fig.2 Induction efficiency of the hairy roots of Stylosanthes gracilis by different Agrobacterium rhizogenes strains注:图中不同字母表示不同菌株间差异显著(P<0.05)Note:Different letters indicate significant differences among different strains (P<0.05)

图3 毛状根荧光检测Fig.3 The hairy root detected by fluorescence注:A,明场下的转基因毛状根;B,转基因毛状根荧光检测;C,明场下的未转基因根;D,未转基因根荧光检测Note:Panel A displays the transgenic hairy root under natural light;Panel B the transgenic hairy roots detected by fluorescence;Panel C the non-transgenic root under natural light;Panel D the non-transgenic hairy roots detected by fluorescence
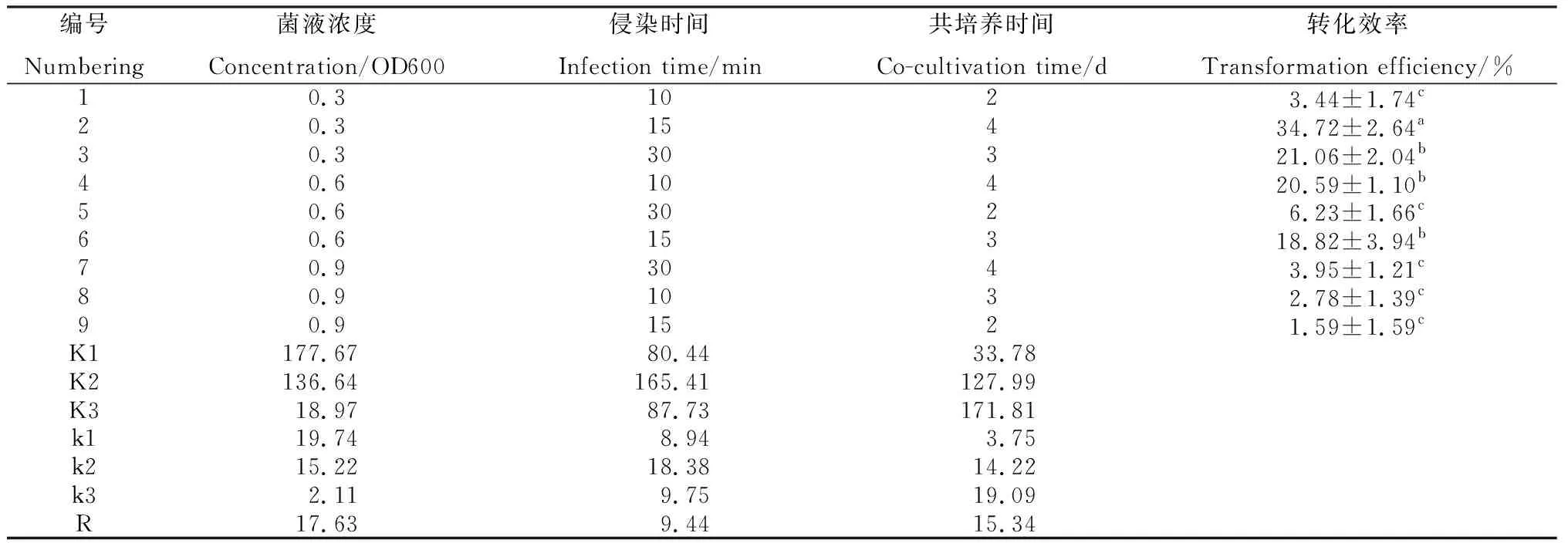
表1 不同侵染条件对毛状根转化效率的影响Table 1 Effects of different infection conditions on transformation efficiency of hairy roots
2.3 转基因毛状根的鉴定
为进一步验证发根农杆菌的相关基因以及植物表达载体pEGAD是否成功整合到细茎柱花草毛状根的基因组,以5个发绿色荧光毛状根的基因组DNA为模板利用PCR技术检测GFP,Bar,rolB,UBCE1基因,以野生型柱花草根系基因组和ddH2O作为阴性对照模板,以转入pEGAD质粒的MSU440菌液作为阳性对照模板。图4A可知,ddH2O和阳性对照未扩增出UBCE1片段,而在6个柱花草根系样品中均扩增出UBCE1条带且大小一致,表明样品可靠。5个转基因毛状根中均扩增出Bar,rolB,GFP条带且与阳性对照条带大小一致,阴性对照未扩增出条带,表明Bar,rolB,GFP均成功整合到细茎柱花草毛状根基因组中。此外,利用Western blot对这5个转基因毛状根中GFP的表达进行蛋白水平的鉴定,用野生型柱花草根系作为阴性对照。图4B可知,5个转基因毛状根样品均有明显条带条带大小正确,且阴性对照未出现条带,表明GFP在柱花草毛状根中正常表达。
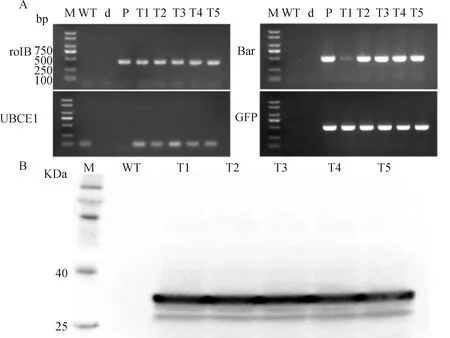
图4 转化毛状根的分子检测Fig.4 Molecular detection of transformed hairy roots注:A,转化毛状根PCR检测;WT,野生型柱花草根系;d,ddH2O;P,转入pEGAD质粒的MSU440菌液,T1~T5,转GFP基因毛状根株系;M,Maker B:转化毛状根Western Blot检测;WT:野生型柱花草根系;T1~T5:转GFP基因毛状根株系;M:MakerNote:Panel A displays the PCR detection of hairy roots. WT stands for the negative controls;d ddH2O;P the positive controls;T1~T5 the transgenic hairy roots;M:Maker. The same as below. Panel B displays the Western Blot detection of hairy roots
3 讨论
在发根农杆菌介导的毛状根转化体系中,毛状根的诱导效率和转化效率受到菌株类型、菌液浓度、侵染时间、共培养时间等多种因素的影响。本研究发现在诱导细茎柱花草产生毛状根时,不同发根农杆菌菌株诱导产生毛状根的效率存在显著差异。菌株K599无法诱导细茎柱花草产生毛状根,这与在白花草木樨[12]、小扁豆[13]、白羽扇豆[14]等豆科植物中的研究结果存在差异,这可能与物种之间的差异有关。ArQua1,MSU440,C58C1这3种均能诱导细茎柱花草产生毛状根,其中MSU440菌株的诱导能力显著高于其它两个菌株,且毛状根生长状态良好,因此,MSU440是最适用于细茎柱花草毛状根转化体系建立的菌株。罗萍等[15]发现MSU440菌株对尾巨桉的毛状根诱导率高达80.1%,这与本试验研究结果一致。侵染所用的菌液浓度、侵染时间、共培养时间也是影响毛状根的转化效率的重要因素。本研究结果表明,菌液OD600为0.3、侵染时间为15 min以及共培养4 d时毛状根转化效率最高,是发根农杆菌诱导细茎柱花草子叶产生毛状根时最佳侵染条件(表1)。过高的菌液浓度和较长的侵染时间都会降低毛状根的转化效率,这可能是发根农杆菌大量附着在细茎柱花草子叶表面,后期共培养阶段菌大量繁殖,导致子叶褐化死亡,无法诱导产生较多毛状根。
确定合适的筛选压是成功获得植物转基因材料的关键步骤,对转化效率有极大影响。本试验参照本课题组前期实验结果,选择0.6 mg·L-1Basta®进行筛选,获得了34.72%的转化效率,转化效率仍待进一步提高[9]。周玲燕等[16]研究发现在水稻的转基因过程中使用潮霉素作为筛选剂优于Basta,具有较少的假阳性,能显著提高阳性率。韩秀丽等[17]在大麦的遗传转化研究中也发现潮霉素较草丁膦更适于作为筛选剂。因此,为进一步提高转化效率,减少假阳性,后续研究可使用不同的筛选剂,确定最适的筛选压。
目前,发根农杆菌因其诱导产生的毛状根分化程度高、遗传性状稳定以及操作简易等特点而被广泛应用于蛋白定位、蛋白互作等,Meng等[18]采用双分子荧光互补实验在木豆(Cajanuscajan)毛状根中验证了CBLs与CIPKs相互作用;程媛媛等[19]在大豆中利用发根农杆菌介导的大豆毛状根技术成功进行了CRISPR/Cas9基因编辑、亚细胞定位及蛋白-蛋白互作分析,且发现互作的两种蛋白在烟草叶片细胞和大豆毛状根中的表达量存在差异,表明毛状根可能更利于准确预测基因的功能。此外,发根农杆菌诱导产生的离体毛状根也是丛枝菌根真菌双重培养的理想宿主材料,对于研究AM真菌于植物根系的共生及相关分子机制有极大的辅助作用怕[20];同时,离体毛状根在无激素的液体培养基中震荡培养,一个月可增殖数千倍,因此,可作为生物反应器生产次生代谢产物[21],在药用植物有效成分工业化生产具有广泛的应用前景。本试验后续将探索细茎柱花草毛状根的离体培养体系,助力代谢产物的生产。
4 结论
本研究以细茎柱花草为材料,采用子叶节侵染法建立了一种细茎柱花草毛状根转化体系。通过比较毛状根诱导率筛选出最适于细茎柱花草毛状根诱导的菌株MSU440,并确定了其侵染细茎柱花草的最佳条件,成功获得了表达GFP蛋白的毛状根,转化效率为34.72%。细茎柱花草毛状根转化体系的建立为柱花草属物种的基因功能研究提供了强有力的手段,为以后柱花草的遗传改良奠定基础。

