微创肺表面活性物质给药技术在早产儿呼吸窘迫综合征36例中的应用
李小燕, 王慧琴, 张彬, 陆天慧, 马红星, 程龙慧, 闫国秀
早产儿呼吸窘迫综合征(respiratory distress syndmme, RDS)主要原因是肺表面活性物质(pulmonary surfctant, PS) 缺乏所致, 以生后不久(2~6 h)出现呼吸窘迫并进行性加重为特征的临床综合征。胎龄越小, 发病率越高[1]。外源性PS不仅可降低肺泡表面张力, 且促进氧合、减少并发症等, 外源性PS替代治疗早产儿RDS已成为国际共识, 也是重要治疗手段之一[2]。目前, 常采用气管插管-肺表面活性物质-拔管(tubation-surfactant-extubation, INSURE) 技术[3], 这种传统的PS给药方法无法避免由于气管插管操作本身对新生儿气道黏膜的损伤, 以及给药时的正压通气带来的肺组织的气压伤, 这使得微创肺表面活性物质给药(less invasive surfactant administration, LISA)技术受到医学界专家的关注[4]。现将LISA技术应用在临床研究报告如下。
1 资料与方法
1.1 一般资料回顾2020年1月至2022年2月安徽省妇幼保健院新生儿科收治的82例早产儿RDS临床资料, 根据治疗方法分为应用LISA技术36例(A组)和应用INSURE技术46例(B组), 符合《2019年欧洲新生儿呼吸窘迫综合征管理指南》诊断标准。按给药方式的不同分为A组和B组。其中A组:男19例, 女17例;胎龄25~32周, 体质量720~1 700 g;B组:男26例, 女20例; 胎龄26~32周, 体质量800~1 960 g。
纳入标准:①本研究获安徽省妇幼保健院伦理委员会批准(文号YYLL2020-2020xkj235-02-01), 病人近亲属对研究方案签署知情同意书, 同意用PS;②早产儿RDS定义为早产儿生后不久进行性呼吸困难加重[5], 伴有或不伴有影像学证据, 排除其他原因所致呼吸困难;③25≤胎龄≤32周;出生后12 h内入院、能自主呼吸且未进行气管插管者;临床资料完整者。
排除标准:①先天性肺部、心、脑血管疾病者及其他先天发育畸形者;②生后在产房使用过外源性PS者;③出生后即刻需要气管内插管辅助机械通气者; ④具有遗传代谢性疾病的早产儿。
并发症定义:住院期间的主要并发症包括①支气管肺发育不良(bronchopulmonary dysplasia, BPD), 定义为生后28 d仍然脱离不了氧的需要, 以及肺部CT或X线等影像学资料支持;②坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC), 腹部直立位平片等影像证据;③新生儿颅内出血(头颅B超、磁共振或CT等影像学证据, 脑血管疾病除外);④根据头颅影像学将颅内出血分为4级(Ⅰ级:室管膜下生发基质出血;Ⅱ级:脑室内出血, 但无脑室扩大;Ⅲ级:脑室内出血伴脑室扩大;Ⅳ级:脑室扩大伴脑室旁白质损伤或脑室周围终末静脉出血性梗死)[6]; ⑤早产儿视网膜病(retinopathy of prematurity, ROP), 眼底镜筛查证据;⑥生后72 h有血液动力学影响的动脉导管未闭(hemodynamic significant patent ductusarteriosus, hsPDA), 心脏超声检查明确存在左向右分流(或双向分流)。
1.2 治疗方法所有病儿入院后予入保温箱、心电监护、呼吸支持、静脉营养、抗感染治疗、预防出血、完善相关检查等常规处理。(1)A组(LISA技术):在经鼻持续气道正压通气(nasalcontinuous positive airway pressure, NCPAP)辅助呼吸下, 在直视喉镜下应用直镊将6号胃管送入气管内(管端到口角的距离=体质量+6 cm), 用无菌针头和注射器吸取药液, 经胃管将PS药液缓慢注入气道, 维持经皮血氧饱和度0.90~0.94。PS物质为猪肺磷脂注射液 (商品名:固尔苏, Chiesi Farmaceutici S.P.A.公司生产, 批号HJ20181202, 批次1102675);建议一经诊断为RDS, 尽快开始治疗。出生后(6 h内)尽早一次给药100~200 mg/kg。第一次给药后6~12 h可以再给100 mg/kg(最大总剂量:300~400 mg/kg)。本品开瓶即用, 贮藏在2~8 ℃冰箱里。使用前将药瓶升温到37 ℃。轻轻上下转动, 勿振摇, 使药液均匀。(2)B组(INSURE技术):在直视喉镜下将气管插管(气管内导管型号按照标准计算公式的导管型号)置入气管, 并经气管插管将PS注入肺部, 拔出气管插管后继续NCPAP辅助通气。
1.3 观察指标(1)一般资料:两组病儿一般资料及母亲因素。(2)临床相关指标:两组PS的反流情况、2次使用PS、辅助通气时间、总用氧时间、住院时间等。(3)预后及并发症:两组死亡, 并发症情况(早产儿视网膜病变、颅内出血、NEC、气胸、BPD、hsPDA等)。
1.4 统计学方法应用SPSS 23.0软件进行统计学分析。正态或近似正态分布的计量资料以±s表示, 两组间比较采用成组t检验(方差齐)或校正t检验(方差不齐)。非正态分布连续资料用中位数(第25、第75百分位数)[M(P25,P75)]表示, 两组间比较采用Mann-WhitneyU检验。计数资料以例数及率描述, 两组比较为χ2检验或Fisher确切概率法。检验水准α=0.05。
2 结果
2.1 两组病儿一般资料比较两组病儿的胎龄、出生体质量、性别、Apgar评分情况等各基线指标均相对一致, 差异无统计学意义(P>0.05), 见表1。

表1 不同方法治疗的两组早产儿呼吸窘迫综合征(RDS)一般资料比较
2.2 两组病儿母体各临床指标比较两组母亲年龄、胎膜早破、妊娠期合并糖尿病及产前应用地塞米松情况等指标经比较均差异无统计学意义(P>0.05), 见表2。

表2 不同方法治疗的两组早产儿呼吸窘迫综合征母体临床指标比较
2.3 两组病儿治疗相关指标比较两组病儿2次PS应用、PS反流、72 h机械通气治疗、用氧总时间、住院总时间及辅助通气总时间等方面差异有统计学意义(均P<0.05), 见表3。

表3 两组早产儿呼吸窘迫综合征不同方法治疗的相关指标比较
2.4 两组死亡与并发症情况比较两组气胸、hsPDA、BPD等差异有统计学意义(P<0.05), 见表4。
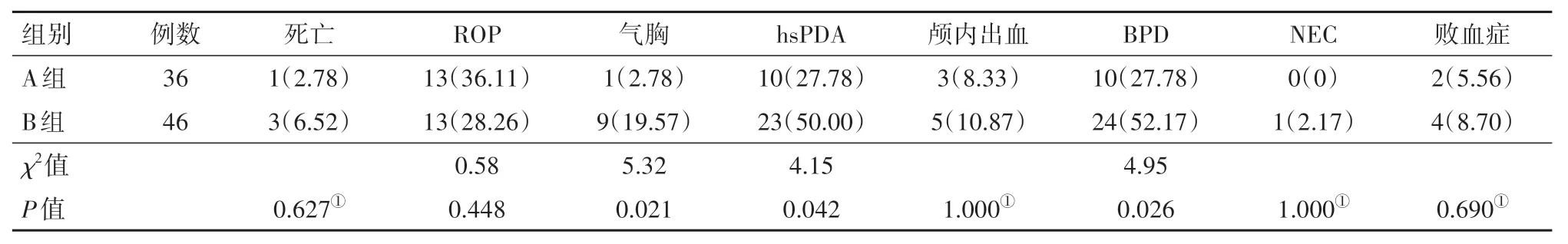
表4 两组早产儿呼吸窘迫综合征不同方法治疗的死亡与并发症情况比较/例(%)
3 讨论
随着产前糖皮质激素预防、出生后PS替代治疗及NCPAP呼吸支持早期应用, 早产儿RDS发病率随之降低[7]。本研究A组病儿PS的反流、二次用药率均低于B组, 由于LISA技术使用6号胃管(管径较细、软)给药, 该胃管对病儿自主呼吸影响较小, 可防止药液反流、保证药液剂量的准确性。此外, 由于早产儿发育不全, 行气管插管给药对早产儿而言侵入性较强, 且气管插管正压通气抑制病儿自主呼吸, 注入PS后机械通气时间可能需要延长, 增加病儿并发症的发生率[8]。A组病儿辅助通气时间、用氧总时间、住院时间均短于对照组, Kaniewska、Gulczynska[9]及现有多中心研究[10]结果也证明采用最新的LISA微创给药技术使得hsPDA、BPD发生率更低。
本研究显示两组死亡、ROP、NEC、颅内出血发生率无差别, 可能与样本量偏小有关。A组早产儿hsPDA、BPD、气胸的发生率低于B组。A组hsPDA发生率低, 可能提示微创给药对血液动力学影响小, A组全程NCPAP呼吸支持, 最大程度避免肺泡萎缩, 血氧饱和度波动频繁, 减少hsPDA的发生率。高亮等[11]研究表明早产儿hsPDA大部分发生在生后2~3 d(最长3~4 d), 由于肺循环阻力明显降低, 体循环血压回升后, 左向右分流的血液不断, 左心负荷加重导致出现呼吸困难症状, 即使短时间的高潮气量也会导致严重肺损伤, 进而进展为BPD[12]。本研究也显示胎龄越小、出生体质量越低早产儿是BPD的高危因素[13], 尤其早产儿肺部在管道形成期结束后以及囊泡形成期, 此时若受外界刺激, 肺泡结构发生简单化, 肺泡数目减少且肺泡体积增大, 间质纤维化更强, 进一步发展为BPD[14]。
2019年游芳等[15]报道新生儿重症监护室的随机对照研究, 研究人群为RDS早产儿145例, 胎龄27~34周, 分为LISA组(76例)和INSURE组(69例), LISA给药组生后72 h机械通气比例、BPD发生率降低均低于INSURE组。2019年欧洲呼吸窘迫综合征管理指南也不提倡在生后早期给予积极的肺膨胀策略。INSURE在给药过程中很容易导致肺过度膨胀, 引发肺损伤、BPD。流行病学研究表明hsPDA和BPD相关, hsPDA增加肺毛细血管床动脉和静脉的压力, 导致更多的液体渗透至肺间质, 间质蛋白浓度降低, 进而加重肺水肿, 影响肺循环[10]。本研究中A组hsPDA发生率低于B组, 可能也是BPD发生率低的原因。
本研究结果显示, A组发生气胸1例, B组发生气胸9例。本研究中的INSURE技术采用的气管插管仍易导致气道黏膜的损伤, 其短暂的正压通气仍可能带来明显的肺损伤[16-17]。由于LISA技术减少了对气道的损伤, 均匀吸入气体使肺膨胀, 同时无创NCPAP呼吸支持较气管插管可以减少早产儿气管内细菌定植, 因此减少败血症、NEC的发生率, 从而到达了改善肺部预后的目的[18-19]。
综上所述, 微创PS运用LISA技术治疗早产儿RDS, 减少PS用药剂量的耗损, 降低机械通气率、降低住院期间并发症, 缩短住院时间, 明显改善早产儿预后, 值得临床推广应用。

