食管鳞癌患者血清中lncRNA-TUSC7、lncRNA-UCA1表达与血管生成拟态的关系及意义*
李 洁,李美芳,骆 莉,张丽霞,朱晓林
河北省邯郸市第一医院:1.肿瘤内科;2.康复医学科,河北邯郸 056000
食管鳞状细胞癌(ESCC)是发生于食道且病理类型为鳞状细胞癌的恶性肿瘤,约占临床中所有食道癌类型的90%,ESCC患者常表现为吞咽困难,且随着病情加重还有可能出现病灶转移[1]。有研究显示在肿瘤复发与转移过程中,由于血管生成过程作为能够为肿瘤生长提供所需要的营养,因此也是造成肿瘤不断复发及病灶持续转移的重要因素[2]。而血管生成拟态(VM)作为不同于传统的肿瘤新生血管,目前临床证实其与多种因子如血管内皮生长因子、迁移诱导蛋白7等具有密切联系[3-4]。长链非编码RNA(lncRNA)作为人体肿瘤组织及体液中存在的一种长度大于200 bp的核苷酸分子,众多研究表明其与多数恶性肿瘤细胞的侵袭、转移具有密切联系[5-6]。其中肿瘤抑制候选基因7(TUSC7)在ESCC患者中呈现低表达从而促进细胞凋亡,而尿路上皮癌相关基因1(UCA1)在ESCC患者中的特异性表达也同样提示其与肿瘤的发展存在密切联系[7-8]。但两者与ESCC患者发生VM之间的关系暂未有研究阐明,因此本研究通过选取133例ESCC患者,并采用实时荧光定量聚合酶联反应(qPCR)检测其血清lncRNA-TUSC7、lncRNA-UCA1,进一步分析两者与VM之间的关系,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2020年3月至2021年12月经本院确诊为ESCC的133例患者,按照是否形成VM将其分为VM组76例及无VM组57例,其中VM组男37例,女39例,年龄32~64岁,平均(51.12±7.74)岁;无VM组中男25例,女32例,年龄33~65岁,平均(51.63±7.52)岁,两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。所有纳入研究的患者对本研究所采取的检测方式及研究目的均获得知情权,并签署知情同意书,本研究所获取的临床资料及一般信息均采取保密措施,不做其他用途。纳入标准:(1)所选取的ESCC患者符合文献[9]的ESCC诊断标准;(2)临床资料及一般信息完整;(3)签署知情同意书;(4)依从性较高,能够配合研究进行。排除标准:(1)伴有精神类疾病;(2)研究过程中私自服用药物导致研究结果产生偏差;(3)伴有肝、肾、心功能严重障碍;(4)伴有先天性免疫功能缺陷。
1.2方法
1.2.1qPCR检测血清lncRNA-TUSC7、lncRNA-UCA1表达 lncRNA-TUSC7、lncRNA-UCA1表达均采用qPCR进行检测,具体操作如下,两组患者均于清晨空腹状态采取外周血5 mL,放入离心机(美国Themor公司)中,以3 500 r/min(离心半径:13.5 cm)离心10 min,离心完毕后分离上层血清并放置于-70 ℃的冰箱中保存以待检测。取待测血清并采用Trizol法提取血清总RNA,在每1 mL的Trizol试剂裂解样中加入0.2 mL氯仿(成都市科龙化工试剂厂),并剧烈振荡15 s后在15~30 ℃的条件下孵育3 min,4 ℃下12 000 r/min离心15 min;离心后混合液体将分为下层的红色酚氯仿相,中间层及无色水相上层; 将水相上层转移到干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15~30 ℃孵育10 min后,于4 ℃下12 000 r/min 离心10 min;移去上清液,每1 mLTrizol试剂裂解的样品中加入至少1 mL的75%乙醇(成都市科龙化工试剂厂)混匀后,4 ℃下7 000 r/min离心5 min;小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5~10 min;溶解RNA时,先加入无RNA酶的水40 μL用枪反复吹打几次,使其完全溶解,获得的RNA溶液保存于-80 ℃待用;在4 ℃对其完整度及纯度进行检验,RNA溶液的A260/A280即为RNA纯度,比值1.8~2.1;在条件为42 ℃ 60 min,70 ℃ 10 min下进行逆转录并在4 ℃下进行保存;采用3 g/dL琼脂糖凝胶电泳分析扩增产物,并用花青素溴化乙锭染色,采用凝胶成像仪获取Ct值,其变化以ΔCt表示;以18 s作为内参,序列为上游5′-CAGCCACCCGAGATTGAGCA-3′,下游5′-TAG TAG CGACGGGCGGTGTG-3′;lncRNA-UCA1序列为上游5′-CTCTCCATTGGGTTCACCATTC-3′,下游5′-GCGGCAGGTCTTAAGAGATGAG-3′;lncRNA-TUSC7序列为上游5′-CATACAGAAGGCACCTCAA-3′,下游5′-GTCAGAGCA GTCACACTT-3′,采用2-ΔΔCt法计算lncRNA-TUSC7、lncRNA-UCA1的相对表达水平。
1.2.2CD34联合PAS染色判定VM 取所有ESCC患者肿瘤标本并按照流程制成石蜡切片,常规脱蜡水化后采用CD34染色,在高压锅中放入柠檬酸盐抗原修复液中进行5 min修复过程,待冷却后采用PBS洗涤3次,放入3%H2O2中孵育30 min后PBS洗涤3次,再次重复以上操作;VE-cadherin抗体孵育过夜后PBS洗涤3次;加入DAB显色后蒸馏水终止染色,并在PASI液下氧化10 min,蒸馏水冲洗后PASⅡ避光染色10 min,苏木素复染后中性树胶封片;以管腔壁CD34染色阴性,内见红细胞,并在外层可观察到PAS阳性物质围绕则可判定为VM阳性。
1.3观察指标 (1)对比两组患者血清合lncRNA-TUSC7、lncRNA-UCA1表达差异;(2)分别分析lncRNA-TUSC7、lncRNA-UCA1与ESCC患者临床病理参数之间的关系;(3)Spearman相关系数分析lncRNA-TUSC7、lncRNA-UCA1表达与VM生成之间的相关性;(4)受试者工作特征曲线(ROC曲线)分析联合lncRNA-TUSC7、lncRNA-UCA1检测对ESCC患者形成VM的预测效能。

2 结 果
2.1对比两组患者血清lncRNA-TUSC7、lncRNA-UCA1表达差异 相比于无VM组,VM组患者lncRNA-TUSC7表达显著降低,而lncRNA-UCA1表达显著增高,差异有统计学意义(P<0.05)。见表1。

表1 两组患者血清lncRNA-TUSC7、lncRNA-UCA1表达比较
2.2分析lncRNA-TUSC7与ESCC患者临床病理参数之间的关系 lncRNA-TUSC7与ESCC患者肿瘤分化程度、临床分期、淋巴结转移情况及是否发生VM具有密切联系(均P<0.05),见表2、图1。

表2 lncRNA-TUSC7与ESCC患者临床病理参数之间的关系

图1 lncRNA-TUSC7与ESCC患者临床病理参数回归森林图
2.3分析lncRNA-UCA1与ESCC患者临床病理参数之间的关系 lncRNA-UCA1与ESCC患者肿瘤分化程度、临床分期、淋巴结转移情况、浸润程度及是否发生VM具有密切联系(均P<0.05)。见表3、图2。

图2 lncRNA-UCA1与ESCC患者临床病理参数回归森林图

表3 lncRNA-UCA1与ESCC患者临床病理参数之间的关系
2.4分析lncRNA-TUSC7、lncRNA-UCA1表达与VM生成之间的关系 Spearmam相关系数显示,lncRNA-TUSC7与VM生成之间呈负相关(r=-0.782,P<0.001),而lncRNA-UCA1与VM生成之间呈正相关(r=0.766,P<0.001)。
2.5分析lncRNA-TUSC7、lncRNA-UCA1联合检测对VM生成的诊断价值 ROC曲线显示lncRNA-TUSC7、lncRNA-UCA1联合检测的曲线下面积(AUC)显著高于单一检测(Z=2.428,P<0.05),且具有较高的灵敏度与特异度,见表4、图3。

图3 ROC曲线分析lncRNA-TUSC7、lncRNA-UCA1联合检测对VM生成的诊断价值
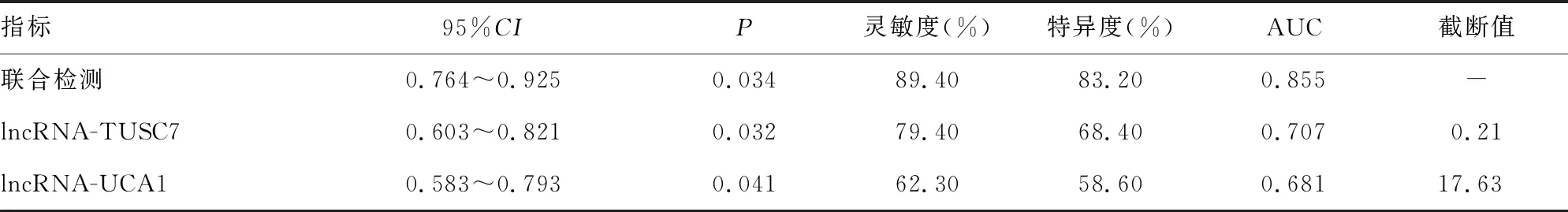
表4 各指标诊断效能
3 讨 论
ESCC作为一种恶性且伴有侵袭性的肿瘤疾病,临床上可通过化疗、放疗、手术等多种方式进行治疗,但由于肿瘤细胞繁殖速度较快,因此极易发生肿瘤远处转移,导致患者的生存预后情况较差[10]。越来越多的研究表明,肿瘤细胞发生转移与血管生成之间具有密切联系,而VM作为一种血液供应模式,其不依赖于内皮细胞且与肿瘤细胞恶性程度之间具有重要关系,提示VM可能参与ESCC复发转移,因此通过对有效指标进行检测并预防VM对改善ESCC患者的预后生存具有重要意义[11]。由于VM形成过程有多种因子参与,但目前临床上对VM的发病机制尚未形成统一定论,且单一因子也不能完全解释VM发病机制,因此探讨相关因子参与VM形成过程,能够为临床诊疗、改善ESCC患者预后提供新的理论依据。
本研究结果显示,lncRNA-TUSC7在VM患者体内呈现低表达,且lncRNA-TUSC7与VM生成之间呈负相关(r=-0.782,P<0.001)。现如今越来越多的研究表明,lncRNAs能够调控上皮细胞-间充质转化从而参与肿瘤的发展过程,并促进肿瘤细胞的侵袭与转移,lncRNA-TUSC7作为近年来发现的一种新的抑癌基因,在多种肿瘤组织中呈现低表达[12]。对其促进ESCC发展及VM形成的机制进行猜测后笔者认为,lncRNA-TUSC7能够通过与miR-211、miR-10a等发生相互作用,从而调控上皮细胞-间充质转化进程,使上皮细胞失去与基底膜的连接,从而获得更高的迁移、侵袭率,促使VM的形成及恶性肿瘤的发生、发展[13]。赵珂等[14]报道基础研究中也同样表明,敲低lncRNA-TUSC7后可导致E-cadherin蛋白表达降低,Vimention蛋白表达升高,进一步提高细胞迁移及侵袭率,指出过表达lncRNA-TUSC7对ESCC具有逆转作用。而本研究还显示lncRNA-UCA1在VM患者血清呈高表达,且lncRNA-UCA1与VM生成之间呈正相关(r=0.766,P<0.001)。lncRNA-UCA1作为由3个外显子和2个内含子组成的长度为2 314 bp染色体,随着众多学者研究的不断深入,指出其与乳腺癌、膀胱癌、胃癌等多种恶性肿瘤的发展具有密切关系[15]。lncRNA-UCA1作为一种致癌基因,可通过调控Wnt、AKT等多种通路促进肿瘤细胞的增殖,侵袭,并在此过程中逐渐生成VM,另有学者在研究肝癌中的lncRNA-UCA1表达时也同样表明,lncRNA-UCA1可产生“海绵样”作用,从而抑制miR-214的表达,升高Snail2蛋白活性,促进肝癌中的内皮间质转化作用,与lncRNA-TUSC7功能类似[16]。通过分别分析lncRNA-TUSC7、lncRNA-UCA1与ESCC不同病理参数特征也同样可以表明,以上两种血清指标均与临床分期、分化程度、是否发生淋巴结转移具有密切联系,其中临床分期越高越有可能发生远处淋巴结转移,疾病严重程度也越高,而分化程度越低提示细胞恶性程度越高,因此lncRNA-TUSC7可通过降低表达上调E-cadherin蛋白表达,并通过仅竞争性调控EPHA4进一步促进ESCC细胞增殖、侵袭,而lncRNA-UCA1通过上调表达调控Wnt等通路促进肿瘤增殖,两者共同发挥调控上皮间质转化的作用,进一步促进疾病发展,引起ESCC临床病理参数发生变化[17-18]。
此外随着lncRNA作为肿瘤标志物的出现,其在机体的表达变化早于其他受体、蛋白,因此对多种肿瘤的早期诊断具有重要意义,本研究ROC曲线显示,lncRNA-TUSC7、lncRNA-UCA1联合检测的AUC显著高于单一检测(Z=2.428,P<0.05),且具有较高的灵敏度与特异度,说明ESCC患者lncRNA-TUSC7、lncRNA-UCA1的表达对判断VM生成及疾病发展具有显著优势。但因本研究为小样本,因此缺乏一定的临床指导意义,因此可在下一步研究中进一步扩大样本量,为lncRNA-TUSC7、lncRNA-UCA1指导ESCC诊疗提供更加严谨的理论依据。
综上所述lncRNA-TUSC7与ESCC发生VM呈负相关,且lncRNA-UCA1与ESCC发生VM呈正相关,联合监测能够有效提高ESCC患者合并VM的检出率,对早诊断、早预防奠定了有效的生物标志物基础,同时lncRNA-TUSC7、lncRNA-UCA1在ESCC合并VM患者中的特异性表达也为日后研发新的治疗方式提供了潜在的靶点方向,在预防及治疗方面均具有较为深远的影响。

