大补脾汤对伊立替康所致小鼠迟发性腹泻的影响
岳晓华张小平孙少伯王碧莹谢晓蓉耿广琴安方玉
(1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃中医药大学敦煌医学与转化教育部重点实验室,甘肃兰州 730000)
伊立替康广泛用于治疗结肠癌、胃癌、肺癌等,通过抑制DNA 拓扑异构酶I 发挥其抗肿瘤作用[1],其常见副作用为腹痛、腹泻、消瘦等,属于中医“泄泻” 范畴[2]。伊立替康是腹泻发生的重要外因,属于中医“毒邪”,使脾胃受损,运化失调,进而水湿内生,导致泄泻的发生。目前伊立替康所导致的腹泻的中医证型认为有脾胃虚弱证、脾肾阳虚证、寒热错杂证、湿热内蕴证、肝郁脾虚证等[3],其中脾胃虚弱是其基本病机。敦煌古方大补脾汤主治脾气大疲、饮食不化。因此,本研究探讨大补脾汤对伊立替康导致的脾胃虚弱型腹泻的影响。
1 材料
1.1 动物 50 只BALB/c 小鼠,6 周龄,体质量18~20 g,购于甘肃中医药大学实验动物中心,实验动物生产许可证号SCXK(甘)2015-0002。
1.2 试剂与药物 大补脾汤(人参、炙甘草、干姜各15 g,白术、麦冬、五味子、旋覆花各5 g),购自北京同仁堂股份有限公司,经甘肃中医药大学高建德副教授鉴定合格。伊立替康(澳大利亚Pfizer Pty Limited 公司,批号H20160576);TRIzol(美 国Ambion 公 司,批号15596-026);逆转录酶、荧光定量PCR 参比染料(南京唯诺赞生物科技股份有限公司,批号R101-01/02、Q111-02);核糖核酸酶抑制剂(北京全式金生物技术有限公司,批号J11202);兔多抗GAPDH(杭州贤至生物有限公司,批号AB-P-R 001);兔多抗MRP2(北京博奥森生物技术有限公司,批号bs-1092R)。
2 方法
2.1 药物制备 药材浸泡30 min,大火煮沸后用小火煎煮30 min,过滤,药渣加水,同法再次煎煮30 min,过滤药渣,合并药液,浓缩至生药量0.9 g/mL,-20 ℃下贮存。
2.2 分组及给药 将50 只小鼠随机分为空白组、模型组及大补脾汤低、中、高剂量组。除空白组外,其余各组小鼠腹腔注射伊立替康(36.8 mg/kg),每天1 次,连续4 d[4]。造模成功后,给予大补脾汤低、中、高剂量组4.29、8.58、17.16 g/kg 药液,每天1 次,连续7 d。
2.3 取材 期间观察各组小鼠的饮食、进水、精神和腹泻等情况并记录,同时计算小鼠稀便率、平均稀便级以及腹泻指数。稀便级即稀便程度,用滤纸量稀便污染面积定级,每污染直径<1.0 cm 为1 级;污染直径1.0~1.9 cm 为2级;污染直径2.0~3.0 cm 为3 级;污染直径>3.0 cm 为4级。平均稀便级=每只小鼠所有稀便级数相加的和/稀便次数。稀便率=每只小鼠稀便数/总便数。以腹泻指数作为评定小鼠腹泻情况的主要指标[5-6],腹泻指数=稀便率×平均稀便级。干预7 d 后摘眼球取血,注射器抽取结肠内容物测定β-葡萄糖醛酸苷酶活性,同时取小肠、肝脏组织样本,收集混合粪便。
2.4 组织形态学观察 取小肠组织,4% 多聚甲醛固定,梯度乙醇脱水,组织透明,石蜡浸蜡,包埋,切片(厚度4 μm),脱蜡,苏木精-伊红(HE)染色,中性树胶封片,显微镜下观察。
2.5 小鼠粪便总DNA 的提取和PCR 扩增检测 取小鼠混合软湿粪便,总基因组DNA 用CTAB-SDS 法提取,稀释DNA 为1 ng/μL,用带有barcode 的特异引物扩增16S rRNA/18S rRNA/ITS 基因的V3+V4 可变区(16S V4/16S V3/16S V3~V4/16S V4~V5,18S V4/18S V9,ITS1/ITS2,Arc V4 等)并测序。扩增体系为10 ng 模板DNA,正反向引物0.2 μmol/L,15 μL Phusion 超保真PCR Master Mix,总体积30 μL。PCR 扩增条件98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,72 ℃温度下5 min,共30 个循环。
2.6 RT-qPCR 检测大肠杆菌相对数量 参照试剂盒说明书,提取基因组DNA,依据大肠杆菌的16S rRNA 序列设计引物(表1),将基因组DNA 稀释到60 ng/μL,RTqPCR 法检测小鼠大肠杆菌的相对数量,反应条件为50 ℃2 min,95 ℃10 min;95 ℃30 s,60 ℃30 s,40 个循环。通过2-ΔΔCT方法计算大肠杆菌的相对数量。

表1 引物序列
2.7 肠道β-葡萄糖醛酸苷酶的测定 取结肠内容物,称定质量,加入9 倍量PBS,混匀,3 000 r/min 离心10 min,取上清,用比色法测定肠道β-葡萄糖醛酸苷酶活性。
2.8 Western blot 法检测多药耐药相关蛋白2(MRP2)的表达 收集各组肝脏组织,加入裂解液处理30 min,离心,提取总蛋白,BAC 法测定蛋白浓度,95 ℃水浴变性,10%分离胶、5% 浓缩胶SDS-PAGE 蛋白电泳,转膜,5% 脱脂奶粉-TBST 室温封闭2 h,加入一抗(MRP2、GAPDH,1∶1 000)4 ℃孵育过夜,TBST 洗膜5 次,加入二抗(1∶5 000)室温孵育2 h,TBST 洗膜5 次,ECL 试剂盒显示免疫反应条带,Bandscan 软件分析胶片灰度值,GAPDH 作为内参,以目的条带/GAPDH 条带灰度值的比值表示目的条带的相对表达量。
2.9 统计学分析 通过SPSS 18.0 软件进行处理,计量资料以(±s)表示,组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 一般情况 空白组小鼠饮食正常,反应敏捷,大便成形、质硬,无其他明显异常改变;模型组小鼠出现蜷缩、倦卧、饮食减少、粪便稀溏、肛周黏腻等现象,体质量有所下降;大补脾汤干预后,上述症状均有所改善,主要表现为活动增加,体质量回升,腹泻程度减轻。
3.2 腹泻情况 与空白组比较,模型组小鼠稀便率、平均稀便级、腹泻指数均升高(P<0.01);与模型组比较,大补脾汤各剂量组小鼠稀便率、平均稀便级和腹泻指数均降低(P<0.01),说明大补脾汤可有效减轻伊立替康所造成的腹泻,见表2。
表2 各组腹泻指数比较(±s, n=10)

表2 各组腹泻指数比较(±s, n=10)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
3.3 小肠黏膜组织病理观察 如图1 所示,空白组小鼠小肠黏膜上皮完整,绒毛结构排列规则整齐,隐窝结构清晰;模型组小肠绒毛的形态和完整性被破坏,绒毛数量明显减少,并可见大量绒毛变形、脱落、断裂(黑色箭头所示),以及伴随隐窝结构的消失;而大补脾汤中、高剂量组小肠绒毛结构较完整,并可见明显的隐窝结构。

图1 小鼠小肠病理形态(×100)
3.4 肠道菌群丰度 伊立替康治疗很容易导致肠道菌群的紊乱[7],治疗后肠道菌群的组成及丰度都有所变化[8]。如图2 所示,伊立替康引起乳杆菌等益生菌的数量减少,假单胞菌、拟杆菌、丹毒丝菌等有害菌的升高;大补脾汤干预后,乳杆菌数量明显回升,有害菌的增殖被抑制。

图2 微生物种类分布情况
3.5 大肠杆菌数量变化 伊立替康毒性导致大肠杆菌的数量增加是引起腹泻的原因之一[9]。与空白组比较,模型组大肠杆菌数量增加(P<0.01);与模型组比较,大补脾汤中、高剂量组大肠杆菌数量减少(P<0.01),证明大补脾汤干预对伊立替康所导致的大肠杆菌升高有抑制作用,见表3。
表3 各组大肠杆菌数量比较(±s, n=10)

表3 各组大肠杆菌数量比较(±s, n=10)
注:与空白组比较,##P <0.01;与模型组比较,* P <0.05,**P<0.01。
3.6 β-葡萄糖醛酸苷酶活性变化 肠道共生菌群表达的细菌β-葡萄糖醛酸苷酶在药物诱导的胃肠道上皮细胞毒性中起着重要作用[9-10]。如表4 所示,模型组β-葡萄糖醛酸苷酶活性升高(P<0.01);与模型组比较,大补脾汤各剂量组β-葡萄糖醛酸苷酶活性均有不同程度的降低(P<0.05,P<0.01)。
表4 各组小鼠β-葡萄糖醛酸苷酶活性比较(±s, n=10)

表4 各组小鼠β-葡萄糖醛酸苷酶活性比较(±s, n=10)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
3.7 MRP2 蛋白表达 MRP2 介导伊立替康及其代谢产物的排泄[11],如图3、表5 所示,伊立替康导致肝脏MRP2表达升高(P<0.05);经大补脾汤干预后,MRP2 表达下降(P<0.01)。
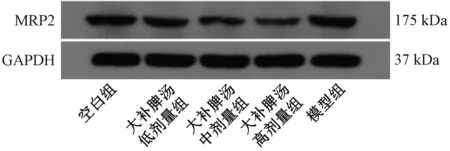
图3 MRP2 蛋白条带图
表5 各组MRP2 蛋白表达比较(±s, n=10)

表5 各组MRP2 蛋白表达比较(±s, n=10)
注:与空白组比较,#P<0.05;与模型组比较,**P<0.01。
4 讨论
伊立替康常见的临床副作用是迟发性腹泻,多表现为排便次数增加、粪便稀溏、甚至泻出如水样,或伴有呕吐、腹痛胀气、乏力等症状,属于“泄泻” “下利” 范畴。癌症属于消耗性疾病,由于病症日久,患者本就素体亏虚,而化疗药物伊立替康作为一种毒性药物,使患者脾胃更加虚弱,致使其运化功能失调,湿浊内生,发生泄泻[2],大补脾汤出自《辅行诀五脏用药法要》,主治脾气大疲,故本实验探究大补脾汤对伊立替康致脾胃虚弱型腹泻的干预作用。
目前普遍认为伊立替康所引起的胃肠道毒性与其独特的肝肠循环有关[12],伊立替康经肝脏代谢产物有7-乙基-10-羟基喜树碱(SN-38)、葡萄糖醛酸化SN-38(SN-38G)和部分没转化的伊立替康,这些代谢产物通过胆汁排泄到肠道,SN-38G 在肠道菌群分泌的β-葡萄糖醛酸苷酶的作用下生成有毒性的SN-38。SN-38 可直接损伤肠黏膜,导致体内水分、电解质吸收障碍以及肠道炎症的发生,引起严重腹泻[10]。本实验结果显示,大补脾汤可以有效降低小鼠腹泻指数和炎症因子水平,明显改善肠道黏膜损伤。前人认为健脾中药通过抑制伊立替康引发的炎性反应而减轻对肠黏膜的损伤[13],与本研究一致。
研究发现,伊立替康治疗后会导致患者肠道菌群失调[9,12],当肠道菌群紊乱时,会出现乏力、纳呆、腹胀、腹泻等症状,即出现中医脾胃虚弱的症状[14]。因此,通过健脾类中药来调节肠道菌群的平衡对减轻伊立替康所导致的脾胃虚弱具有重要意义。本研究发现,大补脾汤干预后肠道菌群的失调得以改善,假单胞菌、拟杆菌、丹毒丝菌等有害菌数量下降,乳杆菌等益生菌数量上升。
另外,研究发现,伊立替康治疗后会导致致病菌特别是大肠杆菌大量增加,而β-葡萄糖醛酸苷酶的增多与大肠杆菌的增多有关[9],细菌β-葡萄糖醛酸苷酶在伊立替康诱导的胃肠道上皮细胞毒性中发挥重要作用[10]。本研究结果表明,大补脾汤组大肠杆菌数量和β-葡萄糖醛酸苷酶活性均有所下降,可能是大补脾汤有效抑制了大肠杆菌的过度繁殖,降低了细菌β-葡萄糖醛酸苷酶活性而减轻了伊立替康的毒性。
MRP2 是伊立替康及其代谢产物在细胞外的转运体,介导了SN-38G 从胆汁排泄至肠腔中的过程。SN-38G 在小肠中β-葡萄糖醛酸苷酶的作用下转化为有毒性的SN-38,进而被重吸收、蓄积而引发肠黏膜细胞的损伤和腹泻[11],本研究结果显示,大补脾汤干预后MRP2 蛋白表达下降,腹泻程度得到改善,可能是大补脾汤通过抑制了MRP2 蛋白表达减少伊立替康及其代谢产物从胆汁向小肠的排泄,进而减少SN-38 在小肠的暴露而改善伊立替康所导致的腹泻,Guan 等[15]研究同样发现生姜泻心汤也能下调MRP2 表达,与本研究结果一致。
综上所述,大补脾汤能缓解伊立替康所导致的小鼠腹泻,其可能是通过改善肠道菌群失衡,抑制大肠杆菌繁殖,进而降低细菌β-葡萄糖醛酸苷酶的产生和MRP2 的表达,从而减少SN-38G 转化为毒性物质SN-38 在小肠的暴露。
——α-葡萄糖醛酸酶的研究进展*

