河北省不同苘麻种群对莠去津的抗性水平及抗性机制研究
郭倩颖 李 哲 马树杰 王明思 杨 娟,* 张利辉,*
(1河北科技师范学院,河北省作物逆境生物学重点实验室,河北 秦皇岛 066004;2河北农业大学,植物保护学院,河北 保定 071000)
苘麻(Abutilon theophrastiMedicus)是锦葵科一年生杂草,危害玉米、大豆等作物,通过竞争光照、水分和养分而造成作物减产[1-2]。苘麻结籽量大,种子活力高,防控难度较大[3-4]。近年来,农田耕作制度改变和除草剂单一使用,使杂草群落的演替加快,目前苘麻的发生和危害处于上升态势,已逐渐成为玉米田的恶性杂草。
莠去津(atrazine)属于光系统Ⅱ(photosystem Ⅱcomplex,PSⅡ)抑制剂,能够有效防除玉米田一年生禾本科杂草和阔叶杂草,其对某些多年生杂草也有一定的防除效果且因莠去津既能被杂草根吸收,也能被茎叶吸收,常作为土壤封闭除草剂和苗后茎叶处理剂使用[5]。但长期大面积使用,加速了抗莠去津杂草生物型的出现,自1972 年美国马里兰州首次发现绿穗苋(Amaranthus hybridusL.)对莠去津产生抗性以来,全球共发现抗莠去津杂草生物型66 个,从数量上仅次于乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂类除草剂的杂草抗性生物型[6]。杂草对除草剂的抗性机制可分为非靶标抗性(non-target-site-based resistance,NTSR)和靶标抗性(target-site resistance,TSR)[7-8]。非靶标抗性包括减少杂草对除草剂吸收和传导,增强解毒代谢作用以及对除草剂的屏蔽或隔离作用等[9]。我国辽宁地区的苘麻种群对莠去津产生了较低水平抗性,抗性指数为1.7~4.0[10]。此外,硬直黑麦草(Lolium rigidumGaud.)对莠去津产生抗性是由于体内P450s代谢作用增强所致[11]。长芒苋(Amaranthus palmeriS.Watson.)抗性种群谷胱甘肽-S-转移酶(glutathione Stransferase,GST)对莠去津的代谢速度比敏感种群快,导致其对莠去津产生抗性[12]。靶标抗性机制主要是除草剂作用位点的基因发生突变,或者靶标酶过度表达[13]。藜(Chenopodium albumL.)[14]、早熟禾(Poa annuaL.)[15]由于psbA基因编码的氨基酸突变(Ser264Gly)导致其对莠去津的吸收能力减弱,从而产生抗性。
近年来,农业生产上莠去津对苘麻的防治效果不佳,田间推荐剂量不能有效防除苘麻,但目前在我国鲜见解析苘麻对莠去津抗性机制的相关报道。因此,本研究以采自河北省玉米田的6 个苘麻种群为研究对象,通过整株生物测定法测定苘麻种群对莠去津的敏感性差异,以明确其抗性水平;并从非靶标抗性和靶标抗性两方面对抗性种群的抗性机制进行分析,以期为河北省玉米田苘麻的抗药性治理和延缓抗性杂草发生提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试苘麻种子 于2020年秋季和2021年秋季在河北省不同典型地区的玉米田单株采集6 个苘麻种群种子(具体采集信息见表1),晾干后放于4 ℃条件下储存备用。

表1 苘麻种群采集地点Table 1 Collection locations of A.theophrasti populations
1.1.2 药剂及试剂 38%莠去津悬浮剂(山东滨农科技有限公司),植物基因组DNA 提取试剂盒(北京天根生化技术有限公司),DNA 凝胶回收试剂盒、总RNA 提取试剂盒II R6934[安诺伦(北京)生物科技有限公司],Hieff qPCR SYBR®Green Master Mix(High Rox)荧光定量PCR 试 剂 盒Hifair®Ⅱ 1st strand cDNA Synthesis Supermix for qPCR(上海翊圣生物科技有限公司),大肠杆菌TG1感受态细胞(北京博迈德生物技术有限公司),95%马拉硫磷原药(安徽瑞辰植保工程有限公司),98%NBD-Cl(上海麦克林生化科技有限公司),酶联免疫吸附测定法(Enzyme-Linked Immuno Sorbent Assay,ELISA)试剂盒、植物谷胱甘肽-S-转移酶、植物细胞色素P450氧化酶(黄石市蓝图生物科技有限公司)。
1.1.3 试验仪器 3WP-2000 型行走式喷雾塔(农业农村部南京农业机械化研究所),梯度PCR 仪、ABI 7500 型实时荧光定量PCR 仪(美国应用生物系统公司),DYY-6C 型电泳仪电源、DUT-48 切胶仪(杭州米欧仪器有限公司)。
1.2 苘麻种群幼苗培养
将营养土∶蛭石按1∶1的比例搅拌均匀,装入7 cm×7 cm×10 cm 花盆中,将上述花盆放入塑料托盘中,灌水,使花盆吸水备用。挑选饱满种子,使用70%酒精浸泡10 min 对种子进行消毒,然后用无菌水冲洗3 次。将种子放入60 ℃水浴锅加热30 min,取出后加入300.00 mg·kg-1赤霉素浸泡,放入培养箱(温度:25~28 ℃,湿度:60%~70%,光照/黑暗:14 h/10 h)。待种子露白后播种到花盆中,每盆5 颗种子,覆土1 cm,24 h后采用3WP-2000 型行走式喷雾塔进行苗前土壤喷雾处理。
1.3 试验方法
1.3.1 苘麻种群对莠去津的抗性水平测定 采用整株测定法,按1.2 所述方法种植6 个苘麻种群,38%莠去津悬浮剂施药剂量为997.50、1 995.00、3 990.00、7 980.00、31 920.00 和63 840.00 g·hm-2,每个处理重复3次,同时设清水对照。施药后观察苘麻对莠去津的反应症状,21 d后剪取所有处理的苘麻植株地上部分,称量鲜重,计算处理占对照鲜重百分比,绘制剂量-反应曲线,计算抑制生长中量GR50及抗性倍数(resistance index,RI)。计算公式如下:
式中,X为莠去津使用剂量;YX为施用剂量为X时苘麻地上部鲜重;Y0为不用药对照组苘麻地上部鲜重;Y为莠去津施用剂量为X时苘麻地上部鲜重占对照干重的比率;C为莠去津使用剂量反应下限;D为莠去津使用剂量反应上限;GR50为苘麻生长抑制中量;b 为斜率。
1.3.2 酶抑制剂NBD-Cl 和马拉硫磷对莠去津的增效作用 以苘麻敏感种群HB-3 和抗性种群HB-6 为研究对象,测定GSTs 抑制剂4-氯-7-硝基苯并-2-氧杂-1,3-二唑(NBD-Cl)和P450s 抑制剂马拉硫磷对苘麻对莠去津抗性水平的影响。按1.2 所述方法种植苘麻。分别将NBD-Cl(270.00 g·hm-2)用50 µL 氯仿进行溶解,马拉硫磷(1 000.00 g·hm-2)用50 µL丙酮进行溶解,之后再用0.1%吐温-80 水溶液定容至20 mL。待抑制剂喷施30 min后再进行莠去津药剂处理。莠去津的处理剂量为997.50、1 995.00、3 990.00、7 980.00和31 920.00 g·hm-2。每个处理3 个重复,设0.1%吐温-80 水溶液为对照。处理后21 d 按照1.3.1 的方法计算抑制生长中量GR50及差异倍数(fold change,FC):
1.3.3 苘麻谷胱甘肽-S-转移酶(GSTs)和细胞色素P450 氧化酶(P450s)活性测定 选取苘麻敏感种群HB-3 和抗性种群HB-6 进行GSTs、P450s 活性研究,按1.2 所述方法种植苘麻,喷施莠去津田间推荐剂量(1 995.00 g·hm-2)。分别于施药前和施药后1、3、5、7、9、14 d 进行取样,用液氮将样品迅速冷冻,置于-80 ℃冰箱保存备用。采用ELISA 试剂盒测定解毒代谢酶GSTs和P450s活性。
1.3.4 苘麻psbA基因克隆及序列比对 选取苘麻敏感种群HB-3和抗性种群HB-6,按1.2所述方法种植,待植株生长至4 叶期时,剪取叶片用液氮迅速冷冻,放入-80 ℃冰箱保存备用后,采用DNA 提取试剂盒提取苘麻DNA。参考GenBank 数据库已报道的苘麻psbA基因序列(NC_053702.1),扩增序列包含已报道的抗性突变位点(表2),将设计好的QM-F1/QM-R1引物送至北京博迈德基因技术有限公司合成,然后采用梯度PCR筛选出引物最佳退火温度。PCR扩增体系为25 µL:10 µmol·L-1正反引物各0.5 µL、2×Tap PCR MasterMix 12.5 µL、模板3.5 µL、ddH2O 8.0 µL。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃终延伸10 min。PCR扩增结束后,使用1%琼脂糖凝胶电泳进行检测,切取含有目的条带的凝胶,使用DNA 凝胶回收试剂盒对PCR 产物进行回收。将回收产物与pMD18-T vector 连接,转化至大肠杆菌TG1 感受态细胞。经过涂板和37 ℃过夜培养,挑取单菌落进行液体振荡培养4 h,将菌液送到生工生物工程(上海)股份有限公司进行测序。将测序结果在NCBI上进行BLAST比对,采用DNAMAN V9.0软件对敏感和抗性苘麻种群的psbA基因部分序列进行比对分析。

表2 psbA基因扩增引物Table 2 Amplification primers of psbA gene
1.3.5 靶标基因psbA表达量测定 选取苘麻敏感种群HB-3和抗性种群HB-6,按1.2所述方法种植,喷施莠去津田间推荐剂量(1 995.00 g·hm-2)。本研究共包括4 组处理:未经莠去津处理的敏感种群;莠去津处理72 h之后的敏感种群;未经莠去津处理的抗性种群;莠去津处理72 h 之后的抗性种群,每个处理3 次重复。取各处理植株整体,用无菌水冲洗后迅速用液氮冷冻,于-80 ℃冰箱保存备用。RNA 提取参考总RNA 提取试剂盒II R6934 说明书进行。选用Hifair II 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)将RNA 反转录成cDNA,于-20 ℃冰箱保存。将苘麻cDNA按5倍梯度稀释后作为模板,进行下一步试验。
本试验参考GenBank数据库已报道的苘麻psbA基因序列(NC_053702.1)设计荧光定量引物,以Histone作为内参基因[16]进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)反应(表3),本试验QM-F2/QM-R2、Histone-F/Histone-R 引物由北京博迈德基因技术有限公司合成。按照Hieff®qPCR SYBR Green Master Mix(High Rox)荧光定量试剂盒说明书配制荧光定量反应体系,采用qRT-PCR仪进行反应。psbA基因PCR扩增体系为10 µL:10 µmol·L-1正反引物各0.5 µL、Hieff®qPCR SYBR Green Master Mix (High Rox)5.0 µL、cDNA模板1.0 µL、ddH2O 3.0 µL。扩增程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃复性30 s,共40个循环。

表3 psbA基因qRT-PCR扩增引物Table 3 qRT-PCR amplification primers of psbA gene
1.4 数据处理
使用SPSS 19.0 软件进行数据统计、差异显著性分析,利用Sigmaplot 14.0软件绘制剂量-反应曲线,求GR50和FC。
抗性水平分级标准,敏感种群:1≤RI<2;低抗种群:2≤RI<5;中抗种群:5≤RI<10;高抗种群:RI≥10[17]。
采用2-ΔΔCt法计算苘麻psbA基因表达量。
2 结果与分析
2.1 不同地区苘麻种群对莠去津的抗性水平
6 个不同地区苘麻种群施药后21 d 对莠去津的症状反应见图1。从图中可以看出,不同地区的苘麻种群对莠去津的反应存在差异。38%莠去津悬浮剂供试剂量为997.50 g·hm-2时,即可明显抑制种群HB-3 的生长,叶片边缘开始干枯;其他5个种群正常生长。剂量为1 995.00 g·hm-2时,除种群HB-6植株无明显受害症状以外,其他5 个种群均出现叶片边缘黄化干枯。施用剂量为3 990.00 g·hm-2时,种群HB-6 仅株高稍有降低,叶片无明显受害症状;其他5个种群植株叶片大部分失绿、干枯,并开始死亡。施用剂量为31 920.00 g·hm-2时,种群HB-6植株叶片枯萎并开始死亡。

图1 苘麻种群在施用莠去津21 d后的症状表现Fig.1 Injury symptoms of A.theophrasti populations 21 days after treatment of atrazine
通过剂量反应曲线可知,在供试剂量范围内,随着莠去津处理剂量的增加,不同种群苘麻的生物量降低(图2)。由表4 可知,不同苘麻种群对莠去津的抗性水平不同,其中抗性种群HB-6 的GR50值最大,为84 721.13 g·hm-2;敏感种群HB-3 的GR50值最小,为1 662.75 g·hm-2,抗性种群较敏感种群的抗性倍数为50.95。
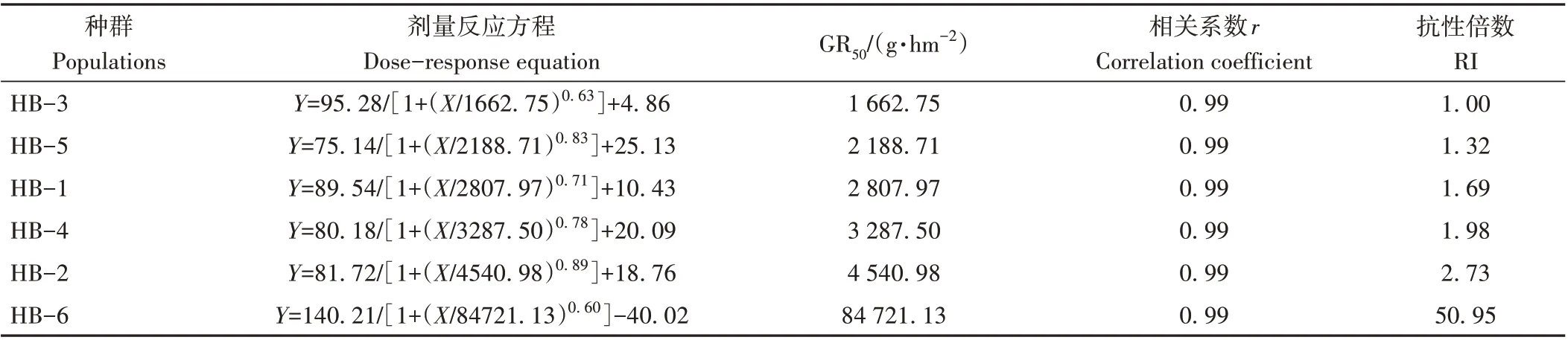
表4 不同苘麻种群对莠去津的剂量反应Table 4 Dose response to atrazine in different populations of A.theophrasti

图2 不同地理苘麻种群对莠去津剂量-反应曲线Fig.2 Dose-response curves to atrazine in different geographical populations of A.theophrasti
2.2 酶抑制剂NBD-Cl 和马拉硫磷对莠去津的增效作用
使用GSTs抑制剂NBD-Cl和P450s抑制剂马拉硫磷处理后,对苘麻生长无明显影响。抑制剂处理后,敏感种群HB-3对莠去津的敏感性无明显变化,但提高了抗性种群HB-6 对莠去津的敏感性。用NBD-Cl 抑制剂预处理后,抗性种群HB-6的GR50值由84 721.13 g·hm-2降至7 295.13 g·hm-2,GR50值差异倍数为-11.61。用马拉硫磷抑制剂预处理后,抗性种群HB-6 的GR50值由84 721.13 g·hm-2降至3 051.29 g·hm-2,GR50值差异倍数为-27.77 (表5)。由上述结果可知,抗性种群HB-6 对莠去津产生抗性与GSTs 和P450s 的解毒代谢有关。

表5 添加酶抑制剂NBD-Cl和马拉硫磷时苘麻种群对莠去津的抗性水平Table 5 The resistance to atrazine in A.theophrasti with the addition of enzyme inhibitors NBD-Cl and malathion
2.3 莠去津对苘麻谷胱甘肽-S-转移酶和细胞色素P450氧化酶活性的影响
为了研究苘麻体内GSTs、P450s 对莠去津的解毒代谢能力,采用ELISA 法测定了莠去津处理前后苘麻敏感种群HB-3 和抗性种群HB-6 的GSTs 和P450s 活性变化。
由图3 可知,莠去津处理后,两个种群的GSTs 活性都相对于未施药时有所升高,整体呈现先上升后下降趋势。抗性种群HB-6 的GSTs 活性在1~7 d 内缓慢上升,第7 天时GSTs 活性达到最大值,为0.26 U·g-1,随着莠去津处理时间的延长,GSTs 活性略有下降。敏感种群HB-3的GSTs 活性在1~5 d 内缓慢上升,第5 天时GSTs 活性达到最大值,为0.24 U·g-1,随着莠去津处理时间的延长,GSTs 活性逐渐降低。以上结果表明,GSTs 在苘麻对莠去津的解毒代谢过程中发挥了一定的作用,种群HB-6 的GSTs 对莠去津的解毒能力高于种群HB-3,种群HB-6对莠去津产生抗性与GSTs活性增强有关。

图3 莠去津对苘麻谷胱甘肽-S-转移酶活性的影响Fig.3 Effect of atrazine on glutathione-S-transferase activity in A.theophrasti
由图4可知,喷施莠去津后,P450s活性表现为,抗性种群HB-6整体先上升后下降,敏感种群HB-3整体呈先下降后上升。抗性种群HB-6 的P450s 活性在第5 天时达到最大值,为0.24 U·g-1,随着莠去津处理时间的延长,P450s 活性略有下降,14 d 后P450s 活性上升且高于敏感种群HB-3。敏感种群HB-3 的P450s活性缓慢上升,第5天时最低,随着处理时间的延长,第9天时P450s 活性达到最大值,为0.20 U·g-1,极显著高于HB-6,14 d 后P450s 活性逐渐下降。说明抗性种群HB-6 通过提高P450s 活性加快对莠去津的解毒代谢速度,表明苘麻对莠去津的抗性与P450s 解毒代谢作用增强有关。
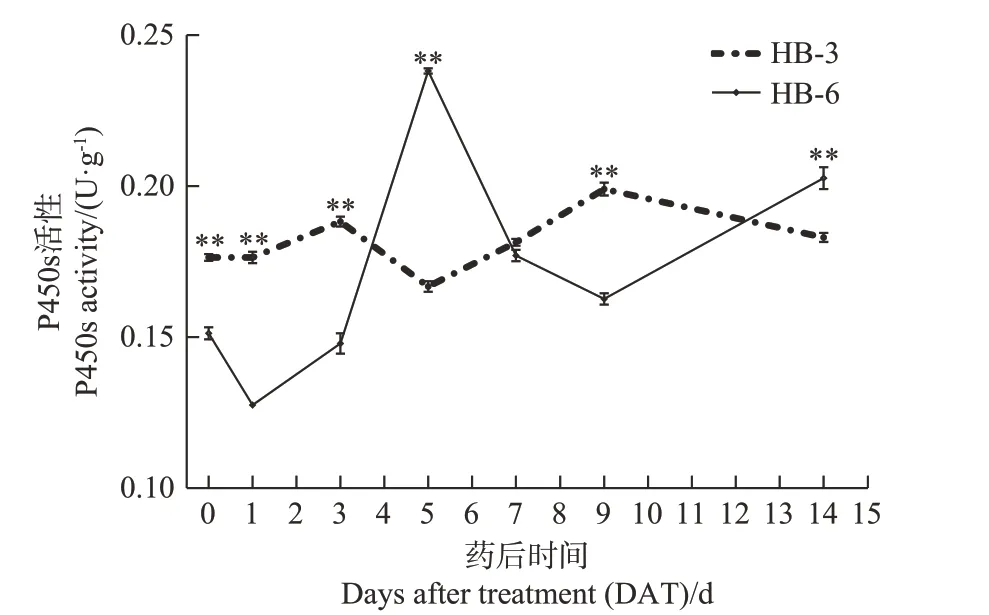
图4 莠去津对苘麻P450s活性的影响Fig.4 Effect of atrazine on P450s activity of A.theophrasti
2.4 苘麻psbA基因序列片段比对
利用引物QM-F1/QM-R1 扩增苘麻psbA基因部分保守区域,将扩增序列在NCBI 中进行BLAST 比对,与苘麻psbA基因序列(NC_053702.1)的同源性为99%,扩增片段大小为489 bp,证明扩增产物是包含已报道的抗性突变位点在内的苘麻psbA部分序列。使用DNAMAN软件比对了敏感种群HB-3和抗性种群HB-6的psbA基因部分序列(图5),编码叶绿体D1蛋白264位氨基酸为丝氨酸(Ser),碱基序列未发生突变,也未发现其他氨基酸代替,如Phe255Ile、Asn266Thr或Phe274Val,表明导致种群HB-6 对莠去津产生抗性与靶标基因psbA突变无关。

图5 苘麻敏/抗种群psbA基因部分序列比对Fig.5 Sequence comparison of mutation loci in A.theophrasti sensitive/resistant populations
2.5 莠去津对苘麻靶标基因psbA表达量的影响
为了研究莠去津对苘麻靶标基因psbA表达量的影响,利用qRT-PCR 技术测定了1 995.00 g·hm-2莠去津苗前处理苘麻后靶标基因psbA在敏感种群HB-3 和抗性种群HB-6 中的表达量(图6)。结果显示,未喷施莠去津时,抗性种群HB-6 的psbA初始表达量与敏感种群HB-3的差异显著;经莠去津处理后,2个种群的psbA表达量均升高,但种群HB-3 的表达量高于种群HB-6,说明苘麻抗性种群HB-6psbA基因表达量与其对莠去津产生抗性无关。
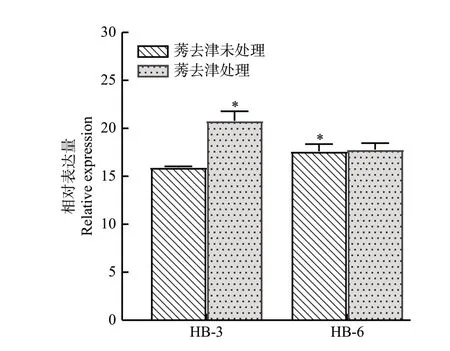
图6 不同苘麻种群psbA的相对表达量Fig.6 The expression of psbA relative to the Histone in different A.theophrasti populations
3 讨论
杂草与农作物有较强的竞争性,严重影响农作物的品质和产量。与人工除草相比,除草剂可以高效地清除杂草,具有保障农业高产、稳产等优点,已成为农田杂草防控的主要手段。但是,如长期大量使用单一靶标除草剂,选择压力会加快杂草抗药性的发生速度,影响除草剂的除草效果[18]。我国于20 世纪80 年代中期开始大面积推广使用莠去津,至今已有约40 年的时间,由于莠去津在我国使用频率高、剂量大、时间长,导致我国农田杂草对其产生了不同程度的抗性[18]。其中,辽宁省的鸭跖草(Commelina communisL.)对莠去津产生了抗性,其抗性种群较敏感种群对莠去津的抗性倍数高达59.60[17]。本试验中,河北省内不同地区的苘麻种群对莠去津的敏感性不同,与采集地莠去津用药史有关;敏感种群HB-3所在采集地未使用过莠去津,GR50值最小,为1 662.75 g·hm-2;种群HB-6 抗性水平最高,使用莠去津年限相对最长,GR50为84 721.13 g·hm-2,抗性指数为50.95。研究结果证实了杂草对莠去津的抗性与其使用时间和选择压有关。
在单一除草剂的长期选择压力下,大穗看麦娘(Alopecurus myosuroidesHuds.)[19]、麦家公(Lithospermum arvenseL.)[20]、长芒苋[21]等杂草主要通过增强自身解毒代谢酶GSTs 和P450s 的活性,加快对除草剂的解毒代谢能力,保护自身免受除草剂的损害,从而对除草剂产生了非靶标抗性。马唐(Digitaria sanguinalisL.)[22]、稗草(Echinochloa crusgalli〔L.〕Beauv.)[23]因体内GSTs活性增强而加快了对莠去津的解毒代谢作用,从而对莠去津产生了抗药性;在我国东北稻区发现,抗性稻稗(Echinochloa oryzicola〔Vasing.〕Vasing)种群P450s 代谢作用增强,导致其对五氟磺草胺产生了抗药性[24];鸭跖草对莠去津的抗性是GSTs 和P450s 代谢作用增强和相关基因的表达量升高所致[25]。本研究通过测定敏感和抗性种群GSTs 抑制剂NBD-Cl 和P450s 抑制剂马拉硫磷对莠去津的增效作用以及GSTs 和P450s活性,发现抗性种群HB-6 对莠去津产生的抗性也与GSTs 及P450s的活性增强有关,进一步印证了GSTs 和P450s 对除草剂的解毒代谢是杂草对除草剂产生非靶标抗性的原因之一。
前人已有研究发现,靶标酶基因突变和过量表达是引起杂草对除草剂产生靶标抗性的主要原因。由于EPSPS基因Pro106Ser突变和EPSPS过表达,导致牛筋草(Eleusine indica〔L.〕Gaertn.)对草甘膦产生抗性[26];山东省小麦田大穗看麦娘对除草剂啶磺草胺、甲基二磺隆产生抗性是由于ALS基因编码的Pro197Thr 发生了突变[27];地肤(Kochia scoparia〔L.〕Schrad.)靶标基因EPSPS和psbA过量表达导致其对除草剂草甘膦和莠去津产生了抗性[28-29]。野萝卜(Raphanus raphanistrumLinnaeus)由于靶标基因Ser264Gly 突变导致其对赛克津产生抗性[30]。本试验通过对苘麻敏感种群HB-3 和抗性种群HB-6 的psbA基因部分序列进行扩增和比对,未发现靶标基因psbA发生Ser264Gly 突变;qRTPCR 结果显示,莠去津处理后,抗性种群HB-6 的psbA表达量反而低于敏感种群HB-3,说明靶标基因psbA表达量变化与抗性种群HB-6 对莠去津的抗性无关。由此推断,苘麻对莠去津产生的抗性主要是由GSTs和P450s 活性增强引起的非靶标抗性,但是苘麻GSTs 和P450s对莠去津的解毒代谢过程有待进一步研究。
4 结论
本研究通过整株生物测定法,明确了河北省不同地区苘麻种群对莠去津的抗性水平,并对敏/抗苘麻种群进行了GSTs 和P450s 活性差异研究、靶基因psbA突变位点检测及表达量研究,从非靶标机制和靶标机制两方面,明确了苘麻对莠去津的抗性是由GSTs 和P450s介导的解毒代谢作用增强引起的。

