复合诱变选育高产赤藓糖醇解脂亚罗酵母及其发酵工艺优化
刘芳美 夏 凯 彭艳婷 赵学群 沙如意 黄 俊
(浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室/浙江省农业生物资源生化制造协同创新中心,浙江 杭州 310023)
目前,因糖过量摄入造成的健康问题给人们的生活造成了困扰[1-2]。而甜味剂的发现和使用有助于降低食品中糖的添加量,从而减少了糖的摄入。近年来,作为天然甜味剂的赤藓糖醇(erythritol)凭借独特的理化性质,如热值低、基本不被人体代谢、稳定性高和食用不会引起肠道不适等受到广泛关注[3]。赤藓糖醇化学名为(2R,3S)-butane-1,2,3,4-丁四醇,是一种白色、无味、不吸湿、无光学活性、热稳定性好且易溶于水的四碳醇,广泛存在于水果、蔬菜和发酵食品中。目前,赤藓糖醇已被广泛用于食品、医药和化工产品中,市场需求量急剧上升,这对赤藓糖醇的生产提出了新的要求[4]。赤藓糖醇可以通过化学法和微生物发酵法合成,然而化学合成法存在生产效率低、成本高和操作危险等缺点[1];微生物发酵法生产过程温和且容易控制,是现今赤藓糖醇生产的主要途径[1]。
赤藓糖醇主要由酵母菌发酵生产,已知的赤藓糖醇高产菌种来源于假丝酵母属(Candida)、亚罗酵母属(Yarrowia)和圆酵母属(Torula)等,其中被认为是安全微生物(generally regarded as safe,GRAS)的解脂亚罗酵母(Yarrowia lipolytica)是赤藓糖醇生产中使用最多的菌种[5-6]。然而,目前能够用于大规模生产赤藓糖醇的工业菌种资源仍相对匮乏,已报道的不同菌种间性能差异显著。因此,菌种选育仍然是现阶段重要的基础性工作。诱变处理是提高菌种性状的重要途径,针对赤藓糖醇生产菌株,目前采用的主要诱变方法为紫外线(ultraviolet,UV)辐射、硫酸二乙酯(diethyl sulphate,DES)和氯化锂(LiCl)分别处理等[7-8]。相比于紫外线辐射,γ 射线诱变因便于控制辐射条件、试验重复性好等特点,已在生物育种中得到普遍应用[9-10]。此外,常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变因操作简单、安全性高、环境友好和突变速度快等特点已在生物高效进化育种中取得了良好的效果[11-12]。然而,这两项技术在赤藓糖醇生产菌株的诱变选育中尚未得到推广。
鉴于此,本研究以解脂亚罗酵母WT5 为出发菌株,采用60Co-γ 射线辐射和ARTP 复合诱变处理,旨在获得一株高产赤藓糖醇且遗传性能稳定的菌株,并探明复合诱变处理的最佳条件及其在解脂亚罗酵母诱变选育中的实用性及高效性。此外,通过对培养基组分的Plackett-Burman (PB)拟合进行优化以及培养模式做出改进,以期进一步提高赤藓糖醇产量,为其他菌种的诱变选育以及赤藓糖醇的发酵生产提供技术参考。
1 材料与方法
1.1 材料与试剂
试验中所用化学试剂,如无特殊说明,均为分析纯,采购于生工生物工程(上海)股份有限公司以及国药集团化学试剂有限公司(北京)。
菌种活化培养基(yeast extract peptone dextrose medium,YPD):D-葡萄糖 20 g·L-1、酵母浸出粉(Oxoid)10 g·L-1、蛋白胨(Oxoid)5 g·L-1、NaCl 10 g·L-1、KH2PO40.5 g·L-1,pH 值6.0;摇瓶种子培养基和发酵培养基中其他成分不变,葡萄糖浓度分别改为200 和330 g·L-1,用于诱变后筛选的培养基组分和发酵培养基一致。其他优化后的培养基组分见下文所述,固体培养基在液体成分基础上添加2% (w·v-1)琼脂粉。
1.2 主要仪器设备
SpectraMax iD3 全波长多功能酶标仪,美国Molecular Devices 公司;Allegra64R 台式高速冷冻离心机,美国Beckman Coulter 公司;KLF2000 3.7 L 全自动发酵罐,瑞士比欧生物工程公司;ZQZY-78AE 智能恒温摇床,上海知楚仪器有限公司;e2695 高效液相色谱仪,美国Waters公司;ARTP-II型ARTP诱变系统,无锡源清天木生物科技有限公司;Aminex HPX-87H 分析柱(300 mm × 7.8 mm),美国Bio-Rad 公司;2414 示差折光检测器;美国Waters公司。
1.3 试验方法
1.3.1 γ 射线诱变处理及菌株筛选 甘油管保存菌种划线于固体活化培养基,之后置于30 ℃培养箱静置培养3 d。挑取单菌落接种于40 mL 种子培养基,200 r·min-1振荡培养至OD600=3.0±0.5,之后5 000 r·min-1条件下室温离心收集菌体并使用生理盐水洗涤2 次。利用生理盐水悬浮菌体并进行系列稀释,获得每毫升细胞个数为107的菌液,之后对菌液进行60Co-γ射线辐射处理:辐射剂量为0 (空白)、400、800、1 200、1 600和2 000 Gy,试验在浙江省农业科学院作物与核技术利用研究所辐照中心完成。诱变完成后,稀释菌液并涂布于含有0.005% (w·v-1)2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)的固体筛选培养基(TTC 氧化态为无色,在胞内脱氢酶的作用下,TTC 作为氢受体可被还原为红色的三苯甲臜,使菌落变红,颜色越深脱氢酶活性越高[13])。之后置于黑暗条件培养,观察菌落形态和颜色变化,计算成活菌落数,并计算致死率:
致死率=[1-(诱变组菌落数/对照组菌落总数)]×100%。
挑取颜色深红且直径大的单菌落进行活化培养,之后转接于发酵培养基进行为期7 d 的赤藓糖醇发酵试验(摇瓶容积为500 mL),测定发酵液中赤藓糖醇浓度以作为高产菌株筛选依据,并计算正负突变率。正向突变定义为当突变菌株的赤藓糖醇产量超过出发菌株5%以上且结果差异显著,反之如产量降低5%以上则为负突变,其他则为中性突变。同时对获得的高产菌株进行遗传稳定测试。将备选优良菌株进行活化培养后以1% (v·v-1)比例接种于40 mL筛选培养基,进行为期7 d 的振荡培养(30 ℃、200 r·min-1),同时以上一次第2 天发酵液作为下一次转接的种子液,连续转接20 次,每次发酵结束后测定培养液中赤藓糖醇浓度。保存性状优良菌株用于后续试验。
1.3.2 ARTP 诱变处理及菌株筛选 菌种的活化和菌悬液的制备过程参照1.3.1 所述,菌悬液的制备改用无菌水,无菌条件下将载片置于酒精灯外焰灼烧30 s,待冷却后放到已灭菌培养皿中,取10 µL 菌液均匀涂布于载片表面。之后进行ARTP诱变:处理距离2 mm;处理功率100 W;气流量8 SLM;处理时间为0、20、40、50、60、70、80 和100 s。诱变结束后将载片放至1 mL无菌生理盐水中制备菌悬液,经不同倍数稀释后涂布于含TTC 的固体筛选培养基。ARTP 试验由无锡源清天木生物科技有限公司完成,高产菌株的筛选和遗传稳定性试验参照1.3.1进行。
在早教方式上,线下课程是大多数年轻父母的首选,只有31%的父母接受线上课程。线上课程里,最受欢迎的是音乐课和语言课。一线城市偏爱语言课,特别是上海,比例高达93%;五线城市最爱音乐课,整体占比为80%。
1.3.3 培养基单因素试验 选取100~500 g·L-1葡萄糖(C6H12O6·H2O)、0~15 g·L-1酵母粉、0~5 g·L-1蛋白胨、0~20 g·L-1氯化钠、0~100 mg·L-1硫酸铵、0~500 mg·L-1磷酸二氢钾、0~100 mg·L-1维生素B1、0~50 mg·L-1肌醇六磷酸、0~400 mg·L-1司班20、0~10 mg·L-1吐温80、0~20 mg·L-1硫酸镁(MgSO4·7H2O)、0~1 mg·L-1硫酸亚铁(FeSO4·7H2O)、0~20 mg·L-1硫酸铜(CuSO4·5H2O)、0~20 mg·L-1硫酸锌(ZnSO4·7H2O)、0~20 mg·L-1硫酸锰(MnSO4·H2O)、0~20 mg·L-1氯化钙,以及初始pH 值4~6 和装液量20~60 mL 进行单因素试验,每组成分选择5 个浓度梯度,每组设置3 次平行试验,以赤藓糖醇浓度为指标确认单因素的最佳条件。用于单因素试验的基本培养基组成及培养条件:330 g·L-1葡萄糖、5 g·L-1酵母浸出粉、5 g·L-1氯化钠、0.5 g·L-1磷酸二氢钾,初始pH值6.0,装液量40 mL,发酵周期168 h。
1.3.4 Plackett-Burman (PB)试验设计 根据单因素试验结果,依据Design-Expert 8.0.6.1软件中的PB设计原理,选取葡萄糖(A)、酵母粉(B)和蛋白胨(C)等14个因素进行三水平的试验设计及数据处理,以确定影响显著的因素以及最佳培养基组成。因素水平设计见表1。
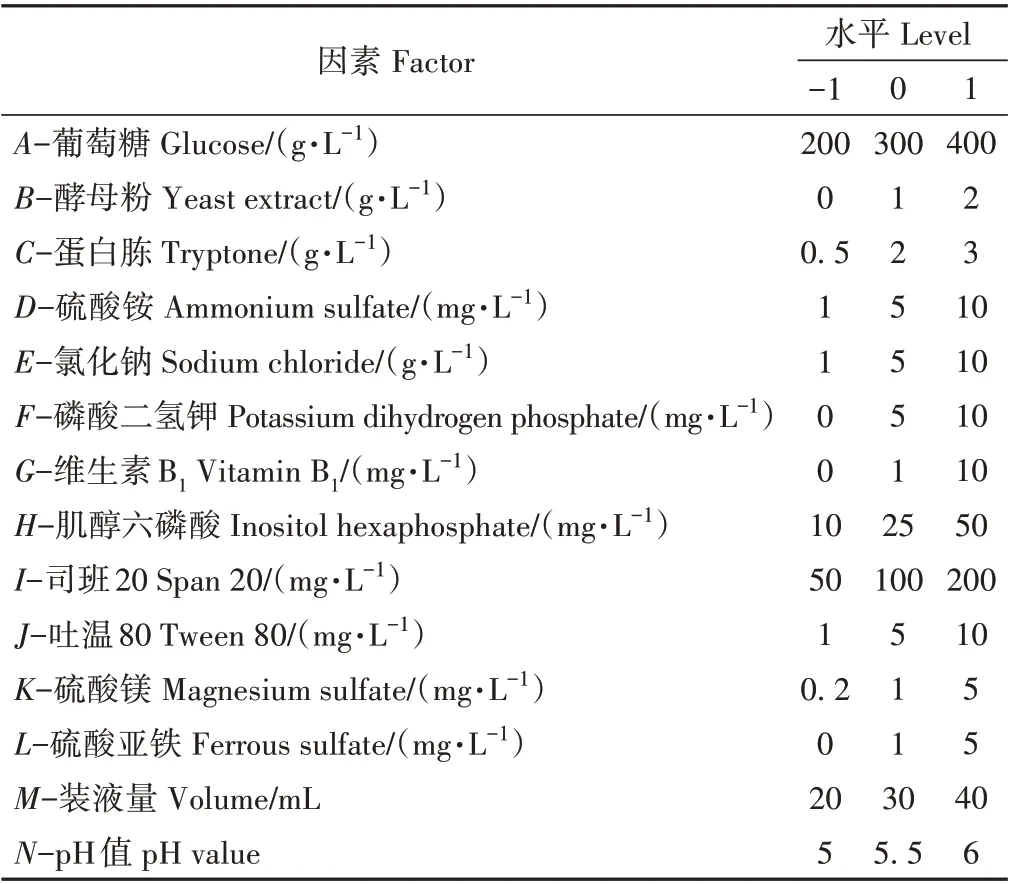
表1 PB试验设计因素与水平Table 1 Factors and levels for PB test
1.3.5 赤藓糖醇发酵试验及相关指标测定
1.3.5.1 摇瓶发酵试验 挑取诱变后生长较快且颜色较深单菌落于5 mL YPD培养基中进行过夜活化培养,之后以5% (v·v-1)比例接种于40 mL发酵培养基中进行为期7 d的连续培养,发酵结束后取样测定发酵液中赤藓糖醇浓度。
1.3.5.2 罐上分批发酵试验(batch fermentation,BF)挑取单菌落过夜活化培养,之后以5%比例转接于30 mL种子培养基(250 mL 摇瓶)中,于30 ℃、200 r·min-1条件下培养24 h,制备一级种子液,随后以5%比例转接于80 mL种子培养基(500 mL 摇瓶)中培养制备二级种子液,之后以10%比例转接于2.0 L 发酵培养基(发酵罐体积3.7 L),控制通气量在250 NL·h-1,转速500 r·min-1,罐压0.1 MPa,发酵周期为8 d。发酵过程中每隔24 h取样测定赤藓糖醇浓度、葡萄糖浓度、菌液OD600、菌体干重和pH值。
1.3.5.3 罐上两阶段pH 调控法分批发酵(two-stage batch fermentation,TSBF)种子液制备过程参照分批发酵试验法,上罐时第一阶段控制葡萄糖初始浓度为50 g·L-1,发酵时间持续48 h,之后补加葡萄糖浓度至243 g·L-1;pH 值控制为第一阶段自然和第二阶段4.0(TSBF1)、第一阶段6.0和第二阶段4.0 (TSBF2)。
1.3.5.4 发酵液中葡萄糖和赤藓糖醇浓度测定 产物和底物浓度测定采用高效液相色谱(high performance liquid chromatography,HPLC)法,参照文献[14]所述,检测条件:柱温35 ℃,上样量10 µL,流动相为0.5 mmol·L-1硫酸,流速0.6 mL·min-1。
1.3.5.5 菌体干重测定 定时取样5 mL 用于离心收集菌体,使用无菌去离子水洗涤菌体沉淀两次后置于恒温干燥箱烘干至恒重,计算菌体干重(g·L-1)。
1.3.6 数据统计学分析 研究中所涉及生物学试验均重复3 次,每次3 组平行,数据差异显著性分析由Origin 9.0 软件中的ANOVA 分析方法完成[15],选用Bonferroni 多重比较法,P<0.05 表示两组数据间差异显著。
2 结果与分析
2.1 60Co-γ射线辐射选育赤藓糖醇高产菌株
选择60Co-γ射线不同辐射剂量处理解脂亚罗酵母WT5。由致死率曲线可知,当辐射剂量大于800 Gy时,细胞的致死率达90%以上,而当辐射剂量为2 000 Gy时,细胞致死率为100% (图1-A)。一般情况下,致死率偏低不易获得性状优良菌株,而致死率过高易造成菌种性能的大幅改变。为确定最佳辐射剂量,分别挑取800、1 200 和1 600 Gy 诱变条件下共51 株菌进行测试。结果显示,在800 Gy 辐射条件下,挑取的12 株菌中发生正突变的有3 株,负突变的有5 株,正突变率为25%(图1-B)。此外,在1 200 Gy 辐射条件下挑取的20 株菌中,正突变菌株为10 株,正突变率为50%。然而,在1 600 Gy 辐射条件下,菌种的负突变率明显上升,在挑取的19株菌中,发生负突变的有13株,负突变率达68.42%,而正突变率仅为15.79%。在挑取的所有突变菌株中,赤藓糖醇最高产量可达40.50 g·L-1,是出发菌株WT5 (25.20 g·L-1)的1.61倍。紧接着对该突变株进行遗传稳定性测试,结果显示在连续转接20 次后,该菌株的赤藓糖醇产量仍然稳定(图1-C)。综上可知,60Co-γ 射线辐射剂量在1 200 Gy 左右时较为适宜,并通过辐射诱变成功获得了赤藓糖醇产量明显提升的优良菌株,将其命名为解脂亚罗酵母WC18。
2.2 ARTP诱变选育赤藓糖醇高产菌株
以菌株WC18为对象,进一步采用ARTP处理。结果表明,随着处理时间的延长,细胞致死率逐步上升,其中处理时间为50 s时,细胞致死率达96.5%,而当处理时间为100 s 时,细胞致死率为100%(图2-A)。为考察ARTP 诱变最佳条件,分别挑取不同处理时间下的59 株菌进行测试。结果显示,诱变时间为20 和40 s时,菌株发生负突变的概率较大,分别为40% 和44.44% (图2-B)。当诱变时间为50 s时,在选取的15株菌中,正突变和负突变的菌株数分别为5 和7,正负突变率分别为33.33%和46.67%。类似地,当诱变时间增加至60 s,在所挑选的菌株中,正负突变率均为40%。然而,进一步增加诱变时间时,菌株发生负突变的概率增加明显,可达80%。在挑取的所有突变菌株中,赤藓糖醇最高产量可达60.80 g·L-1,是出发菌株WC18的1.50倍。紧接着对该菌株进行遗传稳定性测试,结果显示在连续转接20 次后,该菌株的赤藓糖醇产量仍然稳定(图2-C)。综合可知,ARTP最佳诱变时间在50~60 s 之间,并在WC18 基础上,通过进一步诱变筛选获得一株赤藓糖醇产量明显提升的优良菌株,将其命名为解脂亚罗酵母CA20。
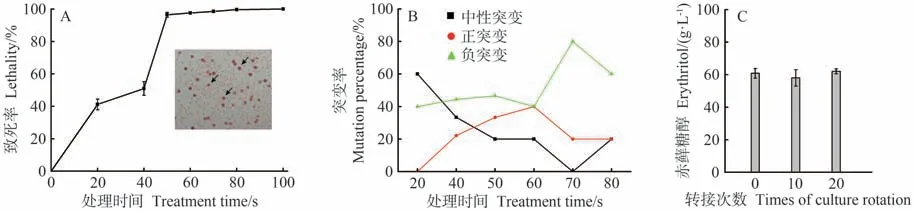
图2 ARTP诱变及菌株筛选Fig.2 Screen of strains with enhanced synthesis of erythritol by ARTP mutation
2.3 培养基成分及发酵条件对解脂亚罗酵母CA20产赤藓糖醇的影响
为确定赤藓糖醇发酵的最优培养基组分,首先考察了不同碳源浓度、氮源、无机盐、生长因子、表面活性剂、金属离子、初始pH 值和装液量对赤藓糖醇产量的影响。结果显示,在测试的葡萄糖、酵母粉、蛋白胨、硫酸铵、氯化钠、磷酸二氢钾、维生素B1、肌醇六磷酸和司班20中,随着各成分浓度的增加,赤藓糖醇的产量均呈现先增加后减少的趋势,表明所选测试浓度合适,其中各组分的最佳浓度为300 g·L-1、1 g·L-1、2 g·L-1、5 mg·L-1、5 g·L-1、10 mg·L-1、1 mg·L-1、25 mg·L-1和100 mg·L-1(图3)。在最佳浓度条件下,赤藓糖醇产量皆在P<0.05、P<0.01或P<0.001水平显著高于最低浓度条件。
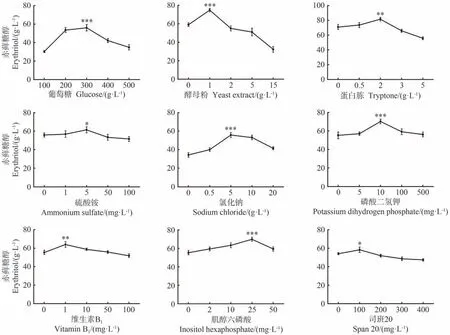
图3 培养基成分对CA20产赤藓糖醇的影响Fig.3 The effect of medium compositions on the erythritol production by CA20
培养基中分别添加吐温80、硫酸镁和硫酸亚铁亦可促进细胞合成赤藓糖醇,其最佳添加浓度分别在5 mg·L-1、1 mg·L-1和0.001 mg·L-1,该条件下赤藓糖醇产量显著高于最低浓度条件(P<0.05,图4)。此外,摇瓶装液量和发酵初始pH 对细胞合成赤藓糖醇具有重要影响,其中最佳装液量和发酵初始pH 值为30 mL 和5.5。相比于葡萄糖等14 种单因素对酵母细胞合成赤藓糖醇的影响,研究发现硫酸铜、氯化钙、硫酸锌和硫酸锰的添加对细胞合成赤藓糖醇无明显促进作用。
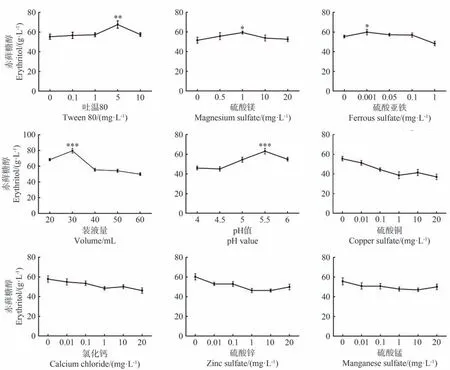
图4 培养基成分及培养条件对CA20产赤藓糖醇的影响Fig.4 The effect of medium compositions and culture conditions on the erythritol production by CA20
2.4 Plackett-Burman试验设计结果与分析
基于单因素结果,选取14因素和3水平进行PB设计,结果见表2。根据PB 设计,赤藓糖醇的产量范围在16.23~92.02 g·L-1。
利用Design-Expert 8.0.6 软件对表2 数据进行处理,结果显示模型F值为23.96(P<0.01),表明模型可信且具有意义,R2=0.963 2 表明试验数据大部分可用该模型解释(表3)。另外根据F值可知,对酵母细胞合成赤藓糖醇影响极显著(P<0.01)的因素表现为C>B>A,影响显著(P<0.05)的因素表现为K>I>L>M>H。为获得最佳培养基组合及培养条件,利用软件对PB数据进行拟合,选取拟合后赤藓糖醇产量最高组分进行实际发酵验证。模拟所获赤藓糖醇最高产量为93.40 g·L-1,实际发酵试验中,赤藓糖醇产量为122.60 g·L-1,表明PB 模拟结果可靠。因此,模拟后的最佳组分:243 g·L-1葡萄糖、1.92 g·L-1酵母粉、2.98 g·L-1蛋白胨、4.70 mg·L-1硫酸铵、6.85 g·L-1氯化钠、3.30 mg·L-1磷酸二氢钾、0.65 mg·L-1维生素B1、49 mg·L-1肌醇六磷酸、193 mg·L-1司班20、7 mg·L-1吐温80、0.42 mg·L-1硫酸镁、0.002 mg·L-1硫酸亚铁、装液量21 mL 和初始pH值5.98,并使用该组分进行后续赤藓糖醇的罐上发酵试验。
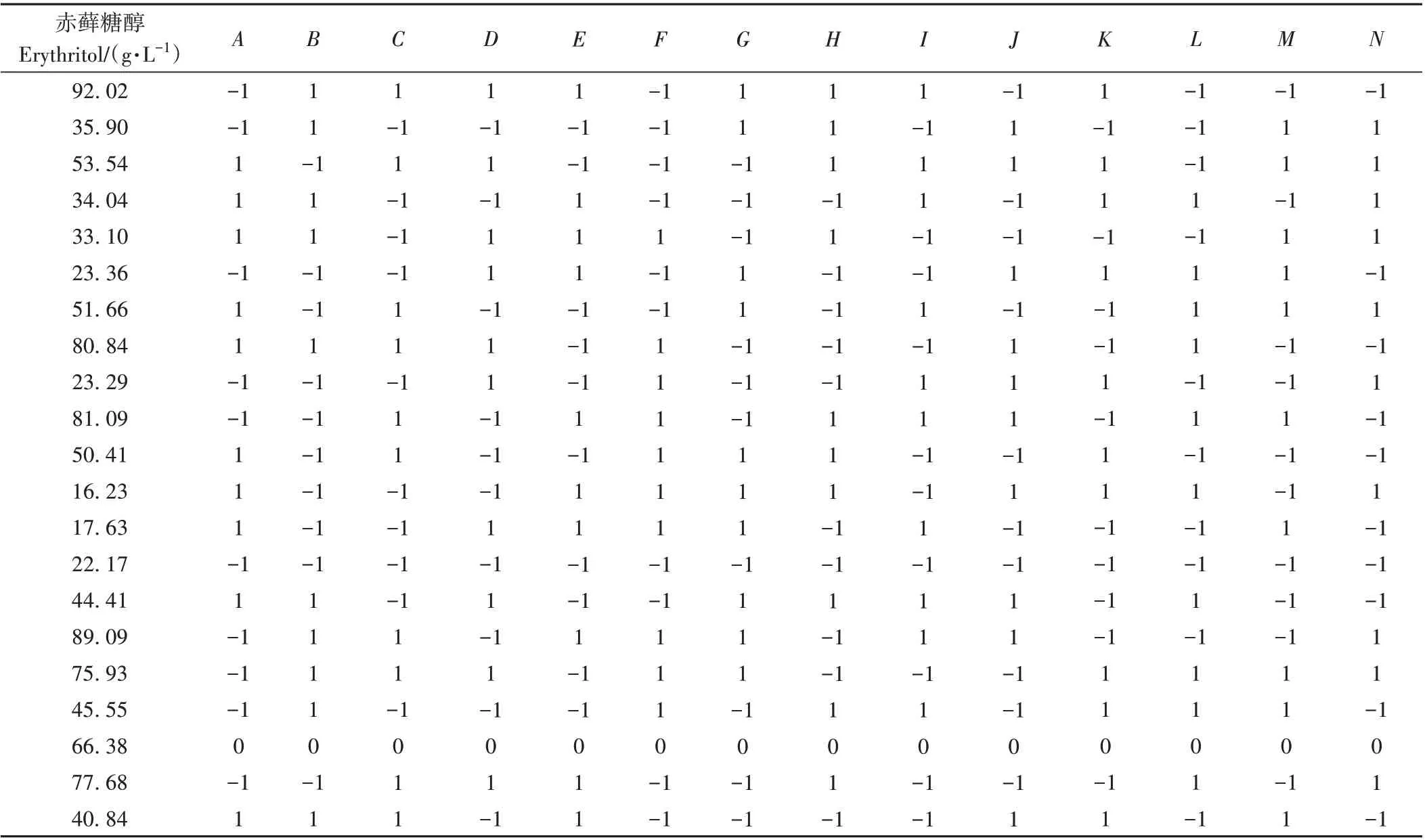
表2 PB试验设计及结果Table 2 The design and results of Plackett-Burman
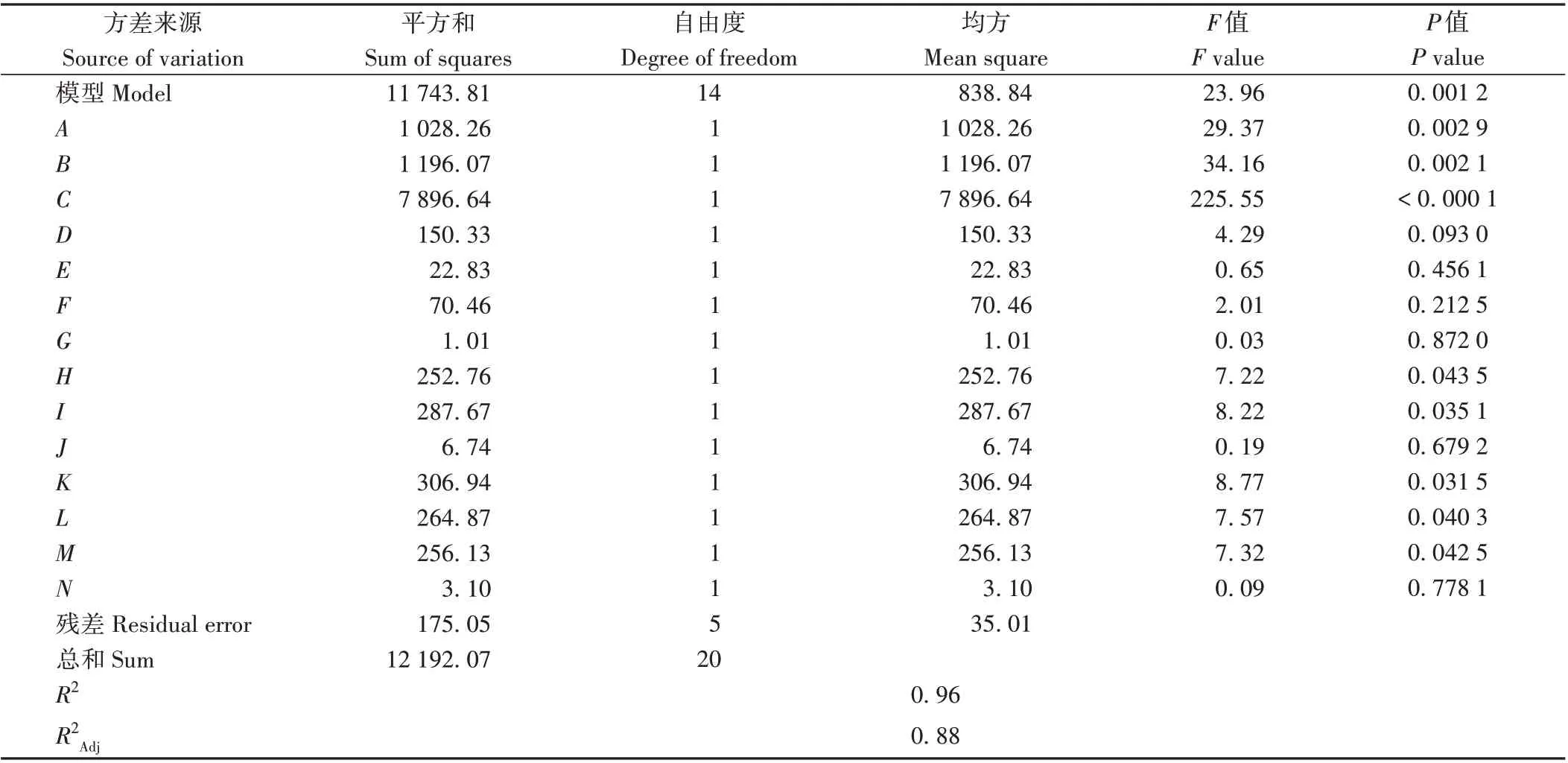
表3 PB试验方差分析Table 3 Analysis of variance of results from Plackett-Burman design
2.5 不同培养模式对解脂亚罗酵母CA20 发酵产赤藓糖醇的影响
为探索不同培养模式对酵母细胞代谢合成赤藓糖醇的影响,比较了分批发酵(BF)和两阶段pH 调控分批发酵下(TSBF1 和TSBF2)赤藓糖醇的产量和得率。结果显示,在分批发酵中,发酵液pH 值随着发酵时间的增加而逐步降低,最终稳定在4左右,葡萄糖浓度在192 h后接近于0,赤藓糖醇产量为131 g·L-1(图5-A)。相比于分批发酵,TSBF1模式下,赤藓糖醇产量可提高至142 g·L-1(图5-B)。进一步在第一阶段和第二阶段分别控制pH 值为6.0 和4.0 条件下,赤藓糖醇产量可进一步增加至156 g·L-1(图5-C)。
从得率角度分析,TSBF2 模式下赤藓糖醇的得率为0.58 g·g-1,显著高于BF模式下的0.54 g·g-1(表4,P<0.05)。然而两阶段发酵周期较长,因此TSBF1 和TSBF2 模式下的赤藓糖醇产率均低于BF 模式。其中,TSBF1 和TSBF2 模式下的赤藓糖产率分别为0.59 和0.61 g·L-1·h-1,显著低于BF 模式下的0.68 g·L-1·h-1(P<0.01)。此外,TSBF1 和TSBF2 模式下的单位细胞得率分别为22.59和17.69 g·g-1DCW,显著高于BF模式下的6.65 g·g-1DCW (P<0.001),这主要因为较低pH 值条件下细胞浓度较低,同时也表明较低pH 值条件下有利于细胞代谢合成赤藓糖醇(图5-D)。综合上述结果可知,通过调节发酵过程中发酵液的pH 值,可实现赤藓糖醇产量和得率的提升。
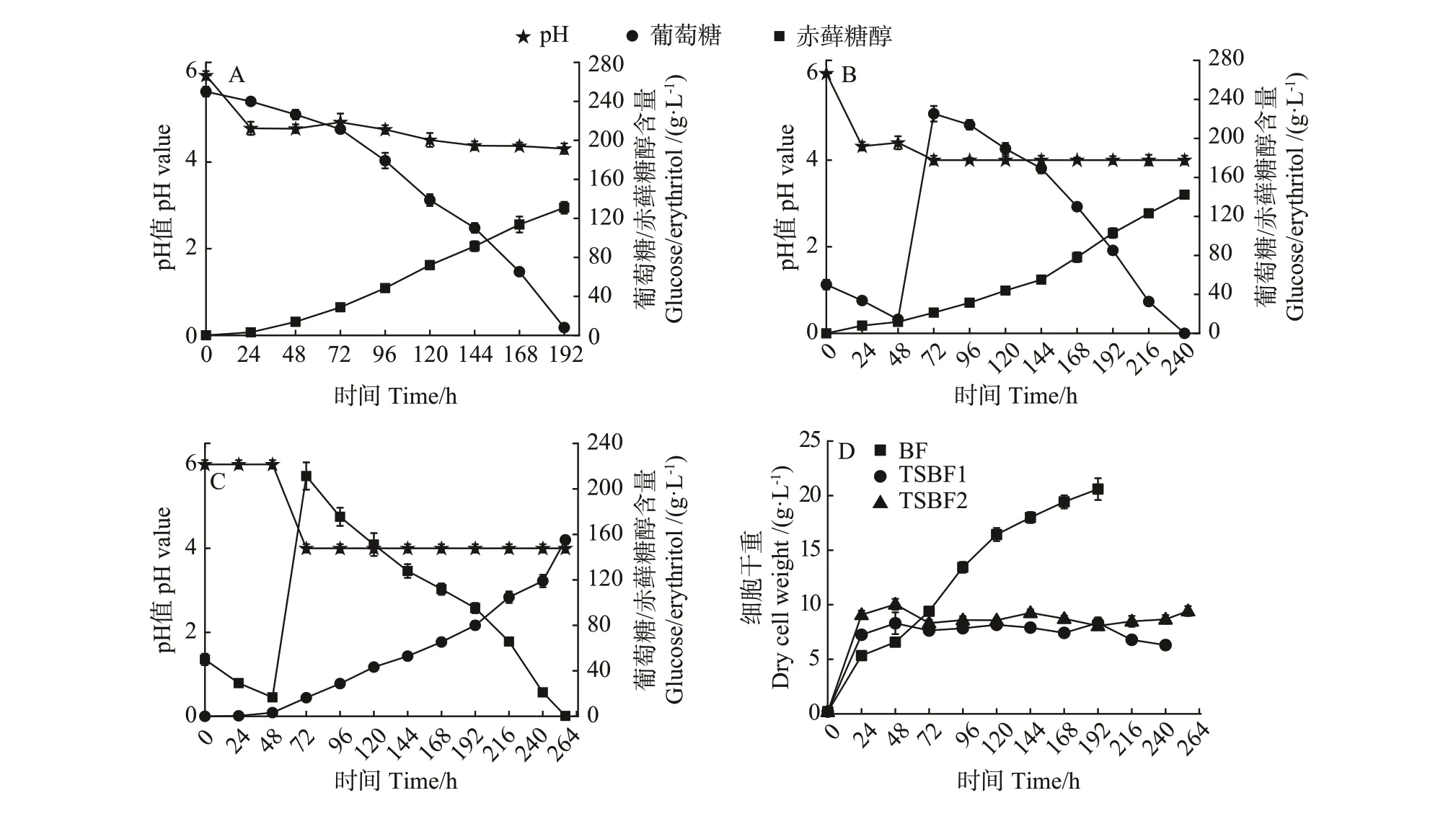
图5 不同培养模式下的赤藓糖醇发酵过程曲线Fig.5 Fermentation curves of erythritol under different cultivation modes
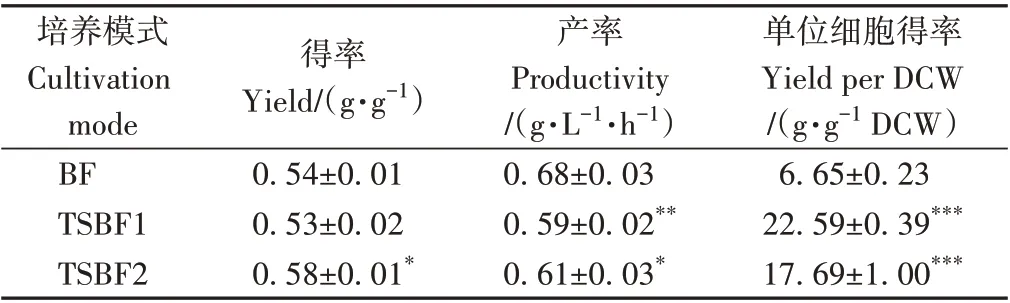
表4 不同培养模式下赤藓糖醇的得率、产率和单位细胞得率Table 4 The effect of cultivation modes on the yield,productivity and yield per DCW of erythritol
3 讨论
工业菌种选育过程中,诱变是主要方法之一。针对赤藓糖醇生产菌种的诱变选育,先前研究主要以紫外线和化学诱变为主[7-8]。紫外诱变虽然操作简单,但菌株诱变后的正突变率相对较低,菌株筛选过程比较耗时[16],而使用化学试剂进行诱变易对环境产生污染。相较于紫外诱变和化学诱变,γ 射线诱变和ARTP诱变方法具有突变率高和环境友好等特点[12]。然而,目前两种方法在赤藓糖醇高产菌种的选育中尚未被深入应用。本研究证实,γ射线辐射结合ARTP诱变可用于高产赤藓糖醇解脂亚罗酵母的快速和高效选育,具体表现为突变菌株筛选过程短,筛选菌株数量较少,在合适的诱变剂量和时间条件下,得到的正突变菌株数多。在最佳诱变条件下,本研究最终获得一株高产菌CA20,赤藓糖醇产量相对于出发菌株WT5 提高141.27%。同时,本研究发现γ射线辐射和ARTP诱变产生高正突变率的同时,负突变率也较高,表明一定条件下两种诱变方法对解脂亚罗酵母的性状影响均较为明显,在实际的育种过程中需要选择合适的剂量和处理时间。
前人研究发现,培养基组分及培养条件对解脂亚罗酵母代谢合成赤藓糖醇影响明显,其中溶液渗透压是主要因素[17-18]。本研究中,葡萄糖添加量与溶液渗透压密切相关,单因素试验结果表明,初始葡萄糖浓度在300 g·L-1左右时有利于酵母细胞代谢合成赤藓糖醇,而优化后的培养基中葡萄糖浓度在250 g·L-1时赤藓糖醇产量最高。前人研究表明,除碳源以外,可通过添加金属离子、表面活性剂以及控制碳氮比以增加赤藓糖醇还原酶活性,从而增加细胞的赤藓糖醇合成量[4,19];在培养基中加入Cu2+和Zn2+能够增加胞内赤藓糖还原酶的活性,从而促进赤藓糖醇的合成[20];此外,Mn2+可促进赤藓糖醇由胞内到胞外的转运过程[21]。Lee等[22]研究发现,在培养基中加入10 mg·L-1CuSO4·5H2O和10 mg·L-1MnSO4·4H2O 可使胞内赤藓糖还原酶活性提高34%,最终赤藓糖醇产量提高33%。但本研究发现培养基中添加硫酸铜、氯化钙、硫酸锌和硫酸锰未能促进细胞代谢合成赤藓糖醇,而加入硫酸镁和硫酸亚铁有助于提升赤藓糖醇产量,但具体机制仍有待进一步分析。除此以外,在培养基中添加表面活性剂可影响细胞形态以及胞内还原酶活性[23-24]。Kang 等[23]发现培养基中加入甜菜碱、吐温20或吐温80可显著增加球头三型孢菌赤藓糖醇产量。类似地,本研究表明添加一定浓度吐温80 和司班20 可促进解脂亚罗酵母代谢合成赤藓糖醇。另外,本研究发现培养基中添加维生素B1和肌醇六磷酸有助于细胞合成赤藓糖醇,与先前研究结果一致[25-26]。
前人研究表明,不同培养模式如分批发酵和连续发酵等对酵母细胞代谢合成赤藓糖醇影响显著[4]。Rakicka 等[27]发现两阶段连续发酵条件下赤藓糖醇的产量可达199.4 g·L-1,是分批发酵条件下的2.5倍。Liu等[28]研究表明高渗透压和较低的pH 值条件(pH 值为3.0)有助于细胞代谢合成赤藓糖醇。另一项研究中,Mirończuk 等[29]使用两阶段发酵法,即第一阶段使用30 g·L-1糖蜜作为碳源促进细胞生长,第二阶段使用200 g·L-1的甘油作为碳源促进细胞合成赤藓糖醇,最终得到赤藓糖醇的产量和得率分别为113.9 g·L-1和0.57 g·g-1。本研究表明,发酵第一阶段使用较低浓度葡萄糖(50 g·L-1)且维持体系pH 值在6.0 可以促进细胞生长,而第二阶段维持pH 值在4.0 可以促进细胞代谢合成赤藓糖醇,最终所获赤藓糖醇的产量和得率分别为156 g·L-1和0.58 g·g-1,显著高于分批发酵模式下的131 g·L-1和0.54 g·g-1。此外,是否可以通过其他培养模式,如连续发酵和分批补料发酵,从而进一步提高解脂亚罗酵母CA20 的赤藓糖醇产量和产率,仍有待进一步研究。
近年来,结合代谢途径改造和发酵工艺优化,如过表达葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase)和赤藓糖还原酶(erythrose reductase)等,赤藓糖醇产量已达200 g·L-1左右,得率已达0.60 g·g-1,最高产率已超过2.0 g·L-1·h-1[30-32]。本研究结果与该研究相比仍有所不足,下一步可通过代谢改造和工艺优化提升解脂亚罗酵母CA20 赤藓糖醇产率,从而降低生产成本。
4 结论
本研究结果表明,60Co-γ 射线和ARTP 复合诱变用于高性能解脂亚罗酵母的选育,具有筛选周期短和正突变率高的特点,其中最佳条件为辐射剂量1 200 Gy和处理时间60 s,所获菌株CA20赤藓糖醇产量相对于出发菌株WT5 提高141.27%;培养基中添加Fe2+、Mg2+、吐温80和司班20有助于促进细胞代谢合成赤藓糖醇;采用TSBF2 培养模式可显著提高赤藓糖醇产量和产率。后期可通过基因组测序挖掘突变菌株高产赤藓糖醇的分子机理,指导高产菌种的定向选育和改造。

