尼妥珠单抗与TPF的联合运用在头颈鳞癌中治疗效果的初步分析
王亚琛,郑 旸,杨月美,刘 婕,宋晓萌,丁 旭,武和明,吴煜农
鳞状细胞癌约占头颈部恶性肿瘤的90%[1]。而90%的鳞状细胞癌都会高表达表皮生长因子受体(epidermal growth factor receptor,EGFR)。EGFR被激活后,一系列下游信号通路激活,导致肿瘤细胞增殖能力增强、恶性肿瘤患者治疗预后变差[2]。尼妥珠单抗(Nimotuzumab)是一种针对EGFR胞外区的人源化IgG1单抗。它通过阻断EGF和转化生长因子-α(transforming growth factor-alpha,TGF-α)与EGFR的结合,从而抑制肿瘤细胞的生长,肿瘤血管生成,并促进肿瘤细胞凋亡[3]。
TPF化疗方案中包含3种药物,分别为多西他赛、顺铂、5-氟尿嘧啶。它们作用于细胞周期的各个阶段,已有文献证明TPF在头颈鳞状细胞癌的治疗中有较为有效稳定的疗效[4-5]。
目前临床上较少有将TPF化疗与Nimotuzumab联合运用效果回顾分析的文章报道。本研究对联合化疗患者的肿瘤反应率、生存率进行了分析,并对其机制进行了初步探讨。
1 资料与方法
1.1 患者收集
回顾性地收集了2016—2021年在江苏省口腔医院进行术前诱导化疗、术后辅助化疗、单纯进行化疗保守治疗的头颈肿瘤患者62例。入组标准:入院前未进行任何化学治疗;年龄24~81岁;血液学、肾功能和肝功能良好,Karnofsky评分≥70[6];签署肿瘤化疗知情同意书;肿瘤组织经切取活检均明确诊断为鳞状细胞癌,可以获得包括病历、医嘱及病理报告在内的完整的医疗数据;对化疗耐受性良好,未发生导致化疗进程中断的严重不良反应。
1.2 免疫组化染色及判读
A组(TPF+尼妥珠单抗)、B组(TPF)及单用尼妥珠单抗患者治疗前切取活检及术后的病灶组织蜡块共3对,行连续切片后置于洁净载玻片上,制成12张组织切片,并于干燥避光黑色器皿内间隔放置,-26 ℃低温保存。
1.2.1 石蜡组织切片 EGFR免疫组化染色重组Anti-EGFR抗体[E114]购于艾博抗上海贸易有限公司。将石蜡组织切片脱蜡,水化,抗原修复,阻断内源性过氧化物酶,滴加Anti-EGFR抗体试剂,滴加酶标羊抗鼠IgG聚合物,滴加DAB显色剂,复染,脱水,透明,封片。待EGFR免疫组化染色完成,用图像采集软件的高倍成像显微镜采集图像,将获取的图片进行分析。
1.2.2 结果判读 免疫组化结果由2位病理医生进行判读。EGFR染色阳性物质主要定位于细胞膜和细胞质,呈棕黄色,以细胞膜更明显[7]。故认定细胞膜和(或)细胞质被染成棕黄色者为阳性细胞,根据上皮组织EGFR免疫组化染色阳性细胞量进行染色程度分类,≤25%记为+,25%~50%记为++,>50%记为+++。
1.3 药物治疗
TPF化疗方案为:T(多西他赛,60 mg/m2),P(顺铂60 mg/m2),F(替吉奥胶囊,1粒25 mg;<1.25 m2为40 mg/次;1.25~1.50 m2为50 mg/次;≥1.5 m2为60 mg/次)。多西他赛及顺铂于第一天静脉滴注完毕,而替吉奥胶囊口服给药1日2次持续3周,为TPF治疗的一个周期。住院治疗期间给予药物水化,保护肾功能,及时复查血常规并予以止吐、抗感染、升白细胞等对症处理。每例患者都进行了2~3周期的TPF治疗。A组患者每周期化疗前都接受300 mg的尼妥珠单抗生理盐水稀释后静脉滴注,而B组患者仅接受TPF治疗。治疗类型为表1所示。利用Fisher检验后得知两组在治疗类型上无显著统计学差异。

表1 A组和B组治疗类型Tab.1 Treatment classification of group A and B n(%)
1.4 肿瘤缓解率
治疗开始前,患者接受头颈部增强CT检查明确肿瘤大小。末次疗程结束三周后,再次拍摄患者头颈部增强CT,并与前片作比对来显示肿瘤大小改变。肿瘤缓解率的评价标准采用RECIST 1.1版的实体瘤治疗疗效评价标准:完全缓解(complete response,CR)[8]为所有的靶病灶消失,病理性淋巴结短径<10 mm;部分缓解(partial response,PR)为靶病灶长径总和缩小≥30%;疾病进展(progress disease,PD)为靶病灶长径总和增加≥20%,并且其绝对值增加超过5 mm,出现新病灶也视为PD;疾病稳定(stable disease,SD)为靶病灶长径总和有缩小但未达PR或有增加但未达PD。有效缓解率(response rate,RR)为CR+PR。
1.5 统计学分析
两组患者一般资料、近期疗效的比较均采用χ2检验及Fisher检验;无进展生存(progression-free sunival,PFS)和总生存(overall survival,OS)的描述采用生存曲线方法,并运用Log-rank统计分析;所有统计分析由Graphpad 6.0及IBM SPSS 20.0完成,P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线数据
患者基线数据如表2所示,总计62例患者,患者的年龄在24~80岁。其中纳入的4例口咽癌患者术后免疫组织化学染色结果均提示p16(-),故根据第八版NCCN指南同样适用口腔癌TNM分期。在性别、年龄、TNM分期、肿瘤序列治疗过程中是否手术,经Fisher检验分析结果显示,两组患者基线数据无显著性统计学差异。
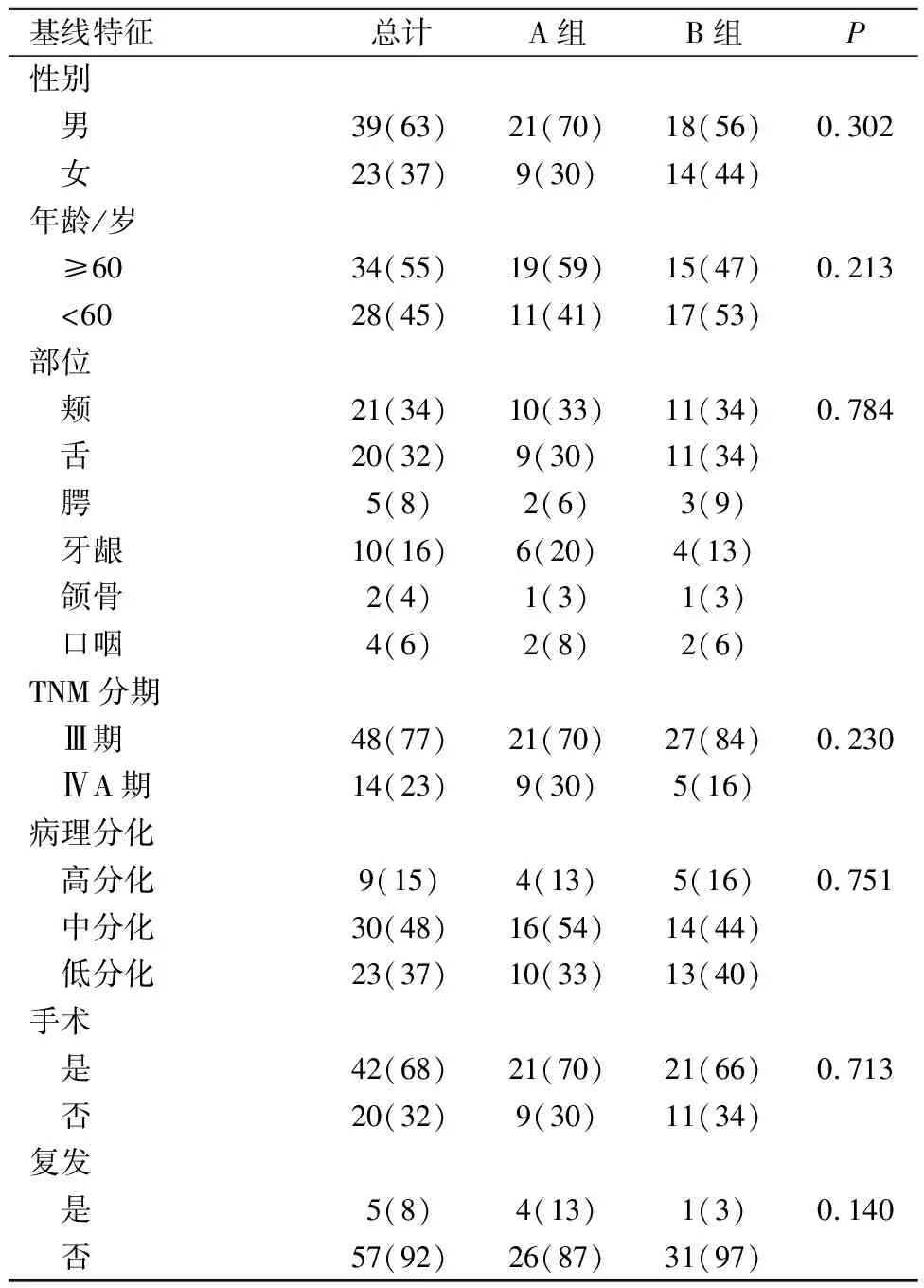
表2 62例头颈鳞癌患者基本信息Tab.2 Basic characteristics of 62 patients n(%)
2.2 短期疗效评估:肿瘤缓解率
如表3所示,对进行诱导化疗以及单纯通过化疗控制肿瘤的患者3周后,如图1所示,利用患者化疗前后头颈部增强CT对比来评估肿瘤大小变化。A组肿瘤RR为78%,B组的肿瘤RR为43%。通过Fisher检验得知两组差异有统计学意义。

表3 肿瘤缓解率Tab.3 Tumor response rate n(%)
2.3 长期疗效评估:患者预后评估
截至最后一次随访,中位随访时间为37个月(10~64个月),A组的5年生存率为72.2%,B组的5年生存率为36.6%(P<0.05),A组的PFS率为63.8%,B组的PFS率为36.2%(P<0.05)。如图2~3所示,A组与B组在生存率及PFS率均有显著差异。如图4所示,两组中单纯化疗、术前诱导化疗患者的5年生存率差异有统计学意义(P<0.05)。A组为64.6%,B组为30.0%。

图2 患者OS曲线图Fig.2 Overall survival curve of patients

图3 患者疾病PFS曲线图Fig.3 Progression-free survival curve of patients
2.4 患者手术前后组织切片免疫组化染色
光镜下调整倍率进行图片采取,如图5所示。化疗前四枚切片细胞膜及细胞质均有大量棕黄色阳性细胞。而化疗后视野内可见阳性细胞数量明显减少。收集A组患者、B组患者和单用尼妥珠单抗患者化疗前后蜡块共6枚进行免疫组化染色,EGFR表达量读片结果如表4所示:接受TPF治疗后,患者头颈肿瘤组织中EGFR表达量均下降,且A组较其余两组下降最为显著。

图4 术前诱导化疗及单纯化疗患者5年OS率Fig.4 5-year overall survival of patients with preoperative induction chemotherapy and chemotherapy alone
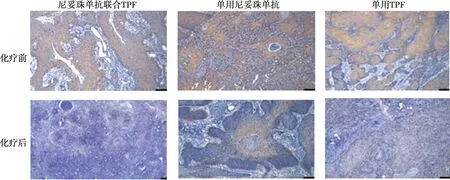
图5 化疗前后病灶组织切片EGFR免疫组化染色结果( ×100)Fig.5 EGFR immunohistochemical staining in tissue sections( ×100)
3 讨 论
中晚期头颈部鳞状细胞癌的治疗一直相对困难,单纯的手术治疗难以取得很好的疗效。研究表明头颈部鳞状细胞癌患者对诱导化疗具有良好的耐受性[9]。诱导化疗可以杀死小的隐匿性转移灶,从而降低远处转移的发生率;还可减少肿瘤体积,缩小放疗靶体积,提高放疗疗效,减少不良反应,有可能提高器官保存成功率从而提高患者生活质量[10]。

表4 EGFR免疫组化染色结果Tab.4 Results of immunohistochemical staining
头颈鳞癌患者接受尼妥珠单抗联合TPF诱导化疗对比单纯TPF诱导化疗会获得更好的疗效。这点得到了一些临床研究的验证。2018年,Subramanian等[11]发表了一项内含14例患者的回顾性研究,该研究表明,将尼妥珠单抗添加到复发性和转移性头颈部鳞状细胞癌的标准治疗中后,肿瘤应答率和总体生存率得到提高,且患者不会出现额外的不良反应。这可能是与正常组织相比,只有EGFR高表达的头颈肿瘤组织中会聚集更多的尼妥珠单抗。有体外细胞实验表明:仅在EGFR中、高表达的细胞系中才能观察到尼妥珠单抗与EGFR的结合[12]。与临床不良反应较多的西妥昔单抗相比[13],尼妥珠单抗具有中度的亲和力,基本不与正常组织表面的EGFR结合,减少了临床运用时的不良反应[14]。
短期的化疗疗效表现为肿瘤缓解率。A组和B组肿瘤RR分别为78%和43%。两组之间肿瘤缓解率具有统计学差异(P=0.029)。这一观察结果与Tian等在2020年发表的一项研究结果一致。该研究报告中,无法手术切除的下咽癌患者诱导化疗后的肿瘤RR对比单纯TPF治疗同样具有统计学差异。但该研究中两组肿瘤RR分别为91.7%、58.3%[15]。推测可能是本研究中纳入的部分患者的疾病多为口腔癌的缘故。
尼妥珠单抗与TPF联合运用的长期生存方面得到的结果令人振奋。A组和B组的5年生存率为72.2%和36.6%,差异有统计学意义(P=0.023);A组和B组的5年疾病PFS率为63.8%和36.2%,A组优于B组,差异亦有统计学意义(P=0.018)。A组及B组中诱导化疗、单纯化疗的患者5年生存率差异有统计学意义(P=0.048)。结合肿瘤缓解率的结果,可以推断联合用药的优势主要体现在无法进行根治性手术及需要进行术前诱导化疗的患者身上。尽管两组比较差异有统计学意义,仍需要更大的样本量增强Log-rank的检验功率。
90%的头颈部鳞状细胞癌组织中均可以检测到EGFR高表达。尼妥珠单抗与EGFR的胞外区结合阻断了配体与受体的结合,最终EGFR二聚化消除。单抗受体复合体内化后被降解,导致EGFR表达下调。降低肿瘤的增殖能力及其侵袭性,提高患者的生存质量及预后[16-17]。此外有文献提及,当EGFR作为四聚体存在时也将失活[18]。TPF治疗方案中的三种药物是非特异性地作用于肿瘤细胞,起到减缓肿瘤细胞增殖、促进肿瘤细胞凋亡的作用。其中顺铂除了通过氧化应激损伤肿瘤细胞DNA来促使其凋亡外,还能从细胞膜诱导Ⅱ型跨膜蛋白和Fas配体(FasL)激活Fas受体来促进肿瘤细胞凋亡[19-21]。而EGFR是跨膜糖蛋白细胞表面受体。故猜测顺铂在细胞膜作用时,诱导EGFR由二聚体聚合为四聚体而使其失活,最终EGFR表达量下降。但尚未有顺铂与EGFR作用机制的文献报道。目前尼妥珠单抗与TPF治疗方案二者在作用方式上没有明显联系。但单用尼妥珠单抗、单用TPF后肿瘤组织切片EGFR表达量均有下降,且进行联合化疗以后下降更为明显。这一现象表明尼妥珠单抗联合TPF化疗增强了对头颈鳞癌组织EGFR表达量的下调。其中微观分子机制需要通过体内、体外研究来进一步探索。
由于本研究是回顾性研究,有一定的局限性。因纳入的患者局限在江苏省口腔医院,且尼妥珠单抗于该院从2016年才开始投入使用、至今尚未纳入头颈肿瘤医保范畴,所以没能收集到大量的数据。当随访时间增加、纳入患者数量增多时,可以更加全面精准地分析临床上尼妥珠单抗联合TPF用药的临床疗效。

