褐藻素对Keap1/Nrf2/HO-1信号通路介导的前列腺癌DU145细胞氧化应激反应的影响
张俊强 万久恺 姚浩宇 范 锐
前列腺癌是老年男性常见恶性肿瘤,死亡率仅次于肺癌,对男性人群健康造成严重影响。目前临床可通过手术切除肿瘤,一定程度提高患者生存率,但存在复发风险,中晚期患者还可通过激素去势治疗,但多数患者易发生激素抵抗,导致病情恶化,严重影响患者生存质量[1-2]。因此,迫切需要寻找有效治疗药物以延缓病情进展,延长患者生存期。近年来,随着对天然植物药物的深入研究,多种中草药及其提取物被发现具有明显的抗肿瘤作用。褐藻素是从海带科植物中提取的一种类胡萝卜素成分,具有抗炎、抗病毒、抗氧化等药理活性[3]。既往研究显示,褐藻素可抑制宫颈癌细胞[4]、鼻咽癌细胞[5]增殖,具有明显抗肿瘤作用。此外,褐藻素还被证实在非酒精性脂肪肝动物模型中具有抗氧化作用[6]。氧化应激与肿瘤进展关系密切,Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein 1,Keap1)/核因子E2相关因子2(nuclear factor-E2-related factor 2,Nrf2)/血红素氧合酶-1(heme oxygenase 1,HO-1)信号通路是体内重要抗氧化应激通路,Keap1失活可引起Nrf2高表达,促进细胞增殖,诱发基因突变,在肿瘤进展中发挥重要作用[7]。鉴于此,本研究以前列腺癌DU145细胞为研究对象,分析褐藻素对癌细胞增殖凋亡的影响,并探讨其作用机制,旨在为临床开发相关药物及治疗前列腺癌提供理论依据。
1 材料与方法
1.1 细胞系
人前列腺癌DU145细胞株,购自中国科学院上海细胞库。
1.2 主要试剂和仪器
褐藻素(98%)、2,7-二氯荧光黄乙酰乙酸(2',7'-dichlorodihydronuorescein diacetate,DCFH-DA)(美国sigma公司),含有Keap1 shRNA和阴性对照Keap1 shNC基因序列的pHBLV-U6-Scramble-ZsGreen-Puro质粒(苏州吉玛基因股份有限公司),丙二醛(malonic dialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(南京建成生物工程研究所),兔抗人Keap1、Nrf2、HO-1、B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)一抗及辣根过氧化物酶标记的山羊抗兔IgG(英国Abcam公司),FITC-PI凋亡检测试剂盒、流式细胞仪(美国BD公司),RT-PCR仪(美国Thermo Fisher Scientific公司),酶标仪、电泳仪(美国Bio-Rad公司)。
1.3 细胞培养
DU145细胞常规水浴复苏后,置入培养箱中培养,培养环境为:含有10%胎牛血清的RPMI 1640完全培养液,37 ℃、饱和湿度、5% CO2,每2~3 d换液1次,观察细胞融至80%~90%时进行传代。使用对数增殖期细胞。
1.4 MTT法检测褐藻素对DU145细胞增殖的影响
取对数增殖期DU145细胞,弃去培养基,PBS漂洗3遍,胰酶消化、离心,重悬细胞密度为5×105个/mL,96孔板中每孔加入0.1 mL细胞悬液,置于37 ℃、5% CO2培养箱中培养24 h,之后加入不同浓度褐藻素(1、10、20、40、80 μmol/L),另设不加褐藻素的空白组,各设置5个复孔,培养48 h,每孔加入10 μL MTT溶液(5 g/L),继续孵育4 h,弃上清,每孔加入150 μL二甲基亚砜,振荡溶解结晶,使用酶标仪于490 nm处观察各孔吸光(A)值,计算细胞增殖抑制率,细胞增殖抑制率=(1-各浓度褐藻素A值/空白组A值)×100%。
1.5 细胞转染和分组
将对数增殖期DU145细胞,以5×105个/mL密度接种于6孔板,细胞融合至70%时,弃去原培养基,加入新鲜培养基,加入3×106U含有Keap1 shRNA和Keap1 shNC基因序列的pHBLV-U6-Scramble-ZsGreen-Puro慢病毒质粒,37 ℃、5% CO2培养箱中培养24 h,更换培养基,继续培养48 h,加入嘌呤霉素筛选细胞,48 h后观察细胞,未感染的空细胞死亡,而病毒感染细胞存活,表示转染成功。将对数增殖期DU145细胞随机分为对照组(常规培养)、Keap1 shRNA组(转染Keap1 shRNA慢病毒质粒)、Keap1 shNC组(转染Keap1 shNC慢病毒质粒)、褐藻素组(使用40 μmol/L褐藻素处理)和褐藻素+Keap1 shRNA组(稳定转染Keap1 shRNA后,使用40 μmol/L褐藻素处理)。
1.6 流式细胞术检测细胞凋亡
各组细胞以5×105个/mL密度接种于6孔板,37 ℃、5% CO2培养箱中培养48 h,弃去培养基,PBS漂洗,胰酶消化后,置于离心管中,1000 r/min,离心5 min,弃上清,使用PBS重悬细胞,1000 r/min离心5 min,弃上清后收集细胞,加入200 μL 1×Binding Buffer重悬细胞,加入5 μL Annexin-FITC结合悬浮细胞,室温避光孵育10 min,之后加入10 μL PI染色液,4 ℃避光孵育10 min,1 h内使用流式细胞仪进行分析,检测细胞凋亡率,重复3次,取平均值。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.7 流式细胞术检测细胞中活性氧(reactive oxygen species,ROS)水平
各组细胞于6孔板中,37 ℃、5% CO2培养箱中培养24 h,胰酶消化,1000 r/min离心5 min,弃上清后收集细胞,PBS漂洗2遍,计数1×105个细胞,加入终浓度为10 μmol/L的DCFH-DA染液,37 ℃孵育30 min,PBS漂洗,使用流式细胞仪检测细胞荧光强度,以荧光强度反映细胞内ROS水平。
1.8 检测细胞中SOD、GSG-Px活力和MDA含量
各组细胞于6孔板中,37 ℃、5% CO2培养箱中培养48 h,收集培养上清,1500 r/min离心2 min,按照试剂盒说明书操作步骤,逐步添加试剂,均匀混合,酶标仪测量A值,检测细胞中SOD、GSG-Px活力和MDA含量。
1.9 RT-qPCR检测细胞中mRNA表达
收集各组细胞,TRizol法提取总RNA,测定RNA浓度和纯度。将RNA逆转录为cDNA,进行PCR反应。配制反应体系:10 μL SYBR Prmix Ex Taq,正向引物和反向引物各0.8 μL,2 μL cDNA模板,灭菌水补至总体积20 μL。将配制好的溶液置于PCR仪上进行反应,反应参数:95 ℃ 5 s,95 ℃ 30 s,60 ℃ 10 s,重复40个循环。以GDPAH为内参,采用2-△△CT法进行相对定量。实验所用引物序列见表1。
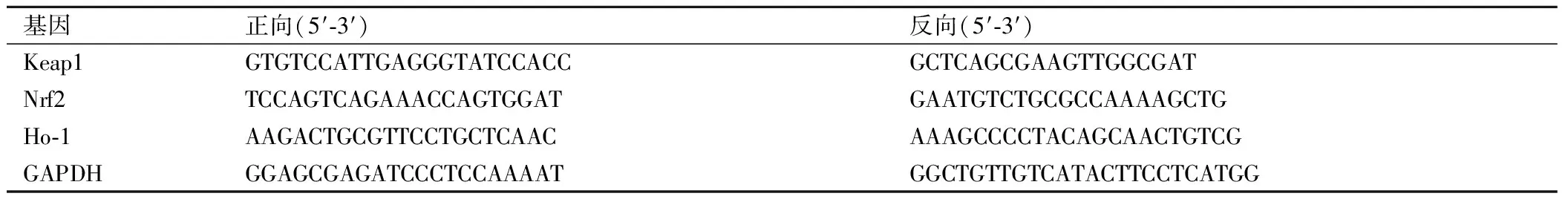
表1 引物序列
1.10 Western blot法检测细胞中蛋白表达
收集各组细胞,PBS漂洗,加入RIPA冰上裂解30 min,12000 r/min离心15 min,收集上清,BCA法测定蛋白浓度。每孔20 μg上样,进行SDS-PAGE凝胶电泳(110 V,2 h)并转膜。5%脱脂奶粉室温封闭2 h,4 ℃孵育一抗(Keap1、Nrf2、Ho-1、Bcl-2、Bax,均1∶500稀释)过夜,TBST洗膜,室温孵育二抗(辣根过氧标记的IgG,1∶2000稀释)2 h。ECL显影、定影,使用ImageJ软件扫描灰度并定量,以Keap1、Nrf2、Ho-1与内参照GAPDH灰度比值作为其相对表达量。
1.11 统计学分析
2 结果
2.1 不同浓度褐藻素对DU145细胞增殖的影响
空白组和1、10、20、40、80 μmol/L浓度褐藻素组细胞增殖抑制率分别为:0、(13.26±2.45)%、(21.33±2.79)%、(34.75±3.42)%、(49.53±3.41)%、(65.74±4.07)%。细胞增殖抑制率随着褐藻素浓度增加而升高,呈浓度依赖性(P<0.05)。后续实验选取增殖抑制率接近50%的褐藻素工作浓度,即40 μmol/L。
2.2 各组细胞凋亡率
与对照组和Keap1 shNC组比较,Keap1 shRNA组细胞凋亡率降低(P<0.05);褐藻素组细胞凋亡率升高(P<0.05)。褐藻素+Keap1 shRNA组细胞凋亡率高于Keap1 shRNA组,低于褐藻素组(P<0.05)。见表2,图1。
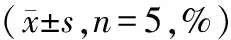
表2 各组细胞凋亡率
2.3 各组细胞ROS水平
与对照组和Keap1 shNC组比较,Keap1 shRNA组细胞ROS水平升高(P<0.05);褐藻素组细胞ROS水平低于对照组(P<0.05);褐藻素+Keap1 shRNA组细胞ROS水平低于Keap1 shRNA组,高于褐藻素组(P<0.05)。见表3,图2。
2.4 各组细胞SOD、GSH-Px活力和MDA含量
与对照组和Keap1 shNC组比较,Keap1 shRNA组SOD和GSH-Px活力降低,MDA含量升高(P<0.05);褐藻素组较对照组SOD和GSH-Px活力升高,MDA含量降低(P<0.05);褐藻素+Keap1 shRNA组SOD和GSH-Px活力高于Keap1 shRNA组而低于褐藻素组,MDA含量低于Keap1 shRNA组而高于褐藻素组(P<0.05)。见表4。

图1 流式细胞术检测细胞凋亡
2.5 各组细胞mRNA表达水平
与对照组和Keap1 shNC组比较,Keap1 shRNA组Keap1 mRNA表达降低,Nrf2和Ho-1 mRNA表达升高(P<0.05);褐藻素组Keap1 mRNA表达高于对照组,Nrf2和Ho-1 mRNA表达低于对照组(P<0.05);褐藻素+Keap1 shRNA组Keap1 mRNA表达高于Keap1 shRNA组低于褐藻素组,Nrf2和Ho-1 mRNA表达低于Keap1 shRNA组高于褐藻素组(P<0.05)。见表5。
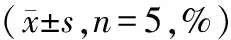
表3 各组细胞ROS水平

图2 流式细胞术检测ROS水平
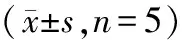
表4 各组SOD、GSH-Px活力和MDA含量
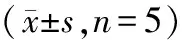
表5 各组细胞Keap1、Nrf2和Ho-1 mRNA表达水平
2.6 各组细胞蛋白表达水平
与对照组和Keap1 shNC组比较,Keap1 shRNA组Keap1、Bax蛋白表达降低,Nrf2、Ho-1和Bcl-2蛋白表达升高(P<0.05);褐藻素组Keap1、Bax蛋白表达高于对照组,Nrf2、Ho-1和Bcl-2蛋白表达低于对照组(P<0.05);褐藻素+Keap1 shRNA组Keap1、Bax蛋白表达高于Keap1 shRNA组低于褐藻素组,Nrf2、Ho-1和Bcl-2蛋白表达低于Keap1 shRNA组高于褐藻素组(P<0.05)。见表6,图3。
3 讨论
氧化还原反应在机体内普遍存在,氧化还原态的失衡与细胞增殖、分化、凋亡及基因转录、细胞信号转导等生物学过程密切相关。乏氧环境、炎性因子等外界环境可导致细胞氧化还原失衡,使细胞发生恶性转化,引起肿瘤;同时肿瘤细胞发生氧化应激,产生大量ROS,促进肿瘤细胞突变和分裂,进一步诱导肿瘤进展[8-9]。氧化应激与前列腺癌发生发展过程关系密切,参与肿瘤细胞上皮间质转化、耐药性和凋亡等过程,并可增强雄激素信号传导,促进去势抵抗性前列腺癌进展,给临床治疗前列腺癌带来极大挑战[10]。
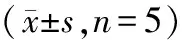
表6 各组细胞蛋白表达水平
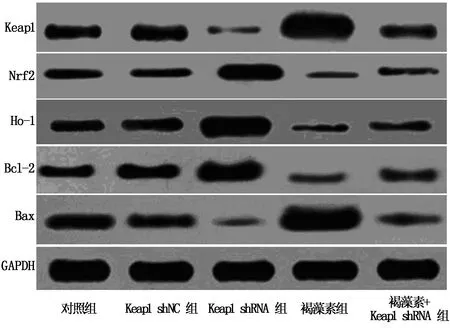
图3 各组细胞蛋白表达电泳图
褐藻素是一种海洋类胡萝卜素,可通过多种途径对不同类型肿瘤发挥抗肿瘤作用。Wang等[11]研究显示,褐藻素可降低乳腺癌细胞和乳腺癌裸鼠模型中微淋巴管密度,体内外均发挥淋巴管抑制作用,可作为乳腺癌患者抗肿瘤转移的潜在途径。Mei等[12]报道,褐藻素在非小细胞肺癌细胞中的抗增殖具有剂量和时间依赖性,可通过阻滞细胞周期诱导细胞凋亡。本研究使用不同浓度褐藻素处理前列腺癌DU145细胞,结果显示细胞增殖活力明显降低,提示褐藻素对DU145细胞增殖的抑制作用,此外,褐藻素处理的细胞凋亡率较对照组明显升高,提示褐藻素对DU145细胞凋亡的促进作用,证实褐藻素可抑制DU145细胞增殖并诱导细胞凋亡,具有潜在抗前列腺癌作用。
ROS在细胞增殖、分化和凋亡过程广泛存在,高浓度ROS可导致氧化还原系统失衡,引起细胞损伤,ROS攻击生物膜中不饱和脂肪酸,形成MDA等脂质过氧化物,MDA水平可反映氧化应激损伤程度。机体内SDO、GSH-Px等抗氧化酶可形成内源性防御机制,使机体免受ROS引起的氧化应激,SOD能够催化超氧自由基,清除ROS,当SOD活性下降时,细胞易受ROS攻击引起损伤;GSH-Px可催化过氧化氢,减少脂质过氧化,保护细胞免受氧化损伤。为进一步研究褐藻素对前列腺癌DU145细胞诱导凋亡的作用机制,本研究对细胞中的ROS水平、SOD和GSH-Px活性及MDA含量进行了检测,结果显示,褐藻素组细胞中SOD和GSH-Px活性较对照组明显升高,ROS水平和MDA含量明显下降,表明褐藻素可平衡细胞氧化还原失衡状态,减少氧化应激对肿瘤细胞的促进作用。有研究显示,褐藻素可通过调控相关信号通路,减轻氧化应激,改善肾纤维化[13]。Zhang等[14]研究显示,褐藻素可通过诱导Sirt1,减轻蛛网膜下腔出血中的氧化损伤,发挥神经保护作用。以上研究均提示褐藻素的抗氧化作用,本研究结果也证实褐藻素在前列腺癌DU145细胞中可通过抗氧化作用,促进细胞凋亡,可能与其类胡萝卜素独特的丙二烯键等结构能清除ROS有关,促进细胞内氧化还原系统维持在相对平衡状态,进而减少DU145细胞过度增殖,并促进细胞凋亡。
Keap1/Nrf2/HO-1在维持机体氧化还原平衡中发挥关键作用,Nrf2对氧化应激高度敏感,主要受其胞质接头蛋白Keap1调控,Keap1可促进Nrf2的泛素化降解过程[15]。正常情况下,Keap1和Nrf2以二聚体形式存在,氧化应激条件下,Keap1与Nrf2解离,导致Keap1-Nrf2通路失活,Nrf2转移入核,与抗氧化反应元件结合,启动下游编码抗氧化蛋白类HO-1等表达,HO-1可保护肿瘤细胞免受损伤,促进细胞增殖,减少凋亡,并可增加肿瘤细胞对化疗药物的耐药性[16-17]。本研究敲降Keap1表达后,相较于对照组,Keap1 shRNA组细胞Keap1 mRNA和蛋白表达降低,Nrf2、HO-1 mRNA和蛋白表达升高,发生明显氧化应激反应,且抑制凋亡蛋白Bcl-2表达升高,促进凋亡蛋白Bax表达降低,细胞凋亡减少,而使用褐藻素处理的细胞Keap1 mRNA和蛋白表达升高,Nrf2、HO-1 mRNA和蛋白表达降低,同时Bcl-2蛋白表达降低,Bax蛋白表达升高,提示褐藻素可能对Keap1/Nrf2/HO-1通路存在调控作用,进而诱导细胞发生凋亡。为阐明褐藻素对DU145细胞的作用机制,本研究在敲降Keap1表达的基础上,进一步联合使用褐藻素处理,结果显示褐藻素可使氧化应激反应明显减弱,证实其对Keap1/Nrf2/HO-1通路的调控作用。
综上,Keap1/Nrf2/HO-1通络介导前列腺癌DU145细胞氧化应激反应,而褐藻素可通过激活Keap1表达,进而抑制Nrf2、HO-1表达,促进氧化还原态平衡,诱导细胞凋亡,为临床前列腺癌治疗提供实验依据。

