人脐带间充质干细胞来源的细胞外囊泡增强纤维化肝脏再生能力
雷耘果 姚嘉 郑俊 陆桐宇 张杰滨 萧家麒 刘亚松 陈海填 赵雪刚 杨兴业
肝移植是治疗终末期肝病的最有效手段,但是在庞大的等待移植患者人数的背景下,供肝短缺的问题持续困扰着移植界,随着肝移植的不断发展,活体肝移植及劈离式肝移植术逐渐走向成熟,这些尖端的肝移植技术大大缓解了供肝不足的情况,给众多终末期肝病患者带来了福音[1-2]。然而,由于终末期肝病患者常发生不可预测的肝性脑病,消化道大出血等突发事件,需要紧急器官移植以挽救患者生命,为了扩大供者来源,边缘供肝或劈离式供肝不可避免地成为选项之一,这其中不乏轻度纤维化的供肝[3]。此前国内有研究报道使用边缘供肝进行全肝移植,与非边缘供肝相比术后肝肾功能和生存情况差异无统计学意义[4]。目前使用边缘供肝进行肝移植的疗效鲜有报道,尤其是轻度纤维化的供肝,其疗效如何以及促进边缘供肝移植后更好地发挥作用,避免小肝综合征发生的方法仍然未知。
另一方面,慢性肝损伤通常会导致肝脏炎症和肝纤维化,甚至发展为肝癌,研究发现肝星状细胞(hepatic stellate cell,HSC)在肝纤维化发生发展过程中具有重要作用[5-7]。目前临床上接受肝切除术的患者多伴有肝纤维化,我国肝癌患者中,80%以上合并肝硬化或肝纤维化等基础肝病,行肝癌切除后如何更好促进肝功能恢复仍然是目前外科需要解决的问题。肝细胞生长因子(hepatocyte growth factor,HGF)是一种能够刺激肝细胞增殖的生长因子,既往研究表明其在肝再生、肝纤维化等方面具有重要的临床意义[8-10],有报道发现HSC 可以分泌HGF 到胞外发挥相关生理作用[11]。
作为细胞治疗的主力军,间充质干细胞(mesenchymal stem cell,MSC)具有免疫调节、组织修复、促进血管新生等作用,而近年来越来越多的研究证实MSC 来源的细胞外囊泡(MSC-derived extracellular vesicle,MSC-EV)是MSC 发挥生物学功能的重要方式[12-15]。本文旨在探讨纤维化肝脏在部分肝切除后与正常肝脏部分肝切除后的再生能力比较有否变化,并探究MSC-EV 在纤维化肝脏部分肝切术后肝再生中的作用及机制。
1 材料与方法
1.1 实验材料和试剂
1.1.1 实验材料 选取10~12 周的健康雄性无特定病原体(specific pathogen free,SPF)级纯系C57BL/6 小鼠24 只,体质量25~30 g,该小鼠购于广东药康生物科技有限公司。人肝脏星状细胞系LX-2 由中山大学附属第三医院肝病实验室捐赠。本实验研究方案已经通过中山大学附属第三医院伦理委员会批准通过。
1.1.2 试 剂 增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、β-actin、α- 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Ki67 抗体购于美国Cell Signaling Technology 公司,HGF 抗体购于美国Signalway Antibody LLC 公司,流式细胞术相关抗体[藻红蛋白(phycoerythrin,PE)-Cy7-CD105,别藻蓝蛋白(allophycocyanin,APC)-人类白细胞抗原(human leukocyte antigen,HLA)-DR 和APC-CD34]及蛋白质印迹法二抗购于英国Abcam 公司,Dir 染料购于深圳市文乐生物科技有限公司。实时荧光定量逆转录聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)相关试剂购于南京诺唯赞生物科技股份有限公司,转化生长因子(transforming growth factor,TGF)-β 购于广州妙博生物科技有限公司,四氯化碳(CCl4)及橄榄油购于广州硕谱生物科技有限公司。
1.2 动物模型建立及标本采集
1.2.1 小鼠肝脏纤维化部分肝切除模型建立和分组所有小鼠根据耳标编号随机分为正常肝脏70%肝切除组(Oil+PHx 组),肝纤维化70%肝切除组(CCl4+PHx 组),肝纤维化70%肝切除+MSC-EV 治疗组(CCl4+PHx+MSC-EV 组),每组8 只,部分肝切除方法按照以往文献所述方法[16]。Oil+PHx 组使用橄榄油进行腹腔注射(注射量5 μL/g,每周2 次,注射2 周);其余两组使用CCl4和橄榄油按照1 ∶4 体积比配制后进行腹腔注射(注射量和时间同上)[17-18]。注射2 周后3 组动物进行70%肝部分切除术[16,19-20],CCl4+PHx+MSC-EV 组在关腹前经腔静脉注射MSCEV,术后2 d 取材。
1.2.2 标本采集 使用戊巴比妥钠麻醉后经眼球取小鼠外周血,室温静置约30 min,后使用离心机1 000 ×g离心15 min,取上层血清。处死小鼠,剪开小鼠下腔静脉,使用生理盐水经心脏进行驱血,后摘取部分肝脏浸泡于4%多聚甲醛固定后使用石蜡包埋并制作切片;另一部分经过液氮速冻后置于-80 ℃冰箱保存,以进行后续实验。
1.3 细胞模型建立与分组
1.3.1 人脐带间充质干细胞及其细胞外囊泡的制备与鉴定 新鲜脐带标本取自于中山大学附属第三医院妇产科行剖宫产的孕产妇,标本获取前均签署知情同意书。从新鲜脐带标本中提取人脐带MSC(human umbilical cord MSC,hUC-MSC),并采用流式细胞术进行细胞表面免疫表型鉴定(CD105、CD35、HLA-DR)。待细胞融合度达到70%~80%后分别更换成骨、成脂诱导培养基,而对照组使用常规培养基进行培养。约14 d 后分别进行油红O 或茜素红染色,光学显微镜下观察并摄影。
从hUC-MSC 中提取hUC-MSC-EV,并进行标志物[CD81、CD9、CD63、葡萄糖调节蛋白(glucoseregulated protein,GRP)94]检测。
1.3.2 细胞分组与处理 将培养稳定,状态良好的LX-2细胞均匀分为磷酸盐缓冲液(phosphate buffer solution,PBS) 组、TGF-β 组、TGF-β+MSC-EV 组,培养于12 孔板中,细胞密度约50%。PBS 组为正常培养的LX-2 细胞,无其他特殊处理;TGF-β 组为活化的LX-2 细胞,每孔TGF-β 的量为10 ng/mL[21-22],诱导48 h 后换取新鲜完全培养基;TGF-β+MSC-EV 组处理方法同TGF-β 组,TGF-β 诱导48 h 后换新鲜完全培养基,每孔加入60 μg MSC-EV。以上各组均于48 h后收集细胞蛋白、RNA 及上清液,以备进行后续实验。
1.4 实验方法
1.4.1 酶联免疫吸附试验 采用酶联免疫吸附试验(enzyme-linked immune absorbent assay,ELISA)检测各组小鼠血清的天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平及LX-2 细胞培养上清液HGF 表达水平。
1.4.2 蛋白质印迹实验 提取各组小鼠肝组织和各组LX-2 细胞的总蛋白,进行电泳。将电泳蛋白转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,脱脂奶粉封闭1 h,使用前述抗体分别孵育过夜,后使用二抗室温孵育1 h,检测各组小鼠肝组织的PCNA、HGF、α-SMA 蛋白表达,检测各组LX-2 细胞HGF、α-SMA 蛋白表达情况。
1.4.3 苏木素-伊红染色 肝组织石蜡切片脱蜡水洗后,放入苏木素染液染3~5 min,分化液分化后,伊红染色5 min,水洗后乙醇梯度脱水,二甲苯透明,中性树胶封片。
1.4.4 天狼星红染色 肝组织石蜡切片脱蜡后水洗,将切片放入天狼星红染液中染色8 min,无水乙醇脱水后二甲苯透明5 min,中性树胶封片。
1.4.5 免疫组织化学染色 肝组织石蜡切片经脱蜡、水洗、抗原修复后滴加1∶200 比例稀释的Ki67、α-SMA 一抗4 ℃过夜孵育。次日浸洗后滴加二抗,37 ℃孵育30 min。浸洗后使用3,3’-二氨基联苯胺(3,3'-diaminobenzidine,DAB)(1∶50)进行显色。浸洗后苏木素染核1 min,浸洗后吹干、封片。
1.4.6 实时荧光定量逆转录聚合酶链反应 采用Trizol总RNA 提取试剂提取细胞样本总RNA,测量细胞样本RNA 浓度,进行互补脱氧核糖核酸(complementary DNA,cDNA)逆转录反应后扩增。每个样本重复3 次试验并记录Ct 值,计算目的基因[Collagen Ⅰ、成纤维母细胞生长因子(fibroblast growth factor,FGF)、表皮细胞生长因子(epidermal growth factor,EGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、HGF]信使RNA(messenger RNA,mRMA)的相对表达水平。
1.4.7 LX-2 细胞内吞实验 待LX-2 细胞融合度达到50%,加入PKH-26 染料预染的MSC-EV 共孵育2 d,浸洗后4%多聚甲醛溶液固定10 min;浸洗后室温通透;浸洗后滴加正常山羊血清室温封闭30 min;α-SMA一抗4 ℃孵育过夜;清洗后滴加稀释好的荧光二抗,避光室温孵育1 h;清洗后1 h,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)避光孵育5 min;清洗后封片,在激光共聚焦显微镜下观察采集图像。
1.5 统计学方法
采用SPSS 26.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为有统计学意义。
2 结果
2.1 hUC-MSC 分离及hUC-MSC-EV 鉴定
光学显微镜下可见分离的hUC-MSC 生长状态良好,分布均匀(图1A);成骨成脂实验显示该hUCMSC 有良好的向骨细胞和脂肪细胞诱导分化潜能(图1B、C)。
流式细胞术结果显示,hUC-MSC 高表达CD105,低表达CD34 和HLA-DR(图1D~F)。蛋白质印迹法结果显示hUC-MSC-EV 较hUC-MSC 高表达CD81、CD63 及CD9,而低表达GRP94(图1G)。
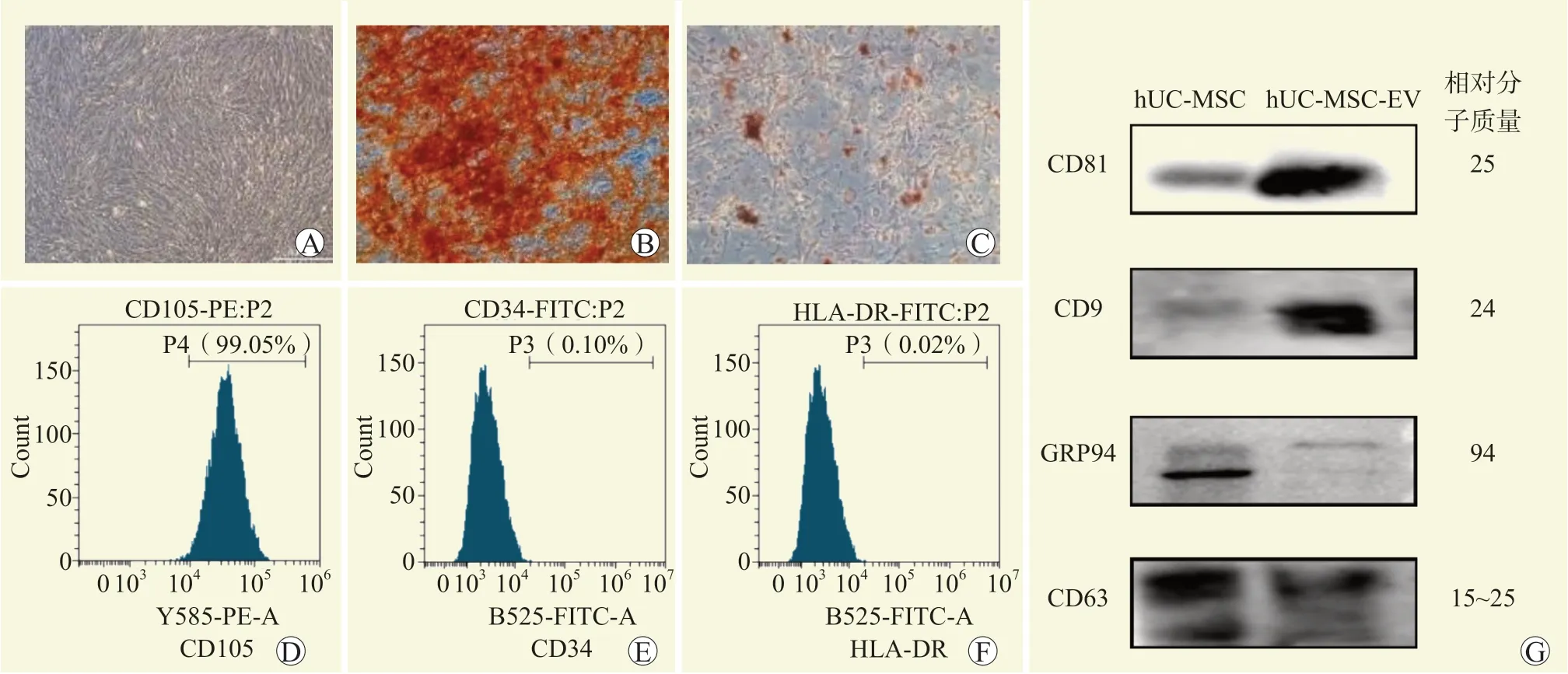
图1 hUC-MSC 细胞及hUC-MSC-EV 鉴定Figure 1 Identification of hUC-MSC and hUC-MSC-EV
2.2 小鼠肝部分切除术后各组血清AST、ALT、LDH 水平变化
与Oil+PHx 组比较,CCl4+PHx 组小鼠血清AST、ALT、LDH 水平均升高;与CCl4+PHx 组比较,CCl4+PHx+MSC-EV 组小鼠血清AST、ALT、LDH 水平均下降,差异均有统计学意义(均为P<0.05,图2)。
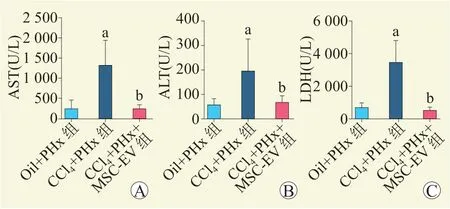
图2 小鼠肝部分切除术后各组血清AST、ALT、LDH 水平变化Figure 2 Changes of serum AST,ALT and LDH of mice among each group after partial hepatectomy
2.3 MSC-EV 减轻肝纤维化程度
肝脏大体标本及HE 染色结果显示,CCl4+PHx组纤维化较Oil+PHx 组明显,CCl4+PHx+MSC-EV 组纤维化程度较CCl4+PHx 组减轻,肝损伤修复较好(图3A)。
天狼星红染色及α-SMA 染色结果显示,与Oil+PHx 组比较,CCl4+PHx 组阳性区域面积增大;与CCl4+PHx 组比较,CCl4+PHx+MSC-EV 组阳性区域面积缩小,差异均有统计学意义(均为P<0.05,图3A~C)。
与Oil+PHx 组 比 较,CCl4+PHx 组α-SMA蛋白表达水平升高;与CCl4+PHx 组比较,CCl4+PHx+MSC-EV 组α-SMA 蛋白表达水平下降,差异均有统计学意义(均为P<0.05,图3D、E)。
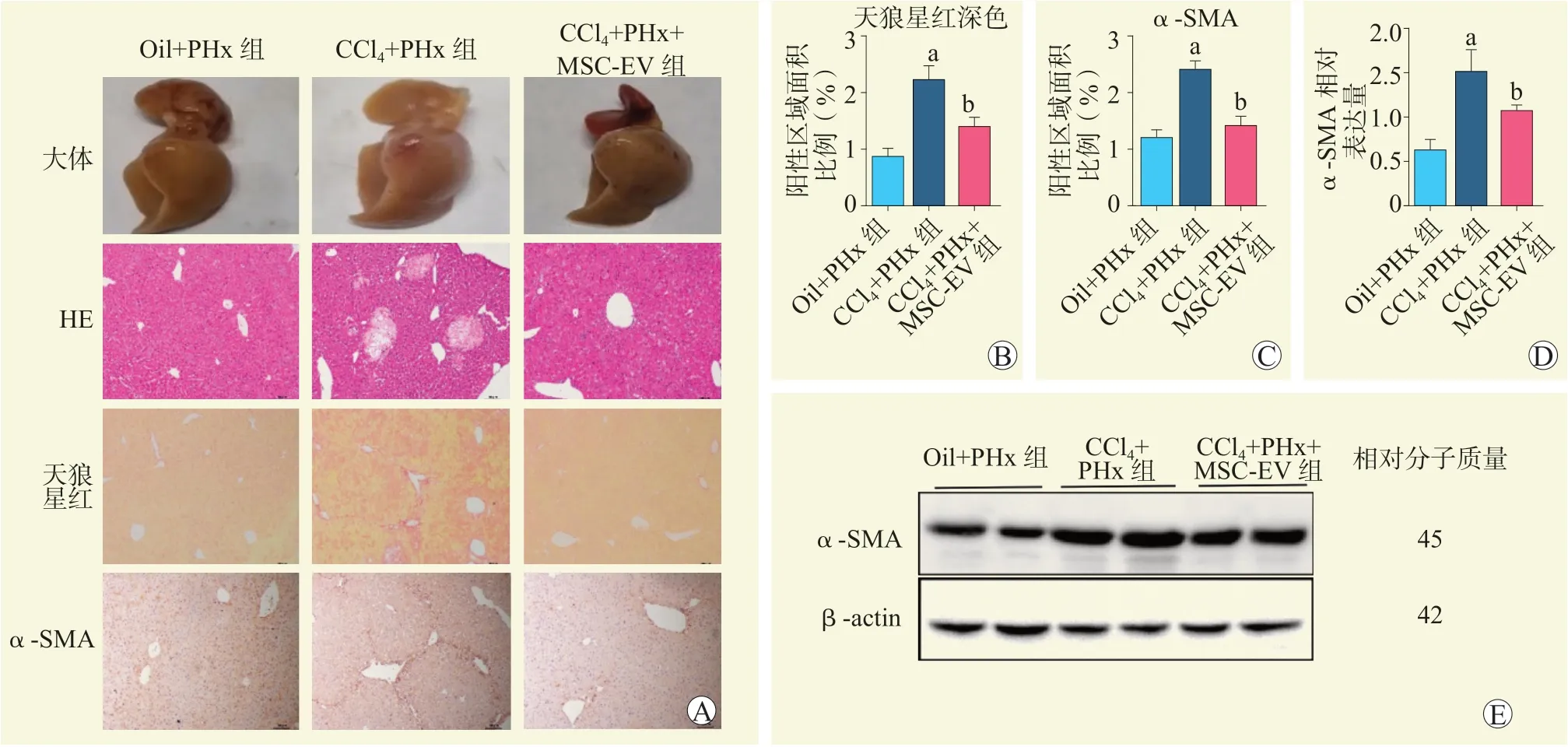
图3 各组小鼠部分肝切除术后纤维化相关指标比较Figure 3 Comparison of fibrosis related indexes of mice among each group after partial hepatectomy
2.4 MSC-EV 促进肝再生
免疫组织化学染色显示,CCl4+PHx 组Ki67 表达量较Oil+PHx 低,CCl4+PHx+MSC-EV 组Ki67 表达量较CCl4+PHx 组上升,差异均有统计学意义(均为P<0.05,图4A)。
蛋白质印迹法结果显示,CCl4+PHx 组PCNA 蛋白表达量较Oil+PHx 组低,CCl4+PHx+MSC-EV 组PCNA 蛋白表达量较CCl4+PHx 组增高,差异均有统计学意义(均为P<0.05,图4B)。
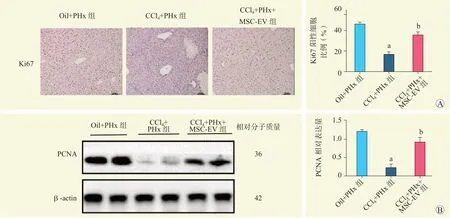
图4 各组小鼠部分肝切除术后增殖相关指标比较Figure 4 Comparison of proliferation-related indexes of mice among each group after partial hepatectomy
2.5 MSC-EV 促进活化的HSC 分泌HGF
LX-2 细胞内吞实验结果显示LX-2 细胞摄取了大量MSC-EV(图5A)。RT-qPCR 结果显示,与PBS组比较,TGF-β 组LX-2 细胞内Collagen ⅠmRNA 表达升高;与TGF-β 组比较,TGF-β+MSC-EV 组LX-2细胞内Collagen ⅠmRNA 表达下降(均为P<0.05,图5B)。各组FGF、EGF、VEGF mRNA 表达差异无统计学意义(均为P>0.05,图5C~E);PBS 组与TGF-β 组HGF mRNA 表达水平差异无统计学意义(P>0.05),TGF-β+MSC-EV 组LX-2 细胞内HGF mRNA 表达较TGF-β 组增多,差异有统计学意义(P<0.05,图5F)。
蛋白质印迹法结果显示,与PBS 组比较,TGF-β组α-SMA 蛋白表达水平升高;与TGF-β 组比较,TGF-β+MSC-EV 组HGF 蛋白表达水平升高,α-SMA蛋白表达水平降低,差异均有统计学意义(均为P<0.05,图5G~I)。
ELISA结果显示,TGF-β组细胞上清液HGF蛋白水平较PBS 组下降,TGF-β+MSC-EV 组细胞上清液HGF蛋白水平较TGF-β 组升高(均为P<0.05,图5J)。

图5 各组细胞生长因子比较Figure 5 Comparison of cell growth factor among each group
2.6 MSC-EV 对肝脏HGF 表达的影响
CCl4+PHx 组HGF 蛋白表达水平较Oil+PHx组下降,但差异无统计学意义(P>0.05);CCl4+PHx+MSC-EV 组HGF 蛋白表达水平较CCl4+PHx 组上升,差异有统计学意义(P<0.05,图6)。
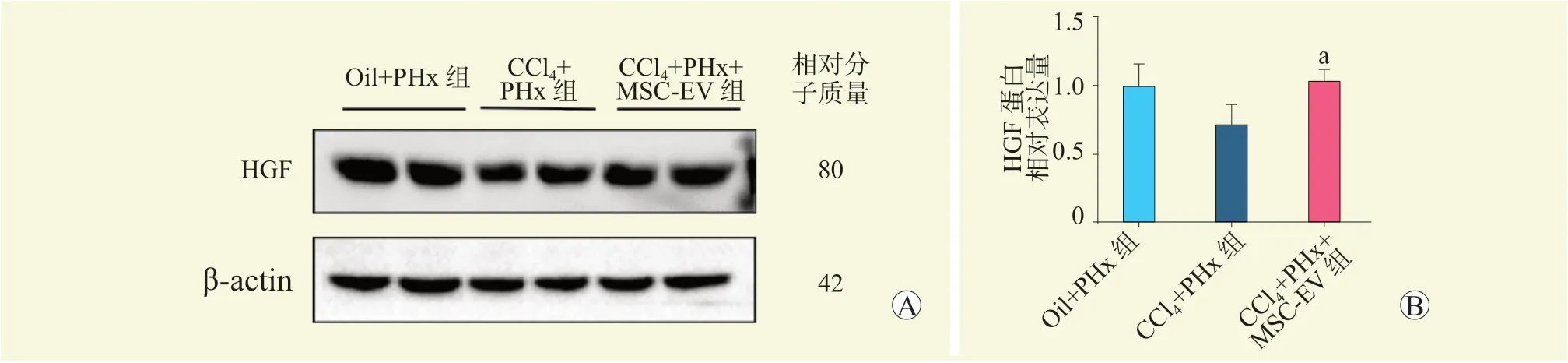
图6 各组小鼠肝脏HGF 表达情况Figure 6 HGF expression in liver of mice among each group
3 讨论
肝脏具备独特的损伤后再生能力,是再生能力最强的器官,肝再生对于肝脏外科常见手术及肝移植术后肝功能迅速恢复有较强的研究价值[23-24]。肝再生的机制错综复杂,Hu 等[25]发现MSC 可以通过调控免疫细胞促进肝再生。最近有研究报道,过氧化物酶体增殖物激活受体α 可以通过Yes 相关蛋白(Yes-associated protein,YAP)-TEA 转录因子(TEA domain transcription factor,TEAD)通路调节肝再生[26]。此外,有学者提出激活的枯否细胞可以通过分泌GRP78 促进肝再生并提高致死小鼠模型的存活率[27]。本研究通过免疫组织化学染色、蛋白质印迹法等测定各组小鼠增殖相关蛋白PCNA、Ki67 的变化,发现纤维化肝脏部分肝切除后增殖能力较正常肝脏部分肝切除组下降,而注射MSC-EV 后纤维化肝脏增殖能力获得了明显提升。
HSC 是肝脏中的一个小细胞群,其在肝纤维化的发生发展以及肝损伤后肝再生的启动和终止发挥重要的作用[28-32]。研究发现MSC-EV 可以通过miR-141-3p/PTEN/蛋白激酶B(protein kinase B,Akt)通路抑制肝纤维化中HSC 的活化进而减轻肝纤维化[33]。类似研究发现,扁桃体来源的MSC-EV 可以通过miR-486-5p 减轻HSC 的活化和肝纤维化[34]。另一方面,衰老的HSC 可以通过白细胞介素-6 和CXC 趋化因子受体2(CXC chemokine receptor 2,CXCR2)配体促进肝再生[35]。以上研究充分表明HSC 在肝纤维化及肝再生中扮演着重要的角色,本研究使用TGF-β 活化LX-2 细胞,并与MSC-EV 共孵育,结果发现LX-2 细胞内Collagen Ⅰ mRNA 水平降低,动物实验也观察到CCl4+PHx+MSC-EV 组纤维化相关蛋白α-SMA 表达降低,表明MSC-EV 治疗后肝脏纤维化程度减轻。LX-2 细胞活化及MSC-EV 治疗前后,各组EGF、FGF、VEGF 等生长因子mRNA 水平无明显变化,而CCl4+PHx+MSC-EV 组HGF 呈现明显上升趋势,表明MSC-EV 可以通过促进活化的HSC 细胞分泌HGF,进而促进肝再生。细胞内吞实验中在共聚焦显微镜下观察到了HSC 摄取MSC-EV,然而MSC-EV 作用于HSC 的具体机制仍需进一步探究。
综上所述,本研究结合体内外实验,初步证实纤维化肝脏的自然再生能力较正常肝脏再生能力差,而纤维化肝脏的HSC 分泌HGF 减少可能是导致这一结果的重要原因,MSC-EV 可能通过促进纤维化肝脏中的HSC 分泌HGF,进而促进肝再生。这一研究结果可以为今后的肝再生研究提供新的思路,并为MSCEV 的临床转化提供依据。

