间充质干细胞来源的细胞外囊泡对放射性肝损伤的保护作用及其机制研究
陈池 萧家麒 隋昕 张英才
放射治疗(放疗)是指用放射线破坏细胞DNA,使细胞失去活性与功能[1]。放疗在癌症的治疗中被广泛应用[2-4],据报道,在癌症患者中,约2/3 的患者接受过放疗[5]。肝脏对照射具有高敏感性[6-8],照射后引起放射性肝损伤,可能进一步发展成肝纤维化,甚至威胁患者生命,故而及时有效地治疗放射性肝损伤尤为重要[9-12]。
有文献指出,铁死亡在放射性损伤的发病机制中有着十分重要的地位[13]。铁死亡由依赖于铁离子的脂质过氧化过程诱导[13-14]。最近有文献报道铁死亡在多个器官放射性损伤中的重要作用[14-16]。研究认为,铁死亡与多种肝脏疾病的发病机制相关[17-19]。铁死亡在放射性肝损伤的发病机制中的作用,笔者尚未见相关文献报道。
目前,国际指南没有明确放射性肝损伤的治疗方法。近年来中药被发现可缓解放射性肝损伤[20-21],但无更高效稳定的手段[22]。间充质干细胞来源的细胞外囊泡(mesenchymal stem cell-derived extracellular vesicle,MSC-EV)具有极好的修复潜能[23-24]。已有文献报道,MSC-EV 可以通过降低活性氧簇(reactive oxygen species,ROS)水平来缓解疾病进展[25]。有研究认为,在照射致损过程中细胞外囊泡可以在受损器官(如肝、肾、骨髓等)中积累[26],具体机制有待深入探究。本研究通过建立放射性肝损伤的动物和细胞模型,探讨MSC-EV 的保护作用及其机制,揭示其对放射性肝损伤的治疗潜能。
1 材料与方法
1.1 材料与试剂
无特定病原体(specefic pathogen free,SPF)级雄性C57BL/6 小鼠购自广东药康公司。小鼠肝细胞系AML12 细胞购于美国MedChemExpress 公司。该动物研究方案经中山大学附属第三医院伦理委员会批准。
Trizol 试剂购自美国Thermo Fisher 公司,信使RNA(Messenger RNA,mRNA)反转录试剂盒以及荧光定量试剂购自南京诺唯赞生物科技股份有限公司,实时荧光定量逆转录聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR) 引物由生工生物工程(上海)股份有限公司合成,脱氧核糖核酸末端转移酶介导的dUTP 缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling,TUNEL)检测试剂盒购于武汉塞维尔公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)偶联Annexin-V 凋亡检测试剂盒购于美国BD公司,二氢乙啶(dihydroethidium,DHE)试剂购于中国Cell Bank of Type Culture Collection 公司,丙二醛(malondialdehyde,MDA)试剂盒购于南京建成生物工程研究所,谷胱甘肽过氧化酶(glutathione peroxidase,GPX)4、铁死亡抑制蛋白(ferroptosis suppressor protein,FSP)1 抗体购于英国Abcam 公司,线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)试剂盒购于上海碧云天生物技术有限公司,DMEM/F12 培养基购于中国塞维尔公司。
1.2 急性动物放射性损伤模型的建立与分组
取27 只6~8 周龄雄性C57BL/6 小鼠,体质量16~20 g。小鼠编号后系统随机抽取编号分为空白组、造模组和MSC-EV 治疗组(治疗组),每组9 只。造模组和治疗组小鼠均进行一次性15 Gy X 线照射,治疗组照射后1 h 尾静脉注射含100 μg MSC-EV 的磷酸盐缓冲液(phosphate buffer saline,PBS)200 μL,造模组相同时间尾静脉注射同体积PBS。空白组不予照射处理,尾静脉注射同体积PBS。照射后48 h 取小鼠的肝组织与血清置于-80 ℃冰箱保存,部分肝组织多聚甲醛溶液固定以进行后续实验。
1.3 小鼠肝细胞系放射性损伤模型建立与分组
将AML12 细胞分为对照组、照射组和MSC-EV干预组(干预组)。照射组与干预组均进行一次性6 Gy X 线照射,干预组照射后1 h 给予含15 μg/mL MSC-EV 的PBS,照射组相同时间予同体积PBS。对照组不进行照射处理,相同时间予同体积PBS。照射后15 h 对细胞进行相关检测。
1.4 实验方法
1.4.1 苏木素-伊红染色检测肝组织病变情况 获取肝组织,多聚甲醛溶液固定过夜,常规石蜡包埋,切片4 μm,常规脱蜡、水化、苏木素-伊红(hematoxylin-eosin,HE)染色。酒精脱水和二甲苯透明、中性树胶进行封片,显微镜观察病变情况。肝损伤评分(Suzuki’s 组织学标准)方法参考文献[27]。
1.4.2 TUNEL 染色检测肝组织凋亡情况 组织固定后冰冻切片取出置于烘箱30 min,经过0.2%Trizon 破膜20 min 并用PBS 润洗后,平衡样本并以脱氧核糖核苷酸末端转移酶孵育缓冲液孵育,PBS 润洗并用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染核,抗荧光淬灭剂封片。烘干后观察肝组织细胞凋亡情况。
1.4.3 DHE 染色检测过氧化物水平 未固定的组织冰冻切片取出置于烘箱30 min,PBS 润洗后,以含DHE 荧光染剂的预热PBS 溶液37 ℃孵育,PBS 润洗并DAPI 染核,抗荧光淬灭剂封片。烘干后观察肝组织及肝细胞系ROS 产生水平。
1.4.4 血清转氨酶水平检测 取得小鼠血清后,采用全自动化学分析仪酶法检测天冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine amiotransferase,ALT)水平。
1.4.5 RT-qPCR 检测炎症因子及趋化因子水平 提取各组小鼠肝组织和AML12 细胞的总RNA,RT-qPCR 测定白细胞介素(interleukin,IL)-1β、IL-6、转化生长因子(transforming growth factor,TGF)-β、CXC趋化因子配体(CXC chemokine ligand,CXCL)10 mRNA 的相对表达量。
1.4.6 蛋白质印迹法测定GPX4、FSP1 蛋白表达 提取各组小鼠肝组织蛋白和AML12 细胞蛋白,经过电泳、转膜、封闭,一抗4 ℃孵育过夜,二抗孵育90 min,置于化学发光仪中曝光显影。
1.4.7 MDA 含量测定 肝组织及细胞MDA 含量测定严格按照试剂盒说明书进行。
1.4.8 碘化丙啶染色测定细胞凋亡情况 AML12 细胞于24 孔板铺板,PBS 润洗后,取碘化丙啶(propidiumiodide,PI)染剂1:1 000 处理30 min,染核后显微镜下观察、拍照。
1.4.9 线粒体通透性转换孔测定 AML12 细胞于24 孔板铺板按照试剂盒说明书进行mPTP 染色处理,染色30 min,染核后显微镜下观察线粒体通透性转换孔是否异常打开,并拍照。
1.5 统计学方法
采用GraphPad Prism 9 软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 照射诱导小鼠放射性肝损伤
利用15 Gy X 射线照射小鼠48 h 后,与空白组比较,造模组小鼠血清AST、ALT 水平均升高,差异均有统计学意义(图1A,均为P<0.05)。RT-qPCR结果显示,造模组小鼠肝组织IL-1β、CXCL10 和TGF-β mRNA 相对表达量较空白组均增加,差异均有统计学意义(图1B,均为P<0.05)。MDA 含量测定结果显示,与空白组比较,造模组小鼠肝组织MDA含量增加,差异有统计学意义(图1C,P<0.05)。肝组织HE 染色结果显示,造模组小鼠肝组织大部分肝细胞体积变大、肿胀,边缘不清,胞质气球样变性,染色变浅,部分肝细胞核固缩,间质内可见炎症细胞浸润(图1D),且肝损伤评分较空白组升高,差异有统计学意义(图1E,P<0.05)。TUNEL 染色结果显示,造模组的细胞凋亡率较空白组增加,差异有统计学意义(图1F、H,P<0.05)。DHE 染色结果显示,造模组的细胞内ROS 水平较空白组升高,差异有统计学意义(图1G、I,P<0.05)。蛋白质印迹法结果显示,造模组小鼠肝组织GPX4、FSP1 蛋白相对表达量较空白组下降(图1J)。
2.2 MSC-EV 通过减轻铁死亡改善小鼠放射性肝损伤
利用15 Gy X 线照射小鼠1 h 后予尾静脉注射MSC-EV,处理48 h 后,治疗组小鼠的血清AST、ALT 水平均低于造模组,差异均有统计学意义(图1A,均为P<0.05)。RT-qPCR 结果显示,治疗组的IL-1β、CXCL10 和TGF-β 的mRNA 相对表达量较造模组均下降,差异均有统计学意义(图1B,均为P<0.05)。MDA 检测结果显示,治疗组的MDA含量较造模组下降,差异有统计学意义(图1C,P<0.05)。HE 染色结果示,与造模组比较,治疗组肝细胞结构完整,部分肝细胞边缘仍不清,肝细胞肿胀、空泡化有明显改善,染色稍变浅,但仍未恢复正常形态,炎症浸润减轻(图1D),且肝损伤评分更低(图1E,P<0.05)。TUNEL 染色结果显示,治疗组的细胞凋亡率较造模组下降,差异有统计学意义(图1F、H,P<0.05)。DHE 染色结果显示,治疗组的细胞内ROS 水平较造模组下降,差异有统计学意义(图1G、I,P<0.05)。蛋白质印迹法结果显示,治疗组的GPX4 和FSP1 蛋白相对表达量较造模组增多(图1J)。
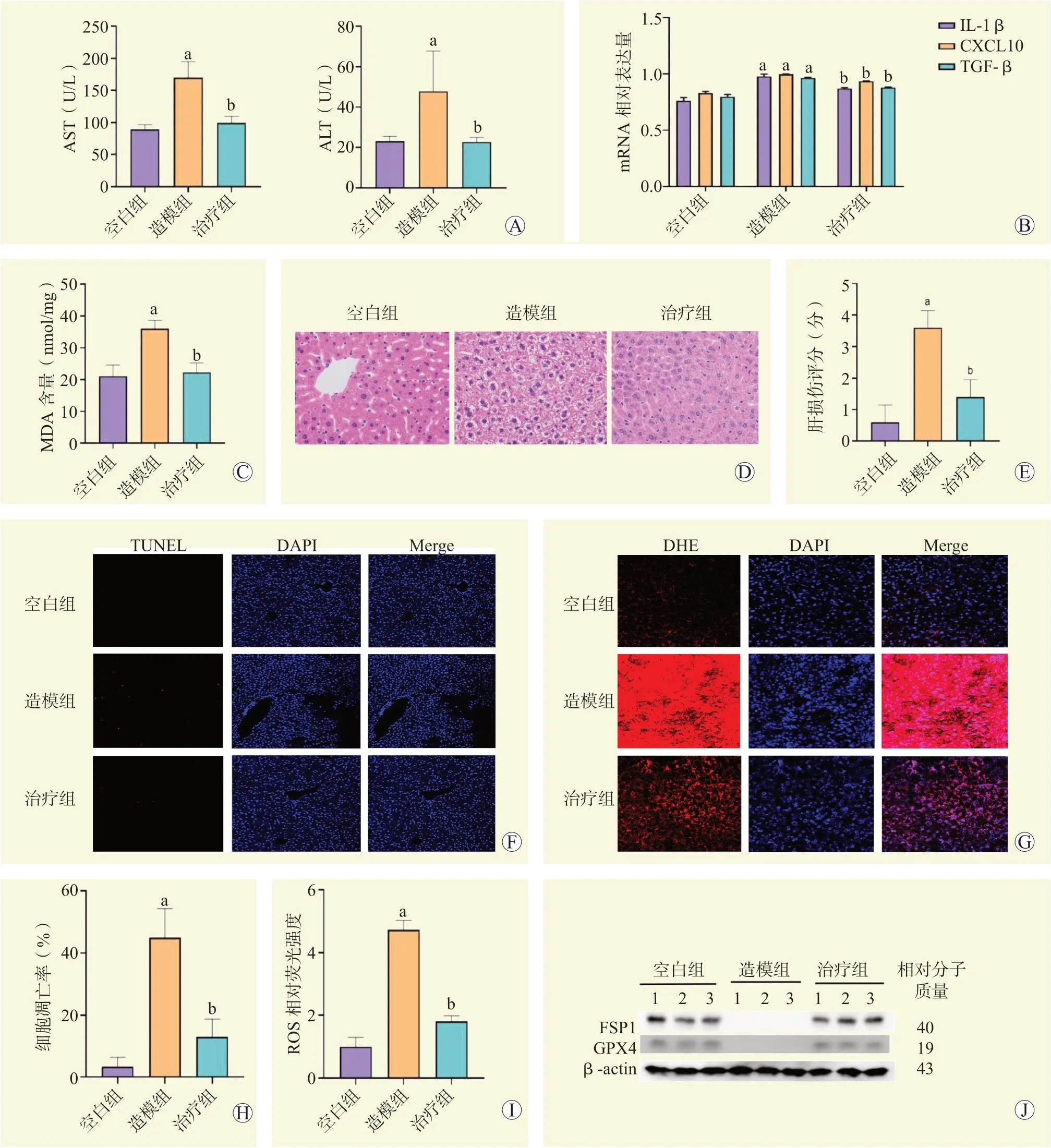
图1 MSC-EV 对小鼠肝脏放射性损伤的保护作用Figure 1 Protective effect of MSC-EV on liver radiation injury in mice
2.3 照射诱导AML12 细胞放射性损伤
利用6 Gy X 线照射细胞后,PI 染色结果显示,照射组细胞凋亡率较对照组增加,差异有统计学意义(图2A、C,P<0.05)。DHE 染色结果显示,照射组细胞内ROS 水平较对照组升高,差异有统计学意义(图2B、D,P<0.05)。mPTP 染色结果显示,照射组的mPTP 荧光强度较对照组减弱,差异有统计学意义(图2E、F,P<0.05),表明照射导致线粒体通透性孔道异常开放,线粒体功能破坏。RT-qPCR 结果显示,照射组的IL-1β、TGF-β、IL-6 的mRNA 相对表达量较对照组增加,差异均有统计学意义(图2G,均为P<0.05)。MDA 检测结果显示,照射组AML12细胞内MDA 水平较对照组升高,差异有统计学意义(图2H,P<0.05)。蛋白质印迹法结果显示,照射组AML12 细胞内GPX4、FSP1 的蛋白相对表达量较对照组减少(图2I)。
2.4 MSC-EV 通过减轻铁死亡改善AML12 细胞的放射性损伤
利用6 Gy X 射线照射后予以MSC-EV 干预,处理15 h 后,PI 染色结果显示,与照射组比较,干预组细胞凋亡率降低,差异有统计学意义(图2A、C,P<0.05)。DHE 染色结果显示,干预组AML12细胞内ROS 水平较照射组降低,差异有统计学意义(图2B、D,P<0.05)。mPTP 结果显示,干预组mPTP 荧光强度水平较对照组增强,差异有统计学意义(图2E、F,P<0.05),表明MSC-EV 干预可以减轻照射导致的AML12 细胞线粒体孔道异常开放和功能紊乱。RT-qPCR 结果显示,干预组IL-1β、IL-6 及TGF-β mRNA 相对表达量较照射组均下降,差异均有统计学意义(图2G,P<0.05)。MDA 含量测定结果显示,干预组的MDA 含量较照射组减少,差异有统计学意义(图2H,P<0.05)。蛋白质印迹法结果显示,干预组的抗过氧化酶GPX4、FSP1 的蛋白相对表达量较照射组均增多(图2I)。

图2 MSC-EV 对AML12 细胞放射性损伤的保护作用Figure 2 Protective effect of MSC-EV on liver radiation injury in AML12 cell
3 讨论
照射损伤肝细胞的主要机制是导致DNA 链断裂和大量自由基产生,从而影响肝细胞的正常功能,导致炎症与肝功能失常。大多数文献认为放射性肝损伤的发病时间通常在放射治疗后4~8 周,甚至更久[28],病理特征是肝静脉闭塞征,具体为静脉阻塞、小叶结构扭曲、实质肝细胞窦性充血以及腹腔积液、疲劳和肝酶升高等临床症状。但近年已有文献报道,在照射后72 h 肝脏过氧化物产生明显增高,脂质过氧化指标已经开始出现异常[29],故而研究放射性肝损伤的早期损伤特点,及时发现并治疗尤为重要。肝组织HE染色是评判肝脏的结构是否完整、肝细胞形态是否正常的重要手段,有研究报道,照射可引起肝脏的病理学改变,HE 染色可见肝中央静脉扩张充血,胞质溶解、消失、淡染[30]。AST、ALT 作为反映肝功能的最敏感的指标,在照射后明显增高[31]。有文献报道,照射可导致肝细胞凋亡比例增高,与凋亡有关的分子水平明显改变[32]。照射可损伤多种分子,如DNA、蛋白质、脂质等,过程中产生大量ROS,使氧化还原体系失衡,进而引起细胞的氧化应激[33]。mPTP 是一种由线粒体内外膜一起组成的非特异性通道,在细胞死亡过程中参与有害物质转运。线粒体损伤可导致孔道打开,线粒体内荧光染料钙黄绿素被进入线粒体的重金属淬灭。作为产生ROS 最多的部位,线粒体在照射导致的损伤中发生了功能性损伤[34]。本研究结果与相关文献报道基本相符,唯一不同是HE 染色可见照射组肝细胞胞质肿胀,肝窦大部分消失,未观察到肝中央静脉的内径变化。可能是因为本研究取材时间早,肝细胞损伤主要表现为水肿,导致肝窦消失,血管内径未增大甚至有缩小的趋势。
细胞外囊泡是一种脂质双分子层膜颗粒,通过囊泡包裹的内容物(包括蛋白质、脂质和核酸)在治疗细胞损伤过程中起着关键作用。目前还没有研究直接证明MSC-EV 可以减轻放射性肝损伤,但近年有研究指出其可治疗其它器官的放射性损伤,如MSC-EV可以减轻照射引起的放射性肺损伤,包括血管损伤、炎症、纤维化,以及通过下调ATM/P53/P21 信号来降低辐射诱导的DNA 损伤水平[35]。已有文献报道MSC-EV 可以通过减轻ROS 来缓解疾病进展[25],而ROS可以诱导铁死亡。铁死亡是一种细胞死亡的形式,不同于凋亡,它由依赖于铁离子的脂质过氧化过程诱导[13,36]。真核细胞在铁离子与过氧化物的作用下,可导致细胞膜的不饱和脂肪酸磷脂发生脂质过氧化,脂质过氧化的产物如果无法及时得到清除,过度累积可损害细胞正常功能,并且该过程也使细胞膜失去其正常的结构与功能,细胞发生铁死亡[37-39]。许多研究证明,照射可导致肝脏的抗氧化酶体系紊乱,脂质过氧化物堆积[9,40]。本研究结果与报道相符,照射导致抗氧化酶GPX4、FSP1 水平均下降,脂质过氧化产物MDA水平升高,引起铁死亡,MSC-EV 治疗均可缓解这些改变,减少铁死亡。本研究结果表明MSC-EV 改善放射性肝损伤的机制可能是通过减少铁死亡。
综上所述,MSC-EV 对照射导致的肝功能障碍、肝脏病理损伤、肝细胞凋亡以及氧化应激均有显著的改善作用,其机制可能是通过减少铁死亡,提高抗氧化水平,减少脂质过氧化物的产生。但本实验仍存在不足,未进一步研究MSC-EV 具体导致抗氧化酶降低的分子机制,未抑制铁死亡以观察照射对肝脏的影响,未来仍需进一步研究。

