三角分离模型在腹腔镜下直肠癌根治手术解剖层面显露中的应用
王 伟,黄 亮
(1.山东省临沂市肿瘤医院普通外科,山东 临沂 276000; 2.中山大学附属第六医院结直肠肛门外科,广州 510600)
1982年HEALD等[1]首次提出直肠癌全系膜切除术(total mesorectal excision,TME)的概念,现已被广泛认可并奉为直肠癌手术的金标准。COFFEY等[2]提出的系膜解剖理论与龚建平[3]提出的膜解剖理论均被认为是对TME理论的延伸,两者属于广义的膜解剖概念。因为直肠系膜由直肠固有筋膜包绕而形成,直肠系膜的完整切除是通过直肠周围的筋膜解剖来实现的,而膜解剖实质上就是研究如何通过筋膜间的平面做到系膜的完整切除[4]。经过多年临床实践,TME显著降低了直肠癌手术后的局部复发率[5],并且术后排尿和性功能障碍发生率显著降低,提高了患者术后生活质量[6]。
众所周知,直肠周围的Toldt间隙是一层直肠固有筋膜与腹膜下筋膜深层之间潜在的、无血管的、易扩展的疏松结缔组织间隙[7],直肠癌TME手术的关键是识别并进入该间隙。手术全程需维持在Toldt间隙中,避免过浅或过深。“浅了”可能损伤肠壁,容易造成系膜残留或医源性肠穿孔,增加复发和腹腔感染的风险,“深了”可能损伤周围神经、骶前血管、输尿管等。目前针对层次分离的方法较少,笔者根据临床经验总结了三角分离模型应用于腹腔镜下直肠癌根治手术解剖层面显露中,具体如下。
1 病例资料
患者女性,49岁,因“大便带血1月余”于2022年7月25日收入中山大学附属第六医院。肠镜显示距肛门12 cm见环腔半周肿物,取检病理诊断为腺癌。术前诊断:直肠癌,行腹腔镜下直肠癌根治术(Dixon);术后病理:中分化腺癌,侵及固有肌层,伴脉管癌栓,肠周1/18枚淋巴结见转移癌,肿瘤分期:pT2N1M0。患者术后恢复顺利,于术后第6天出院。本研究经中山大学附属第六医院伦理委员会批准(编号:2016ZSLYEC-048,有效期10年)。
2 手术方法与技巧
2.1 手术入路
直肠癌腹腔镜手术常用的手术入路为中央入路,即先切开右侧直肠旁沟进入直肠后间隙[8]。第一刀作为关键切入点,常选择骶骨岬下方3~5 cm与右侧髂血管上方2 cm连线交汇处,也可以通过反复拉紧和放松直肠系膜来发现一条不太明显的黄白交界线来判断直肠系膜的根部。切开系膜后助手可适当增加系膜的张力,通过超声刀或电刀产热后的汽化作用进入Toldts间隙。
根据三角分离模型理论,Toldts间隙下方的筋膜被拱形提起,水平进入容易损伤周围组织及神经。要在游离区域虚拟一个三角模型,紧贴三角靠近直肠系膜的附着点(A点)进行分离,分离后会形成新的三角模型,以此类推游离直肠后方Toldts间隙(图1)。按照此方法游离后可见直肠系膜后方及骶前均呈较为光滑的平面,腹下神经隐约可见并得到很好的保护。
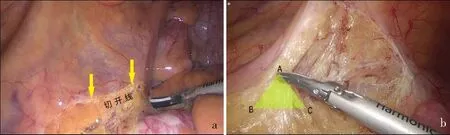
A:中间入路切开线(黄色箭头所示)位置;b:按照“三角分离模型”(黄色三角形所示)进行分离。
另外,临床上采用的外侧入路,即先打开乙状结肠与腹壁的粘连,从直肠左侧进入并拓展Toldts间隙。该入路的优势在于初始操作简单,比较适合初学者使用,缺点是在解剖系膜时易误入肾后间隙[9]。
2.2 肠系膜下血管的处理
沿着Toldts间隙继续向肠系膜下动脉(IMA)根部游离,可见灰白色上腹下丛神经包绕腹主动脉从上而下走形,并于髂血管分叉处发出左、右腹下神经。游离过程中除了对血管的保护,重点是不要损伤神经,避免患者术后出现排便、勃起、射精等功能障碍[10-12]。
根据三角分离模型理论,在助手斜行提起IMA时,上腹下神经丛会被“ヘ”形提起,血管下方筋膜形成一个三角形,需要紧贴三角靠近直肠系膜的附着点进行分离,从而保护左右侧上腹下丛神经不受损伤(图2a)。分离后形成新的三角,以此类推分离。最后骨骼化分离IMA,在距离腹主动脉表面的上腹下丛神经约0.5 cm处切断IMA。
直肠癌手术中IMA的高位结扎和低位结扎保留左结肠动脉(LCA)仍存在争议,吴国举等[13]认为保留LCA的低位结扎与不保留LCA的高位结扎,能达到相似的根治效果;而且保留LCA可以降低吻合口漏的发生以及更早的肠道功能恢复。一项包含有5917例直肠癌手术患者的Meta分析[14]显示,低位结扎IMA表现出更低的吻合口漏发生率和总体并发症发生率。目前中国专家共识[15]建议直肠癌手术中个体化地进行LCA的保留,在不增加手术难度、不牺牲肿瘤根治性的前提下,改善肠管血供,降低手术后吻合口漏等并发症的风险。
肠系膜下静脉(IMV)常位于IMA外侧约2 cm处,应与IMA分别处理(图2b)。少数情况下IMV与LCA紧密伴行,如强行分离易出血,可以一起结扎、切断。
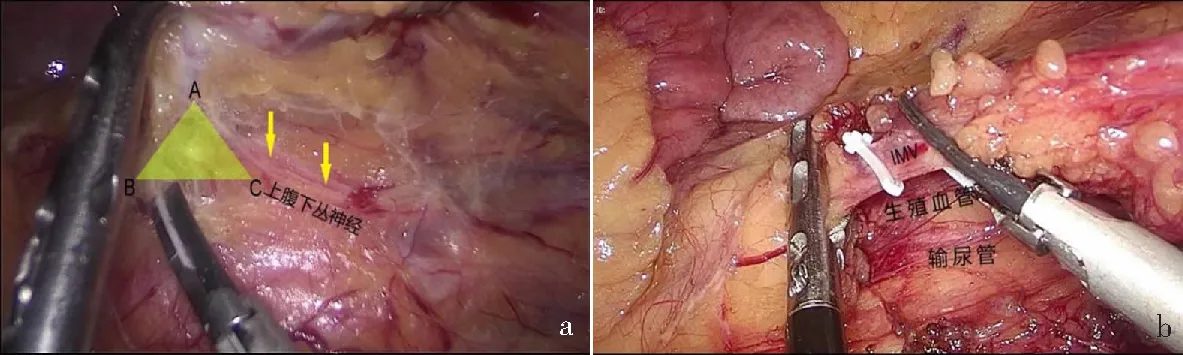
a:按照“三角分离模型”(黄色三角形所示)分离IMA; b:结扎切断IMV。图2 肠系膜下血管的处理
2.3 左半结肠系膜的游离
为减轻吻合口张力,有时需游离左半结肠,甚至将结肠脾曲完全游离。笔者的经验是在以上手术的基础上,可通过三角分离模型分离乙状结肠处粘连(图3a—c)。保持张力后,该区域Toldts筋膜与肾前筋膜(Gerota筋膜)之间可见一条白色的分界线(融合白线),可采取钝性为主、内外结合的方式分离左半结肠后方的Toldts间隙(图3d),郑民华等[16]称之为“翻页式“游离。该区域游离的难点在于手术区域的暴露,对助手的反手操作及杠杆原理的运用是一项较大的考验,通常可通过模拟器反复练习提高操作的速度和准确性。
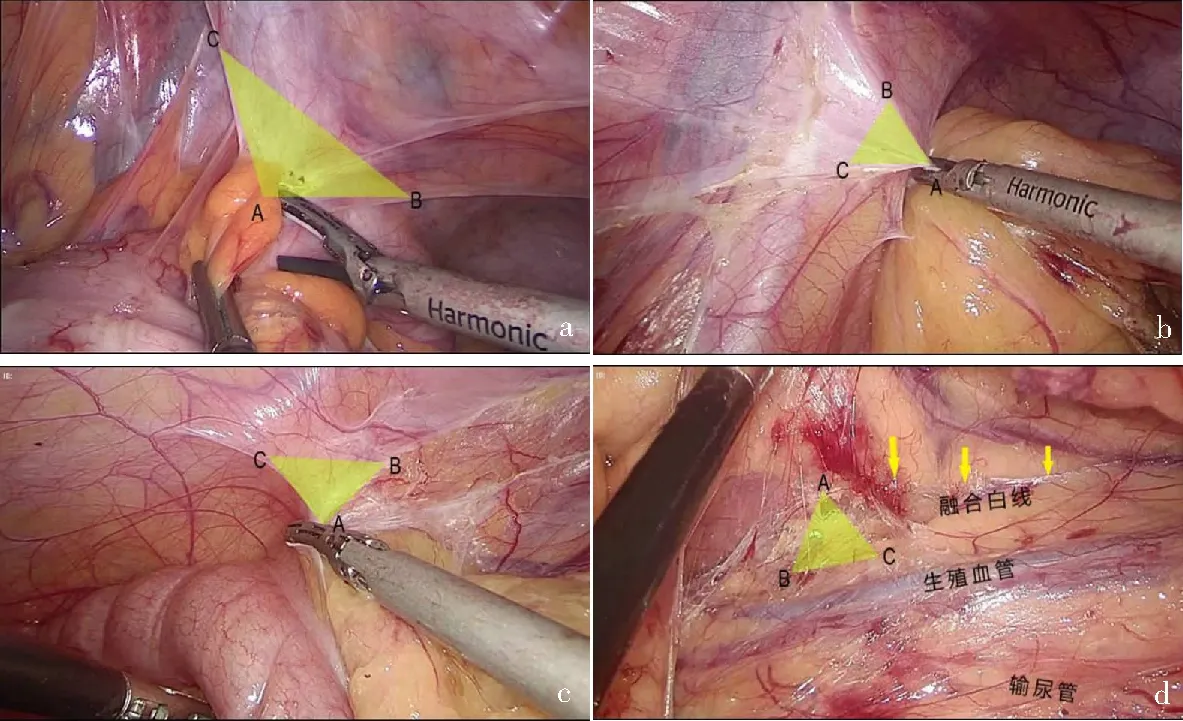
a—c:按照“三角分离模型”(黄色三角形所示)分解乙状结肠;d:在融合白线处拓展Toldts间隙(黄色箭头所示)。
2.4 直肠后方间隙的游离
直肠后方的游离常对直肠侧方的游离起到引导作用,是多数手术者优先游离的区域。池畔教授曾提出“隧道式”分离方法[17],现已被很多术者接受和使用。
笔者利用三角分离模型在直肠后方间隙游离方面积累了一些经验。拓展直肠后方Toldts间隙时,在牵拉最明显处会形成一个正三角形,以蜂窝状的Toldts间隙的直肠系膜附着点设分离点(A)进行分离(图4)。分离后牵拉最明显处发生改变,再重新建立三角形进行钟摆式分离,从而形成弧形的分离线,进一步向远端分离,最后形成一个光滑的U型槽状的分离面。这时可以看到双侧腹下神经和骶前血管得到了很好的保护。
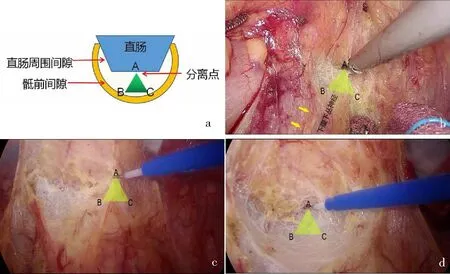
a:示意图;b—d:按照“三角分离模型”(黄色三角形所示)拓展直肠后方Toldts间隙。图4 直肠后方间隙的游离
2.5 直肠两侧间隙的游离
前面提到直肠侧方的游离常以直肠后方的游离为引导,在直肠后方间隙充分游离后直肠两侧的游离变得更加地有的放矢和安全。
直肠左侧间隙的游离需要助手左手顶开直肠前的子宫或膀胱,右手向头侧提拉分离出的腹膜并主刀提起的直肠系膜形成一定夹角,以80°左右为佳。继续向远端游离涉及到直肠侧韧带的争议和神经血管束(NVB)的保护。笔者根据三角分离模型进行分离,能够保持分离平面,避免NVB的损伤。拓展直肠侧方Toldts间隙时,在牵拉最明显处虚拟一个斜三角形,在分离点进行分离后被牵拉的神经、血管能够自然回落原位,不易受到损伤,同时直肠系膜能够被完整切除(图5)。
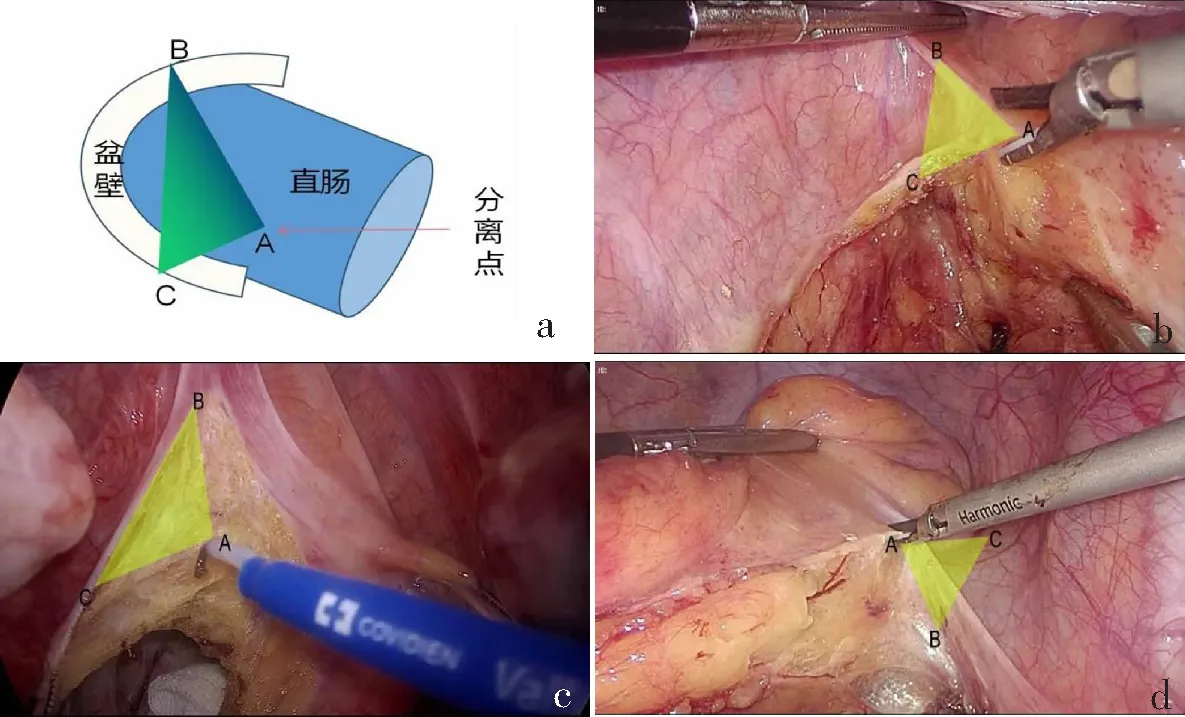
a:示意图;b—d:按照“三角分离模型”(黄色三角形所示)拓展直肠侧方Toldts间隙。图5 直肠两侧间隙的游离
直肠右侧壁的游离与左侧壁类似,主要差异在于助手的牵拉暴露方式不同。另外受到主刀分离器械(超声刀、电刀)本身的干扰,游离时容易出现或“浅”或“深”的偏离,需要及时修正路线。
有些肥胖、骨盆狭小或系膜冗长的患者,助手一支钳子将直肠拉直扯紧变得十分困难,稍不注意就会撕裂直肠系膜造成出血而影响手术进度。笔者的经验是此时可以在骶骨岬下方3 cm左右直肠系粗绳,助手左手夹紧绳子后将直肠推向腹腔并与游离的方向相反。这样可以在安全的前提下保持较好的张力,充分显露分离点。
2.6 直肠前方间隙的游离
直肠前方间隙的游离常涉及切开线与腹膜反折线关系及何时切开邓氏筋膜的争议问题[18]。有些专家认为无论肿瘤是否累及直肠前壁,均可以在上述位置切开腹膜反折。这样操作可以方便主刀左手钳抓住已切开的腹膜反折,与助手顶起阴道或膀胱后壁的两把钳子形成对牵,清晰显露直肠前方间隙便于进行分离。
显露直肠前方间隙后,可根据三角分离模型进行分离:在牵拉最明显处虚拟一个倒三角形,于直肠系膜附着点(A)分离,分离后根据牵拉变化重新设立分离点,以此类推,与侧方交汇时可见NVB穿行,应避免损伤(图6)。有些肥胖或骨盆狭小的患者,直肠前方间隙暴露困难,可以采取悬吊子宫或膀胱后壁的方法辅助暴露。
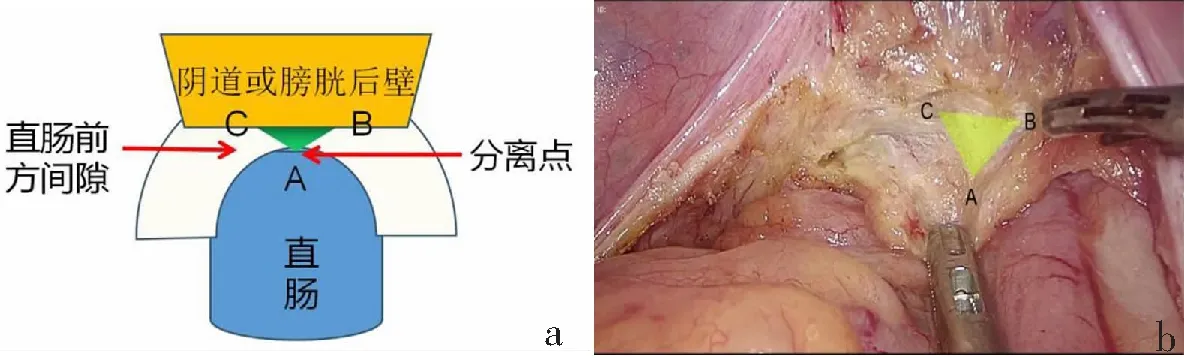
a:示意图;b:按照“三角分离模型”(黄色三角形所示)拓展直肠前方间隙。图6 直肠前方间隙的游离
2.7 直肠裸化及闭合切断
直肠裸化前需先确定肿瘤下极,可通过术中肛诊、缝线测量和钛夹标记等一系列方式进行。裸化后的位置可用2-0 prolene线收紧直肠,该方法能够使肿瘤远端正常肠管包住肿瘤,防止肿瘤被加压后误切割造成肿瘤播散,同时能让60 mm线型切割闭合器更容易完整切割闭合直肠,减少部分患者钉舱的使用,达到即经济又安全目的(图7)。
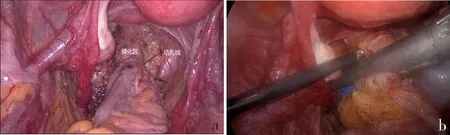
a:裸化直肠系膜,prolene线收紧直肠;b:闭合切断直肠。图7 直肠裸化及闭合切断
3 讨论与结语
近年来,随着3D腹腔镜和外科手术机器人技术为代表的腔镜外科技术在临床的应用,可以使术野最高放大到15倍,分辨率也提高到高清4K、甚至8K[19]。外科医生对解剖学的观察和认识进入了“亚微解剖”的层次,引发了对手术层面更加精细的认识和盆腔自主神经保护的再思考[20]。
笔者提出的“三角分离模型”通过更加清晰的视野能够得到更好的应用。其优势是术中利用直肠周围层次动态变化,识别出正确的分离点,然后由点到线,由线到面进行分离。该方式使得复杂操作简单化,有利于青年医师学习和掌握腹腔镜直肠癌根治术的操作,缩短他们的学习曲线。同时有望更大程度降低系膜残留及直肠周围重要结构以及自主神经损伤的机会,提高直肠癌患者的术后生活质量,后续还需要对照研究提供循证医学证据。由于患者存在个体差异性,例如新辅助放化疗后、肿瘤明显外侵时,局部分界不清,难以维持清晰的层面,此时需仔细分辨分离点,要沿着已分离出的间隙,采取钝性和锐性相结合的方式拓展间隙,避免副损伤。
综上所述,三角分离模型基本可以实现腹腔镜直肠手术全程适用,充分的暴露和正确的分离层次保证了直肠全系膜切除的完整性和周围结构、自主神经的安全性。另外,左半结肠和右半结肠腹腔镜手术涉及类似的组织间隙和分离过程,而腹部无切口经自然腔道取标本的外科手术(NOSES)和经肛全直肠系膜切除术(taTME)也涉及结直肠全系膜切除中识别正确分离层面和周围组织、神经保护的问题,三角分离模型或许能在这几种术式中被应用。今后,笔者会通过临床不同手术类型的实践进一步验证该理论的有效性和安全性。

