肥胖患者不同糖代谢状态对非酒精性脂肪性肝病严重程度的影响
陈有为, 康星, 严雨, 俞杭, 陈思含, 孙喜太
(1. 南京大学医学院,江苏 南京 210008; 2. 南京大学医学院附属鼓楼医院减重代谢外科,江苏 南京 210008)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指在无饮酒、未服用致脂肪变性的药物及其他损肝因素存在的情况下,肝脏中出现过多的脂质堆积[1]。根据不同的组织学特征,NAFLD的疾病谱可划分为单纯的非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)及肝纤维化,并可逐渐发展为肝硬化和肝癌[2-3]。其中肝脏纤维化是NAFLD最重要的组织学特征,且该特征常预示着有更晚期的肝病存在与较高风险病死率[4-5]。据报道,近年来因NAFLD较严重的肝组织病变如肝纤维化、肝硬化而住院的患者逐年递增[6-7]。因此,筛查出促进NAFLD发展的影响因素并及时予以干预对于改善NAFLD的预后至关重要。
临床上,NAFLD通常在常规检查中发现。据统计,普通人群中该疾病的患病率为20%~30%[8]。然而一项包含约50 000个样本的荟萃分析指出,全球T2DM患者NAFLD患病率却高达55.5%[9]。对此,有学者认为NAFLD是代谢综合征的肝脏表现,因此与T2DM密切相关。此外,也有研究将胰岛素抵抗的严重性与NAFLD的发展相关联[10]。实际上,关于糖代谢紊乱与NAFLD患病率增加相关的原因尚未得到充分研究。其次,促进NAFLD发展的危险因素可能因地理及种族因素而有所差异。本研究着重探讨肥胖患者不同糖代谢状态对NAFLD严重程度的影响,希望为控制NAFLD的进展提供新的视角。
1 资料与方法
1.1 研究对象
回顾分析2018年7月至2021年7月于南京大学医学院附属鼓楼医院减重代谢外科中心行减重手术的490例肥胖患者的临床资料。所有患者均按照纳入及排除标准入组,纳入标准:① 年龄16~65岁;② 减重手术适应证符合2019年发布的《中国肥胖和2型糖尿病外科治疗指南(2019)》[11];③ 腹部彩超及Fibrotouch检查(公司:海斯凯尔;型号:FT7000-004-002)提示存在脂肪肝,且无过量饮酒史(男性乙醇摄入量<30 g/d,女性乙醇摄入量<20 g/d)及其他肝脏疾病。排除标准:① 术前检查不完善或基线数据缺失;② 未在术中行肝脏组织活检及肝组织病理未行NAFLD活动度评分;③ 1型糖尿病诊断明确。最后共纳入111例肥胖合并NAFLD患者,并根据不同的糖代谢状态分为T2DM组与非T2DM组。
所有研究对象术前均完善相关检查及评估,以排除绝对手术禁忌,由主治医师告知减重手术与肝脏组织活检的获益及其风险,待患者知情同意后签署由南京大学医学院附属南京鼓楼医院医学伦理委员会审核批准的《普外科手术知情同意书》与《采集和使用样本知情同意书》。
1.2 临床指标
记录患者一般人口学特征,如性别、年龄、体重、体重指数(BMI)。于清晨空腹时抽取患者静脉血,检测并记录血清学指标及生化指标,如空腹血糖、空腹血清胰岛素、空腹C肽、稳态模型评估胰岛素抵抗指数(HOMA-IR)、糖化血红蛋白(HbA1c)、谷丙转氨酶、谷草转氨酶等。其中HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mmol/L)÷22.5[12]。
1.3 T2DM的诊断
根据“中国2型糖尿病防治指南”[13],所有纳入研究对象满足以下任何一个条件即患有T2DM:① 患者自诉有糖尿病病史,伴或不伴正在服用抗糖尿病药物;② 空腹血糖>7.0 mmol/L;③ 餐后2 h血糖≥11.1 mmol/L;④ HbA1c≥6.5%。
1.4 NAFLD的病理评估
由同一位主刀医师于肝脏左侧外叶边缘取约1.0 cm的楔形肝组织送术后病理,并由资深的肝脏病理科医师按照NASH临床研究网病理工作组确认的评分标准[14],对NAFLD行活动度评分(NAFLD activity score,NAS)及分类。NAS积分范围为0~8分,包括肝细胞脂肪变性0~3分(0分:脂肪变性范围<5%;1分:5%~32%;2分:33%~66%;3分:>66%);气球样变性0~2分(0分:无气球样变;1分:少量气球样变;2分:明显气球样变);小叶炎症0~3分(0分:无炎症;1分:200倍镜下<2个炎症灶;2分:200倍镜下2~4个炎症灶;3分:200倍镜下>4个炎症灶);NAS总积分≥5为NASH,2~5分为NASH可能,≤2分为非NASH。根据《肝纤维化诊断及治疗共识(2019年)》[15]将所有NAFLD患者肝纤维化病变分为4期,分别为0期:无纤维化;1期:轻度纤维化;2期:中度纤维化;3期:进展期肝纤维化;4期:肝硬化。统计分析时,将脂肪变性0~1分归类为轻度,2分为中度,3分为重度;气球样变1分为轻度,2分为重度;小叶炎症1分为轻度,2分为中度,3分为重度。
1.5 统计学分析

2 结果
2.1 患者一般特征
共111例肥胖合并NAFLD患者纳入本研究,其中有30例(27.0%)同时患有T2DM,平均年龄为(36.43±9.80)岁;81例患者(73.0%)无T2DM,平均年龄为(31.69±8.90)岁。两组患者年龄间的差异有统计学意义(P<0.05)。T2DM组NAFLD脂肪变性和NAS总积分明显高于非T2DM组(P<0.05)。其他临床及统计学特征见表1。
2.2 NAFDL不同病理严重程度的分布
结果显示,T2DM组中肝轻度脂肪变性5例(16.7%),低于非T2DM组的35例(43.2%),中重度肝脏脂肪变性25例(83.4%)明显高于非T2DM组46例(56.8%),差异有统计学意义(P<0.05)。111例中共有31例NAFLD患者进展为NASH,其中T2DM组12例(40.0%),高于非T2DM组的19例(23.5%),差异有统计学意义(P<0.05)。T2DM组轻度和中度肝纤维化12例(40.0%),高于非T2DM组的15例(18.5%),差异有统计学意义(P<0.05)。而气球样变与小叶炎症不同病变程度的分布,两组未见明显差异(P>0.05)。见表2。
2.3 NAFLD各病理严重程度与糖代谢指标间的相关性分析
NAFLD肝脂肪变性的严重程度与空腹胰岛素、HbA1c、空腹C肽、HOMA-IR呈正相关(P均<0.05),其中与空腹C肽值的相关性最强(rs=0.420,P<0.001),与HbA1c相关性最弱(rs=0.200,P=0.035),而与空腹血糖值无明显相关性。NAFLD的小叶炎症病变、气球样病变及肝纤维化病变的严重程度与空腹血糖、空腹胰岛素、空腹C肽、HbA1c、HOMA-IR均无明显相关性(P>0.05)。见表3。
2.4 NASH的影响因素
为评估促进NASH发生的影响因素,将NASH(NAS≥5)与非NASH(NAS≤2)作为结局变量进行二分类Logistic回归分析。将年龄、BMI、空腹血糖、空腹胰岛素、空腹C肽、HbA1c及HOMA-IR视为可能的相关性因素纳入单因素Logistic回归分析,结果显示BMI、空腹血糖、空腹C肽、HbA1c、HOMA-IR为NASH的影响因素(P<0.05),见表4。将以上影响因素带入Lasso回归,最终在λ为0.031的情况下,对应模型的变量选择为BMI、HbA1c、空腹C肽、空腹血糖;将Lasso回归中选择的变量纳入多因素Logistic回归分析模型中,采用向前LR法和向前条件法排除相关混杂因素后,结果表明空腹C肽为NASH的独立危险因素(OR=1.002,95%CI:1.000~1.004,P=0.048)。经ROC曲线分析显示,空腹C肽预测NASH的曲线下面积为0.754(95%CI:0.609~0.899,P<0.05),最佳临界值为1 542.5 pmol/L,对应的敏感度为60.0%,特异度为87.5%,表明空腹C肽在预测肥胖患者NASH方面具有一定的临床应用价值。当空腹C肽值>1 542.5 pmol/L时,NASH发生的概率更大。见图1。

表2 NAFLD不同病理严重程度分布的比较 例(%)
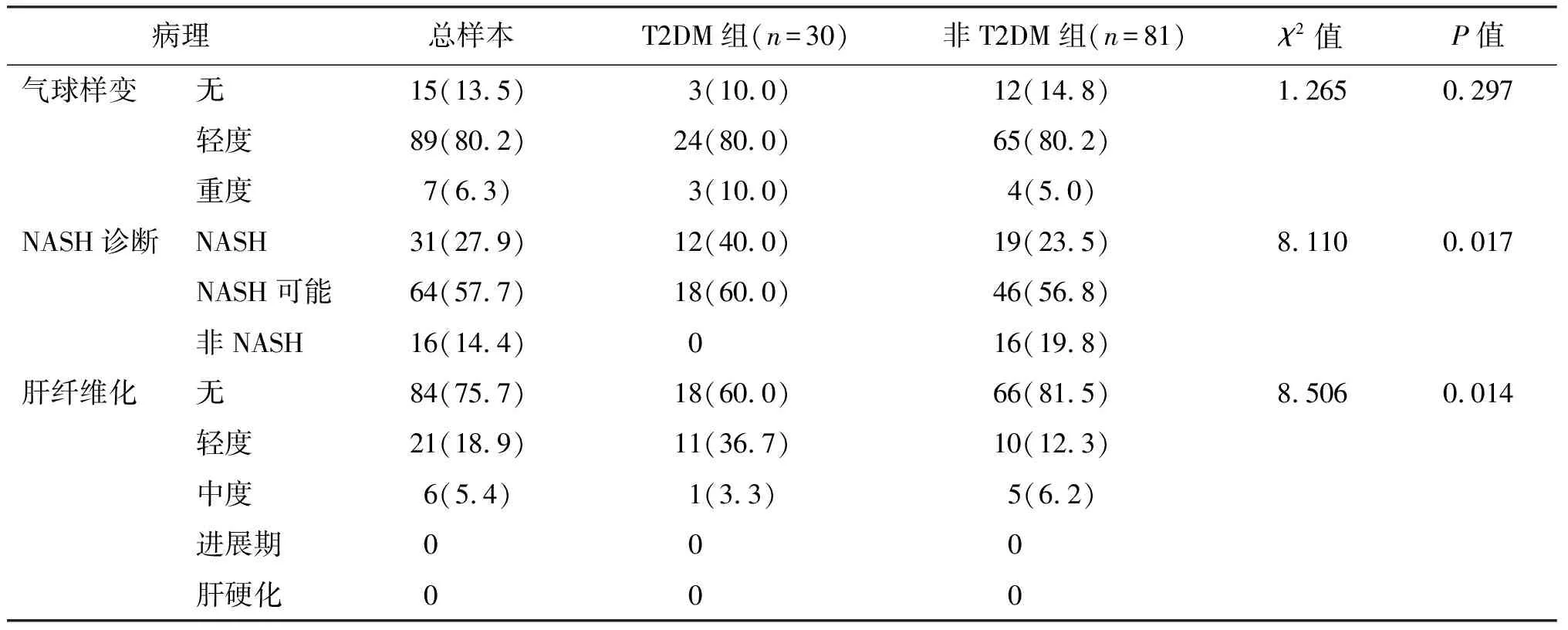
续表2

表3 糖代谢指标与NAFLD各病理严重程度间的相关性分析
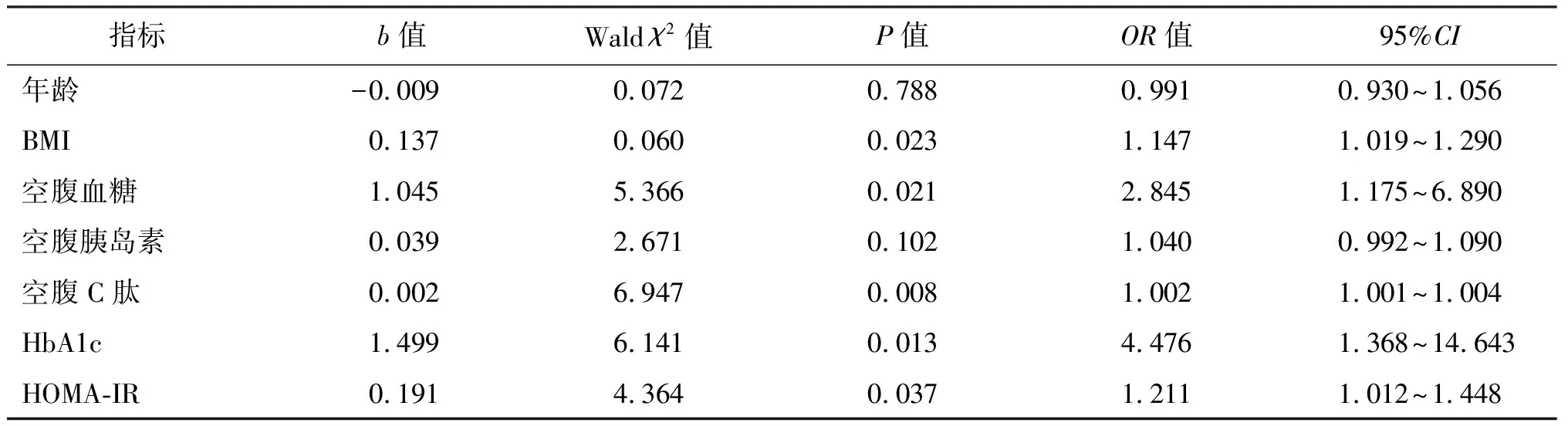
表4 单因素Logistic回归分析NASH的影响因素
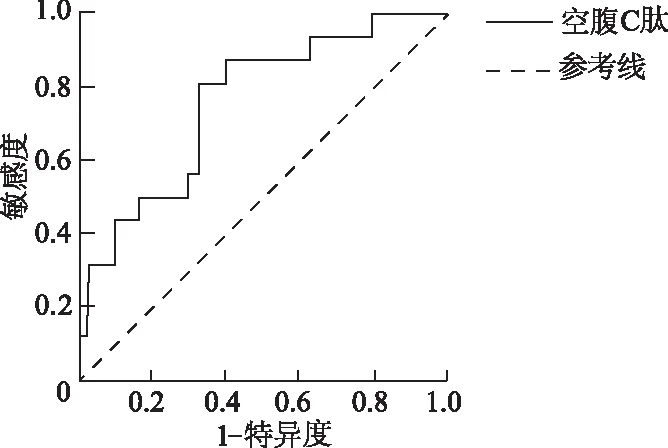
图1 空腹C肽预测NASH的ROC曲线
3 讨论
本研究通过回顾性分析比较肥胖患者在不同糖代谢状态下NAFLD病变的严重程度,证明了NAFLD的肝组织受损程度与机体存在糖代谢紊乱相关。与非T2DM组患者相比,合并有T2DM的肥胖患者NAFLD脂肪变性更严重,且由非酒精性脂肪肝发展为NASH和肝纤维化的风险更高。曾有文献报道称T2DM与NAFLD存在几种共同的代谢异常,如葡萄糖和脂质稳态缺陷、胰岛素抵抗和慢性炎症[10,16-17],但关于T2DM加重NAFLD病变程度的确切途径尚不完全清楚。因此本研究进一步采用Spearman相关分析探索NAFLD不同病理变化的严重程度与糖代谢指标的相关性,结果显示肝脏脂肪变性的严重程度与空腹胰岛素、空腹C肽、HbA1c及HOMA-IR呈正相关,而与空腹血糖水平并无明显相关性,据此我们考虑糖代谢紊乱增加肝脏脂肪变性的严重程度主要归因于胰岛素抵抗或高胰岛素血症。其可能的机制是,一方面,根据NAFLD“二次打击”理论[18],胰岛素抵抗使脂肪组织分解增加,游离脂肪酸增多,过多的游离脂肪酸在肝脏中蓄积使肝细胞体积增大及功能受损,进而促进了脂肪肝的发生及进展。另一方面,胰岛素抵抗可促进肝星状细胞增殖与活化,胶原产生增加,因而导致了NAFLD脂肪变性的不断加重[19]。然而目前关于胰岛素抵抗增加肝脂肪变性病变程度的具体机制尚不充分,仍需进一步研究。本研究未发现糖代谢指标与肝小叶炎症、气球样变及肝纤维化病变的严重程度之间存在相关性,因此我们认为T2DM加重NAFLD整体肝组织的损伤可能始于肝脏脂肪堆积,并且改善胰岛素抵抗的生活方式调整或药物干预也许可以缓解肝脏脂肪变性的严重程度,而对NAFLD进展期病变如NASH、肝纤维化的作用则较为有限。因此就改善肥胖患者NAFLD的预后而言,首先,当机体无糖代谢紊乱时,应密切关注自身血糖控制情况;其次,当合并胰岛素抵抗或T2DM时,定期评估肝组织进展情况很有必要。
研究指出,NASH由于易导致肝功能不全而成为目前肝移植的第二大原因,且进展为NASH的NAFLD患者患肝细胞癌的风险也更大[20],因此尽早检测出NASH并及时调整干预方案对于改善NAFLD的预后尤为重要。本研究通过肝组织活检发现T2DM组患者NASH的患病率为40.0%,与文献报道的37.33%相似[21]。该结果表明,当肥胖患者机体存在糖代谢紊乱时,非酒精性脂肪肝更易进展为NASH。此外,由于NASH的诊断对于NAFLD的治疗具有重要的指导意义,因此对于合并糖代谢紊乱的肥胖个体可能更有必要行肝组织活检。本研究中,考虑到肥胖作为众多疾病预后不良的影响因素[22],以及腹腔镜手术便于获取肝组织,所以在减重手术结束时对于术前检查提示存在NAFLD的患者均附加肝组织活检术。然而,在临床工作中,肝脏活组织检查不仅有创伤性,同时还因具有重复性较低、术后可能出现相关并发症等问题,在未行减重手术的肥胖人群中难以广泛应用。因此,寻找无创、重复性高且较为准确的诊断方法对于NAFLD严重程度的评估显得十分重要。
与非酒精性脂肪肝相比,NASH不仅较难检测,而且危害性更高。此外,考虑到临床上肝纤维化的发病率比NASH较低,因此本研究着重评估了NASH的影响因素。既往文献表明,空腹血糖及HOMA-IR升高会促进NASH的发生与发展[23]。而本研究结果仅显示空腹C肽值为NASH的独立危险因素,考虑可能的原因是本研究所选取的研究对象均为年轻的肥胖患者。文献报道约40%肥胖合并糖尿病患者接受减重手术后不再需要口服抗糖尿病药物[24],因此该类患者相对于老年人群而言,糖代谢紊乱普遍较轻且多数处于由肥胖引起的胰岛素抵抗状态,因此血糖水平并无明显升高。事实上,C肽是由胰岛素原裂解成胰岛素时产生的短多肽,与胰岛素一起等量产生和释放,因此C肽常用来评估胰岛素抵抗程度,且C肽值越高,胰岛素抵抗越严重[25-26]。而进一步绘制的ROC曲线显示空腹C肽预测NASH的曲线下面积为0.754(95%CI:0.609~0.899,P<0.05),表明空腹C肽对NASH的发生具有一定的预测价值。
有学者指出,体重降低5%及以上有助于减少肝脏脂肪变性的发生率,而对于改善NASH及肝纤维化则至少需要降低体重的7%~10%[21]。减重手术不仅能大幅度降低体重水平,而且可以使肥胖人群长期稳定维持正常体重状态,同时也可以显著降低代谢相关并发症如NAFLD及T2DM的发生率。曾有2项荟萃分析表明,减重手术对于非酒精性脂肪肝、NASH和肝纤维化的缓解率分别为66%~88%、50%~76%及30%~40%[27-28]。而本研究增加了更多T2DM促进NAFLD病变进展的证据,因此对于肥胖合并NAFLD的患者而言,当机体同时存在血糖调节紊乱时,可以早期考虑减重手术作为预防NAFLD进展并改善糖代谢紊乱的治疗方案。当然,这一问题值得进一步探讨。
该研究存在以下局限性。① 本文为回顾性研究,样本量较少,就T2DM促进NAFLD进展的机制而言仍需要进行基础研究及前瞻性、随机、大样本的临床研究;② 本研究所纳入的研究对象均为肥胖患者,所以得出的不同糖代谢状态对NAFLD严重程度的影响的适用人群存在一定的限制。因此,应进一步比较BMI正常人群在不同糖代谢状态下的NAFLD病变程度;③ 本研究根据糖代谢状态的不同只分为T2DM组与非T2DM组,而忽视了糖尿病前期即糖耐量受损状态,因此进一步的研究应考虑将糖耐量受损纳入组间比较;④ 该研究仅局限于患者基线资料的研究,就NAFLD及糖代谢状态进展而言,并未进行长期随访;⑤ 本研究对象均为较年轻的肥胖患者,在预测NASH危险因素方面可能会由于年龄问题而与以往研究结论有所不同,所以尚需进一步探究老年肥胖合并NAFLD患者NASH的危险因素。
综上所述,当肥胖患者存在糖代谢紊乱时,NAFLD脂肪变性程度会更严重,非酒精性脂肪肝向NASH及肝纤维化的进展风险会显著增加。此外,随着空腹C肽值的升高,发生NASH的可能性也随之增加。因此,对于肥胖合并NAFLD的患者,当机体存在T2DM或血清空腹C肽值较高时,可以早期将减重手术作为干预手段纳入考虑;此外,应定期评估肝组织进展情况,以及时调整对于NAFLD的治疗方案。

