添加复苏促进因子的液-固相培养技术在结核分枝杆菌培养中的应用研究*
涂凡,吴娟,刘君,翟桦梓,芮小红,范小勇,张莹莹
(1.江南大学附属无锡市第五人民医院检验科,江苏无锡 214000;2.上海市(复旦大学附属)公共卫生临床中心,上海 201508)
结核病是备受关注的全球性公共卫生问题[1],我国结核病流行形势依然严峻。尽早干预治疗是世界卫生组织建议的结核病防治关键措施之一[2],因而早期、快速和准确的诊断手段至关重要。目前,细菌培养仍然是结核病实验室诊断的金标准,但由于结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)代谢慢、生长周期长,检测报告通常需要一个月以上才能获得。此外,有研究显示,Mtb休眠菌的存在是造成潜伏感染甚至结核病复发的重要原因,也是导致结核培养灵敏度低且耗时长的关键因素[2-3]。
Mtb复苏促进因子(resuscitation-promoting factor,Rpf)是一个蛋白质家族,包含RpfA(Rv0867c)、RpfB(Rv1009)、RpfC(Rv1884c)、RpfD(RV2389c)、RpfE(Rv2450c)5个成员[4]。Rpf是一种裂解性转糖基酶,能水解Mtb休眠菌的细胞壁肽聚糖,从而使结核菌从休眠状态转变为活跃复制状态[4-6]。已经证明,肺结核患者的痰液中含有在普通培养基中无法生长的Rpf依赖性细菌,需要补充 Rpf才能生长,且Rpf依赖性细菌占比较高[7-9]。本研究的创新性在于利用Rpf在结核菌体外培养过程中能激活休眠菌的特性,在普通培养基中添加了Rpf制成液-固相培养基,提高Mtb培养的灵敏度并缩短培养时间,分析此种简单的改良培养技术在Mtb培养乃至结核病诊断中的应用价值。
1 对象与方法
1.1研究对象 选取2020年7月至12月无锡市第五人民医院收治的诊断肺结核的住院患者224例,排除留样不合格21例,合并感染2例和培养污染25例,共计176例肺结核患者的样本纳入研究。其中男性133例,女性43例,年龄(56.9±19.8)岁。肺结核诊断依据中华人民共和国卫生行业标准《肺结核诊断》(WS 288—2017)。样本均为患者临床实验室检验完成后剩余的痰液。
1.2仪器和试剂 ST-16型细胞离心机、HERAcell 150i二氧化碳培养箱(Thermo Scientific公司);BD960全自动快速分枝杆菌培养仪、MGIT培养管、杂菌抑制剂PANTA、营养添加剂OADC(BD公司);晶芯分枝杆菌菌种鉴定芯片试剂盒、Extractor 36核酸提取仪、杂交仪、芯片洗干仪、基因芯片微阵列芯片扫描仪LuxScan 10K/B(成都博奥晶芯生物科技有限公司);抗酸染色液(BASO公司);中性罗氏培养基、20 g/L N-乙酰半胱氨酸-NaOH溶液、5 g/L NaOH溶液实验室自配;多黏菌素、两性霉素B、甲氧苄啶和羧苄青霉素(Sigma公司);Tween 80(生工生物公司);Rpfs培养液由上海市公共卫生临床中心结核病感染免疫课题组自制。
1.3方法
1.3.1标本采集 患者在医生的指导下,留取足量晨痰于螺旋盖痰瓶中,立即由专人送至检验科。挑取黄色、脓样/黏液样痰,直接涂片并革兰染色,低倍镜观察,选取白细胞大于25个/低倍镜且上皮细胞小于10个/低倍镜的痰样本为合格样本。收集临床检验完成后的样本,4 ℃冷藏待用。
1.3.2浓缩集菌抗酸涂片 待检标本加入含5 g/L NaOH溶液玻璃管,振荡混匀后放入100 ℃沸水中30 min,4 000 r/min离心15 min;取沉淀物涂片、烘干染色。结果判读:油镜下见Mtb呈红色杆状或分枝状报告阳性;如连续观察300个不同视野,未发现抗酸杆菌则报告阴性。
1.3.3标本前处理 挑取约5 mL(不超过10 mL)标本至50 mL无菌离心试管中,加入等量2% N-乙酰半胱氨酸-NaOH溶液,旋涡振荡20 s;室温静置15 min后,加入无菌PBS(pH 6.8)至50 mL,3 000 r/min离心15 min后,弃上清液,添加1~3 mL PBS(pH 6.8)重悬菌体。
1.3.4含Rpfs的液体培养液配制 PCR扩增RpfB和RpfE基因[10],用BamHⅠ和EcoRⅠ双酶切扩增产物,回收的目的片段与同样双酶切的pET-28a载体连接,将重组表达的质粒转化E.coliBL21(DE3)感受态细胞制备Rpfs,分装备用;1 L液相培养液中加入RpfB 1.516 mg,RpfE 0.716 mg,多黏菌素B 40 U/mL,两性霉素B 4 μg/mL,甲氧苄啶2 μg/mL,羧苄青霉素50 μg/mL,Tween 80 0.5 mL,甘油5 mL。
1.3.5液-固相培养 在中性罗氏培养基中加入1 mL含Rpfs的液体培养液[11],接种上述处理后的0.5 mL痰标本至培养管中,将接种过的斜面来回晃动,使菌液均匀漫过斜面,斜面朝上放入37 ℃恒温培养箱内培养。结果判读:接种后第3、5、7……35天观察培养情况,此后每周观察1次,直至第8个周末。每次观察后记录培养结果。液相成分中观察到培养液浑浊或颗粒样菌团悬浮,震荡后无明显变化,经涂片证实可记录为阳性结果。Mtb菌落在固相琼脂上为典型的干燥菜花样颗粒形态,而非结核分枝杆菌(nontuberculosis mycobacteria, NTM)则呈现出不典型、细小圆形及颜色各异的菌落形态。
1.3.6MGIT 960液体培养 0.8 mL含杂菌抑制剂PANTA的营养添加剂OADC加入BBL MGIT培养管中,接种标本前处理后的0.5 mL痰标本至MGIT培养管,放入BD960全自动快速分枝杆菌培养仪培养;结果由仪器自动读取。
1.3.7培养阳性验证方法 采用《结核病实验室检验规程》[12]中基因芯片鉴定方法,对前述抗酸涂片阳性的痰液样本、MGIT 960液体培养和液-固相培养分离的菌株进行菌种鉴定。从合适的培养基上用无菌接种环挑取一个肉眼可见的菌落(或从MGIT 960液体培养基中吸取 1个麦氏浊度单位的15 μL菌悬液)至核酸提取管中,用Extractor进行核酸提取作为DNA模板,使用分枝杆菌菌种鉴定试剂盒配制18 μL PCR反应体系,并加入2 μL模板DNA进行扩增,扩增后产物作为PCR产物;在离心管中加入9 μL杂交缓冲液,再加入6 μL PCR产物作为杂交反应混合物,将杂交反应混合物加热至90 ℃进行变性反应5 min,立即冰浴3 min待用;在基因微阵列芯片杂交盒中加入13.5 μL冰浴后的杂交反应混合物,密封放入50 ℃预热的恒温水浴锅中,计时120 min进行杂交反应;杂交反应结束后取出芯片,使用恒温摇床室温洗涤2遍,800 r/min离心5 min,甩干扫描;使用微阵列芯片扫描仪LuxScan进行信号读取及结果判读。
1.4统计学分析 采用SPSS 20.0软件进行。计数资料以例数(率)进行描述,两组间比较采用χ2检验;计量资料两组间比较采用非参数检验的Mann WhitneyU检验及配对样本非参数检验的Wilcoxon Signed Ranks检验。以P<0.05为差异有统计学意义。
2 结果
2.1浓缩集菌抗酸涂片、MGIT 960全自动培养、液-固相培养阳性率比较 176例样本经浓缩集菌抗酸涂片后检出阳性73例(41.5%),MGIT 960全自动培养阳性99例(56.3%),液-固相培养阳性102例(58.0%)。液-固相培养阳性率略高于MGIT 960全自动培养,差异无统计学意义(P>0.05);与浓缩集菌抗酸涂片对比,差异有统计学意义(χ2=9.557,P=0.002),见表1。其中,3种方法均阳性61例,液-固相培养和MGIT 960培养均阳性96例,仅在液-固相培养时出现阳性2例,仅在MGIT 960培养时出现阳性1例,仅抗酸涂片阳性6例。
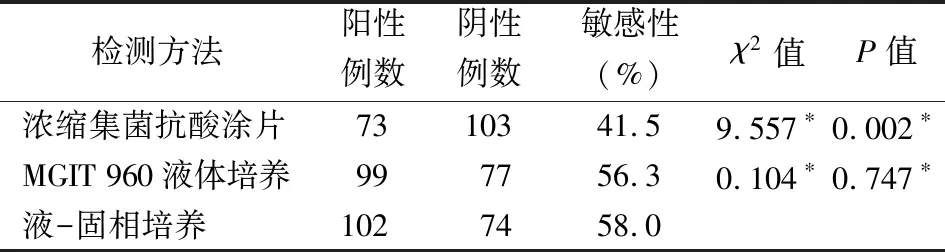
表1 3种方法诊断176例肺结核患者的检测敏感性
2.2液-固相培养和MGIT 960液体培养平均报阳时间的比较 对肺结核患者痰液培养阳性结果进行分析,液-固相培养的平均报阳时间为8.0(6.0,10.0) d,对比MGIT 960液体平均报阳时间10.0(7.0,15.0) d,差异有统计学意义(Z=-3.223,P<0.001);进一步按照960液体培养阳性结果分为1~10 d、11~20 d、21~35 d 3个区间,MGIT 960液体培养平均报阳时间分别为7.0(5.0,9.0) d、14.0(12.0,16.0) d、22.6(21.8,25.0) d,液-固相培养平均报阳时间分别为7.5(6.0,10.0) d、10.0(7.3,13.5) d、14.0(5.5,21.0) d。二者在细菌数量较少的两个区间(11~20 d、21~35 d)内差异具统计学意义(Z=-4.582,P<0.000 1;Z=-2.805,P=0.005)。
2.3液-固相培养技术对NTM的鉴别诊断 176例临床样本中,MGIT 960液体培养和液-固相培养分别检出阳性99例和102例,阳性培养物进一步经抗酸染色和基因芯片确认,均同时检出NTM菌株5例(其中胞内分枝杆菌3例,鸟分枝杆菌2例),痰标本直接进行抗酸染色检出3例NTM阳性(见表2,图1)。MGIT 960液体培养无法区分Mtb和NTM,而液-固相培养则通过对固相斜面上生长菌落形态的观察即可初步鉴别5株不典型菌落,经基因芯片确认为NTM。
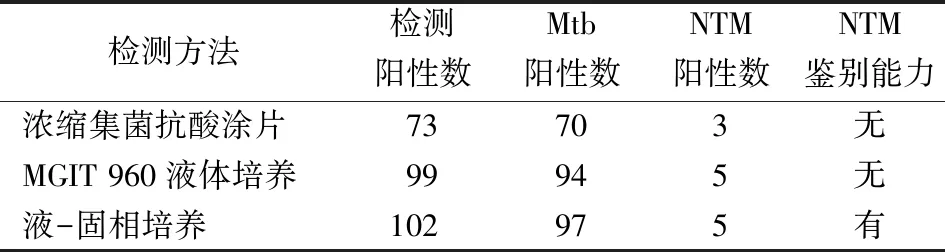
表2 3种方法的NTM诊断分析

注:A,典型菜花样的Mtb菌落(培养30 d);B,不典型的NTM菌落(培养7 d);C,不典型的NTM菌落细菌抗酸染色。
3 讨论
Mtb感染宿主后,在肺泡巨噬细胞中复制,大多数情况下,宿主的免疫防御会抑制细菌生长,导致病原体进入非复制性/持留性休眠状态[13-15];当宿主的免疫力减弱时,休眠的病原体则会复制而导致活动性结核病的发生,非复制性休眠菌在体内长期存活的能力给结核病的诊断和治疗带来了巨大的困难。本研究中,基于患者痰液中存在大量依赖Rpfs的非复制性结核菌,首次在普通中性罗氏培养基中加入富含Rpfs的Middlebrook 7H9液体培养基制备成液-固相培养基,并对176例肺结核患者痰液样本分别应用浓缩集菌抗酸涂片、MGIT 960全自动液体培养和液-固相培养进行同步检测,结果表明液-固相培养的阳性率最高,灵敏度为58.0%,高于MGIT 960全自动培养(56.3%),显著高于涂片抗酸染色(41.5%),差异有统计学意义;此外,液-固相培养的报阳时间仅为8.0(6.0,11.0) d,对比MGIT 960液体培养阳性的时间,差异有统计学意义;在MGIT 960液体培养阳性结果11~20 d区间内,液-固相培养阳性时间明显缩短,尤其在21~35 d区间内,液-固相培养阳性时间显著缩短,出现这一结果可能由于患者痰液中存在较大比例的非复制休眠菌。尽管Mtb在MGIT 960液体培养生长过程中也会分泌产生Rpfs,但由于Mtb生长缓慢,导致自身产生的Rpfs作用滞后,而本研究的液-固相培养基中预先添加了重组表达的Rpfs,通过对非复制休眠菌的刺激而达到快速复苏的效果,缩短了培养的报阳时间。
MGIT 960液体培养须依赖于进口仪器、成本高,无法做出菌种分型,有假阳性的可能。本研究使用的液-固相培养集合了罗氏培养和MGIT 960液体培养的优点,培养时间短、成本低廉、操作简单、无需依赖进口仪器,且可初步鉴别Mtb或NTM,为Mtb培养提供了一种实用且便捷的新方法,适宜于基层医疗机构的推广使用。

