多黏菌素与美罗培南联合应用对碳青霉烯耐药肺炎克雷伯菌多黏菌素异质性耐药的体外抗菌活性分析*
尉景娟,陈硕,孙伟,许颖,张婧雯,马立艳
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
肺炎克雷伯菌(Klebsiellapneumoniae, Kpn)是临床常见致病菌,也是院内感染的主要致病菌之一[1]。近年来,随着抗菌药物不合理使用的逐渐增加,多重耐药及泛耐药革兰阴性杆菌导致的感染也不断增加,成为威胁人类健康的主要原因之一。其中碳青霉烯耐药肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae, CRKP)引起的感染更是临床抗感染治疗中的棘手问题[2-3]。由CRKP引起的感染是导致有多种合并症患者死亡的独立因素[4-5]。面对CRKP日益严峻的耐药形式,多黏菌素(polymyxin, POL)被重新考虑应用于临床抗感染治疗,并认为是治疗多重耐药革兰阴性菌引起感染的最后一道防线[6]。但是,随着POL的广泛使用,抗菌药物的选择压力导致细菌从敏感变为耐药,使细菌避免被POL杀死[7]。由于在具有相同遗传背景的细菌中,存在表现为对抗菌药物有较高耐药性的细菌亚群即异质性耐药菌株的存在,导致常规剂量的抗菌药物治疗失败,使患者错过最佳治疗时间,并进一步加剧抗菌药物的耐药性[8]。在实际临床工作中,临床医生更倾向于用联合治疗来发挥抗菌药物更好的抗菌效果。本实验旨在研究CRKP中对POL的异质性耐药程度,并确定POL与美罗培南(meropenem, MEM)联合应用在体外对存在异质性耐药的CRKP的抗菌活性,为临床联合用药抗感染提供实验依据。
1 材料与方法
1.1菌株来源 收集北京友谊医院2021年1月至12月临床分离的1 088株肺炎克雷伯菌,排除同一患者同一部位来源的重复菌株,经筛选获得肺炎克雷伯菌381株。所有菌株均由基质辅助激光解吸/电离飞行时间质谱系统鉴定为肺炎克雷伯菌。药物敏感试验质控菌株为大肠埃希菌ATCC 25922和肺炎克雷伯菌ATCC 13883,均购自卫生部临床检验中心。
1.2仪器和试剂 质谱仪(法国生物梅里埃公司),Mueller-Hinton(M-H)肉汤及哥伦比亚血琼脂培养基(英国Oxoid公司),POL(中国食品药品检定研究所),MEM(杭州默沙东制药有限公司),八通道微量移液器(德国Eppendorf公司)。
1.3药物敏感性试验 参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)操作规程[9],采用微量肉汤稀释法检测POL及MEM的最低抑菌浓度(minimal inhibitory concentration, MIC)。配制药物母液浓度5 120 μg/mL,倍比稀释为0.125~64 μg/mL的浓度梯度,依次取100 μL加入96孔板相应位置。新鲜培养的待测菌株及质控菌株配制成0.5麦氏浊度单位菌液,用阳离子校正M-H肉汤稀释20倍后加入96孔板,每孔加入10 μL,37 ℃温育16~18 h后读取MIC值,实验重复3次。根据欧洲抗微生物药物敏感性委员会(EUCAST)10.0版的折点[10]判断多黏菌素敏感性。
1.4群体谱分析(population analysis profiles, PAPs) 对POL MIC值0.25~2 μg/mL的CRKP进行POL的异质性耐药菌株筛选。配制2.5~320 μg/mL的POL溶液,与高压灭菌后的M-H琼脂混匀配制成浓度为0.125~16 μg/mL POL的M-H琼脂平板。将培养至对数期的CRKP调至0.5麦氏浊度单位,每个含药平板上用灭菌三角棒将50 μL菌液涂布均匀,干燥后35 ℃培养48 h后对生长20~200 CFU/mL的平板进行菌落计数。每株细菌重复实验3次,取3次结果的均值。在POL浓度≥2 μg/mL的M-H琼脂平板上有菌落生长,则判定该菌株为POL异质性耐药[11]。
1.5PCR扩增筛选耐药基因 筛选碳青霉烯酶编码基因blaKPC、blaNDM、blaVIM、blaIMP及blaOXA-48,特异性引物根据GenBank中基因序列设计[12],引物序列见表1。采用吸附柱法提取细菌DNA,反应体系包括:2×Taq PCR Master Mix 7.5 μL,ddH2O 4.5 μL,上、下游引物各0.75 μL,模板1.5 μL,共15 μL。反应条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,32次循环;再72 ℃延伸5 min。产物由北京安诺优达基因科技公司测序并与Gen-Bank数据库中序列进行比对,最终确认CRKP的耐药基因。

表1 CRKP耐药基因引物序列
1.6时间-杀菌曲线试验(time-kill study) 选取3株携带不同耐药基因的异质性耐药CRKP菌株进行杀菌曲线试验:blaKPC阳性BJFH54号菌株,blaNDM阳性BJFH67号菌株,blaKPC+blaNDM均阳性BJFH21号菌株。POL配制0.5MIC、1MIC浓度溶液,MEM配制0.25MIC、0.5MIC、1MIC浓度溶液,分别绘制每种药物每种浓度的时间-杀菌曲线。将POL和MEM配制成POL 0.5MIC+MEM 0.25MIC、POL 0.5MIC+MEM 0.5MIC、POL 0.5MIC+MEM 1MIC、POL 1MIC+MEM 0.25MIC、POL 1MIC+MEM 0.5MIC、POL 1MIC+MEM 1MIC共6种联合用药方案,绘制联合用药的时间-杀菌曲线。挑取新鲜培养的单个菌落溶于10 mL CAMHB肉汤中,37 ℃用摇床摇至生长对数期,将菌液转移至含有单药或不同浓度联合药物的10 mL CAMHB肉汤中,调至0.5麦氏浊度单位,37 ℃摇床摇菌,分别在0、1、2、4、8、12、24、48 h取样,稀释适当倍数后涂于M-H平板上,将细菌终浓度1×106CFU/mL的M-H肉汤作为生长对照,37 ℃温育24 h后计数菌落并绘制杀菌曲线。若培养24 h时的菌液浓度比初始菌液浓度减少≥3log10CFU/mL,则判断其有杀菌活性[13]。
2 结果
2.1药物敏感性 通过微量肉汤稀释法对381株CRKP检测POL及MEM的MIC值,根据CLSI M100推荐的MEM折点(MIC≤1 μg/mL为敏感,MIC≥4 μg/mL为耐药)判断,全部肺炎克雷伯菌MIC值均≥16 μg/mL,对MEM耐药。根据EUCAST 10.0版推荐的POL折点(MIC≤2 μg/mL为敏感,MIC>2 μg/mL为耐药)判断,未发现对POL耐药的菌株。
2.2PAPs 对POL MIC值在0.25 μg/mL、0.5 μg/mL、1 μg/mL及2 μg/mL的CRKP中,每个MIC值菌株中选取10株,共40株菌株进行群体谱分析,其中存在对POL异质性耐药的菌株38株(占95%)。
2.3耐药基因 对38株存在POL异质性耐药的CRKP进行耐药基因测序,比对结果显示,blaKPC阳性35株,blaNDM阳性6株,blaKPC+blaNDM均阳性3株。未检出blaVIM、blaIMP及blaOXA-48阳性菌株。
2.4时间-杀菌曲线 筛选3株异质性耐药CRKP菌株:blaKPC阳性BJFH54号菌株,blaNDM阳性BJFH67号菌株,blaKPC+blaNDM均阳性BJFH21号菌株进行试验。单独使用不同浓度POL及MEM对异质性耐药的CRKP时间-杀菌曲线如图1中A1-C1所示,与生长对照对比,低浓度单药会在细菌生长初期呈现下降趋势,生长12 h后,所有菌株均重新生长并超过其最初接种菌量。当单药药物浓度达到1 MIC浓度时,细菌初期的生长呈现快速下降,甚至在短时间内可达到杀菌效果,但生长12 h后细菌亦均出现重新生长现象。POL与MEM联合用药的情况下,所有组合的时间-杀菌曲线均呈现出协同作用,并能达到杀菌效果,如图1中A2-C2、A3-C3所示。BJFH54号菌株及BJFH67号菌株在所有联合用药的情况下均可在作用2 h后达到杀菌效果,而携带双耐药基因的BJFH21号菌株也可在4 h后达到杀菌效果。
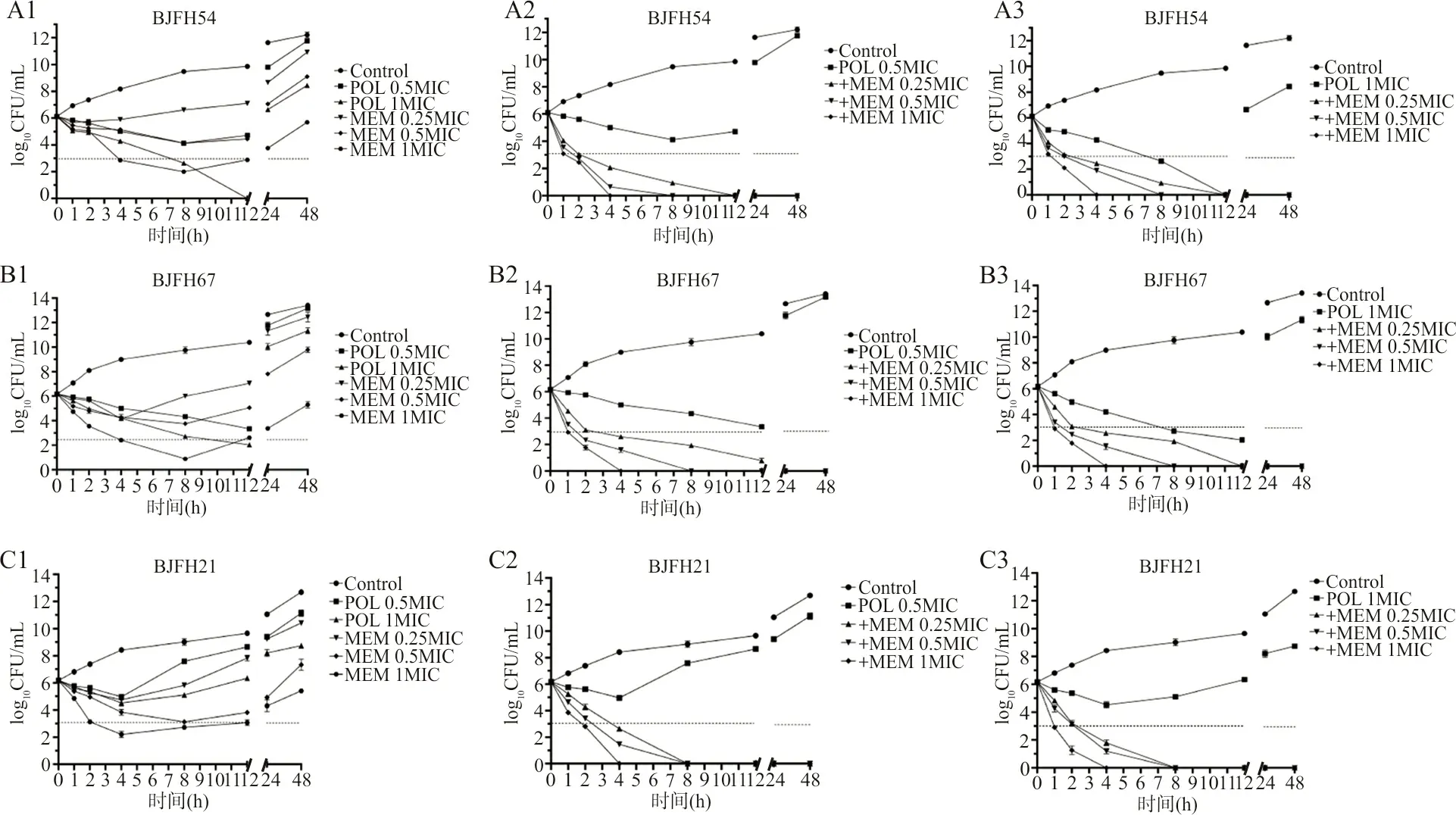
注:不同浓度多黏菌素及美罗培南单药时间-杀菌曲线(A1-C1),0.5MIC多黏菌素与不同浓度美罗培南联合应用的时间-杀菌曲线(A2-C2),1MIC多黏菌素与不同浓度美罗培南联合应用的时间-杀菌曲线(A3-C3)。
3 讨论
随着世界范围内抗菌药物的滥用,细菌耐药性不断增加,极大地增加了院内感染的治疗难度,而CRKP是其中重要的致病菌之一[14]。POL于20世纪40年代末开始被广泛使用,后因其高肾毒性而被限制[15]。由于多重耐药细菌比例日渐增高,POL对多重耐药菌表现出的强杀菌作用,使其成为目前最有效的抗感染药物之一,成为治疗CRKP的最后一道防线[16]。
异质性耐药是细菌耐药进化进程中的一种特殊形式,是在具有相同遗传背景的细菌中,存在表现对抗菌药物有较高的耐药性的细菌亚群[17]。实际临床工作中的常规药敏试验检测不到异质性耐药亚群菌株,需要采用PAPs进行检测[18]。本研究对381株CRKP进行了POL体外药敏试验,其敏感率高达100%。选取对POL不同MIC值的CRKP经过PAPs筛选后,发现对POL异质性耐药率高达95%,稍低于Tian等[19]的研究数据。研究显示,单独使用POL或MEM对异质性耐药菌株的体外效果不理想,即使在高浓度POL作用下早期出现杀菌效果,也会在培养24 h后出现细菌的重新生长,导致治疗失败[20]。说明POL治疗CRKP感染存在非常高的耐药风险,其异质性耐药的出现会导致临床治疗更为棘手,因此寻求合理用药方式,加强联合用药,避免POL作为抗感染最后一道防线治疗的失败。
联合用药能够缩短治疗周期,增加抗菌药物活性,是避免异质性耐药高发的一种有效手段[21]。目前尚少见联合用药治疗对多黏菌素异质性耐药CRKP的效果研究,本试验选取目前临床上常用抗菌药物之一的MEM,与POL联合用药是临床常用的抗菌药物组合,探讨联合用药对POL异质性耐药CRKP的体外抗菌效果。通过时间-杀菌曲线试验,相较于POL单独使用及MEM单独使用时的菌株生长只能被短时抑制,而在12 h后重新大量增殖的情况,POL联合MEM使用可使BJFH54(blaKPC阳性)、BJFH67(blaNDM阳性)在低浓度下(POL 0.5MIC+MEM 0.25MIC)作用2 h后达到杀菌效果,BJFH21(blaKPC+blaNDM均阳性)在低浓度下也可在4 h后达到杀菌效果,且杀菌效果可持续48 h,说明低浓度的POL与MEM联合应用即可对CRKP有很好的杀菌效果。其机制可能是POL破坏细菌细胞膜后增加MEM的杀菌效果,而MEM对blaVIM、blaIMP及blaOXA-48阳性菌株均有很好的体外杀菌效果。Soudeiha等[22]联合应用POL及MEM对鲍曼不动杆菌进行抑菌试验发现,2种药物的联合使用可使其MIC值较单独使用2种药物的MIC值下降2.6倍,具有很好的协同效果,与本试验的结果基本一致。
POL与MEM的联合用药在保证清除异质性耐药菌株的基础上,减少了单药的药物使用浓度,亦减少多黏菌素在高浓度下副作用的发生,为临床治疗提供了以POL为基础,联合美罗培南治疗CRKP的实验基础。尽管在本实验中,POL与MEM的联合应用对异质性耐药的CRKP表现出很好的杀菌效果,但是时间-杀菌曲线检测的是体外药敏效果,并不能准确反映人体内的抗菌活性,而且受限于试验菌株数量过少及认知水平的局限,对于联合用药治疗CRKP对POL异质性耐药方案需进一步深入研究,使其联合用药方案切实可行,成为治疗优选。

