慢性阻塞性肺疾病急性加重期谷胱甘肽过氧化酶、丙二醛、8-羟基脱氧鸟苷测定价值探讨
郑海茹,吴熊军,许文彬
(海南医学院第二附属医院,海南 海口 570311)
慢性阻塞性肺疾病(COPD)是持续气流受限的疾病,发病与粉尘颗粒及烟雾等因素有关[1]。当COPD稳定期患者受到诱发因素(病原体感染、饮食不当、吸入过敏原、气候改变等)刺激,可加重病情。COPD急性加重期(AECOPD)是COPD症状持续恶化,是导致呼吸功能衰竭及死亡的主要原因[2]。因此评估AECOPD患者病情严重程度及临床转归,并调整治疗方案以提升患者生存质量并改善预后,但目前尚无敏感生物标志物能辅助AECOPD严重程度进行分级[3]。研究证实,氧化应激参与AECOPD发生发展[4]。谷胱甘肽过氧化酶(GSH-PX)可清除机体产生的活性氧自由基,参与氧化应激反应[5];丙二醛(MDA)是醛类物质,可反映脂质过氧化而用于评估应激反应[6];8-羟基脱氧鸟苷(8-OHdG)是评价应激状态的敏感指标,对评估慢性炎症性疾病与氧化应激关系具有重要意义[7]。目前临床对GSH-PX、MDA、8-OHdG与AECOPD病情程度相关报道较少,因此本研究进一步分析,现报道如下。
1 资料与方法
1.1 一般资料选取2019年1月至2021年1月我院收治的128例AECOPD患者为观察组,纳入标准:①符合《AECOPD诊治指南》中AECOPD的诊断标准[8];②年龄40~82岁;③患者对研究内容知情同意。排除标准:①恶性肿瘤;②严重血液、内分泌系统疾病;③妊娠或哺乳期妇女;④肺间质纤维化、支气管哮喘等。选取同期100例健康体检者为对照组。根据SAPSⅡ评分系统将AECOPD患者分为轻度组(20~29分,n=42)、中度组(30~39分,n=46)及重度组(≥40分,n=40)。两组基线资料比较差异无统计学意义(P>0.05)。见表1。本研究经医院伦理委员会批准。
1.2 方法
1.2.1病情严重程度评估 采用简化急性生理学评分Ⅱ(SAPSⅡ)[9]评估,共17项,每项最低0分,最高26分,总分越高病情越重。
1.2.2外周血GSH-PX、MDA、8-OHdG水平测定 于入院当天抽取外周静脉血5 ml,3000 r/min下离心5 min,进行离心沉淀细胞,-70℃保存,比色法测定GSH-PX,硫代巴比妥酸法测定MDA,双抗夹心酶联免疫法检测8-OHdG水平。
1.2.3预后 采用电话、门诊行28 d随访,记录生存情况。
1.3 统计学方法采用SPSS 20.0软件处理数据。计量资料以均数±标准差表示,组间比较采用单因素方差分析及t检验;采用ROC曲线评价指标对AECOPD及预后的诊断价值;相关性分析采用Spearman分析。P<0.05为差异有统计学意义。
2 结果
2.1 观察组和对照组GSH-PX、MDA、8-OHdG水平比较观察组GSH-PX低于对照组,MDA、8-OHdG高于对照组(P<0.05)。见表2。

表2 观察组和对照组GSH-PX、MDA、8-OHdG水平比较
2.2 不同病情严重程度AECOPD患者GSH-PX、MDA、8-OHdG水平比较重度组GSH-PX低于中、轻度组,MDA、8-OHdG高于中、轻度组;中度组GSH-PX低于轻度组,MDA、8-OHdG高于轻度组(P<0.05)。见表3。

表3 不同病情严重程度AECOPD患者GSH-PX、MDA、8-OHdG水平比较
2.3 外周血GSH-PX、MDA、8-OHdG水平与AECOPD病情程度的相关性分析AECOPD病情严重程度与GSH-PX呈负相关,(r=-0.814,P<0.05),与MDA、8-OHdG呈正相关(r=0.877,r=0.769,P<0.05)。
2.4 外周血GSH-PX、MDA、8-OHdG水平诊断AECOPD效能分析ROC曲线显示,GSH-PX、MDA、8-OHdG联合预测AECOPD的灵敏度和AUC高于单独诊断(P<0.05)。见表4和图1。
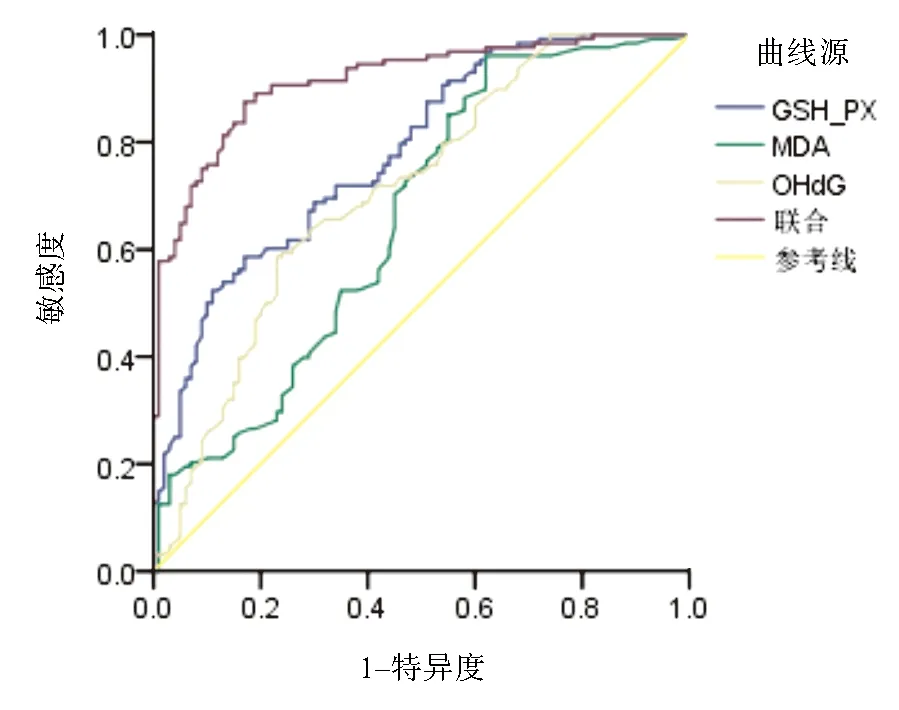
图1 GSH-PX、MDA、8-OHdG水平诊断AECOPD的ROC曲线
2.5 不同预后AECOPD患者GSH-PX、MDA、8-OHdG水平比较根据预后将患者分为存活组98例和死亡组30例,存活组GSH-PX水平高于死亡组,MDA、8-OHdG水平低于死亡组(P<0.05)。见表5。

表5 不同预后AECOPD患者GSH-PX、MDA、8-OHdG水平比较
2.6 GSH-PX、MDA、8-OHdG预测AECOPD预后效能分析ROC曲线显示,GSH-PX、MDA、8-OHdG联合预测AECOPD预后的敏感度为88.50%,AUC为0.863,高于单独检测(P<0.05)。见表6和图2。
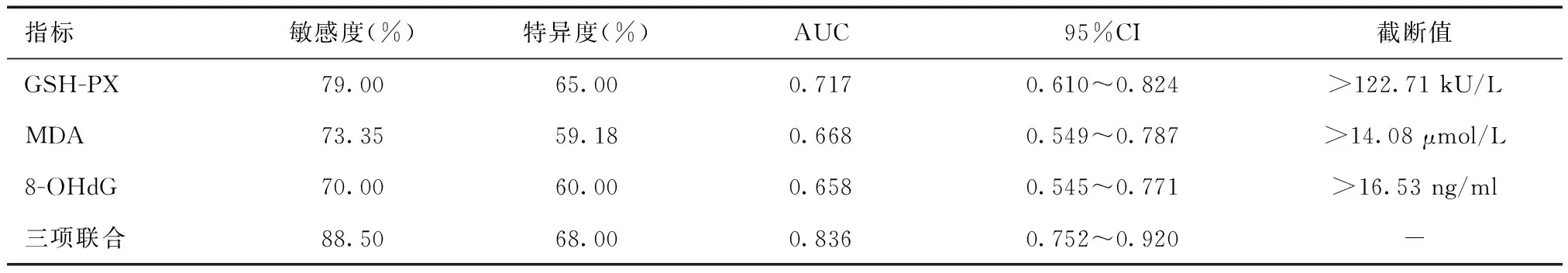
表6 GSH-PX、MDA、8-OHdG预测AECOPD预后效能分析
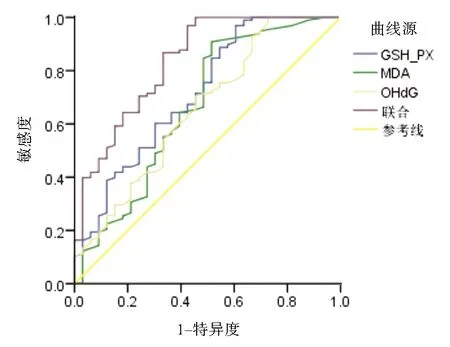
图2 GSH-PX、MDA、8-OHdG预测AECOPD预后ROC曲线
3 讨论
COPD发病率升高,趋向年轻化,据报道截止到2016年,全球约2.5亿COPD新发病例[10]。上呼吸道感染或其他因素可诱发AECOPD,加重缺氧、二氧化碳潴留,并发心力衰竭,故加强对AECOPD病情监测并进行及时有效的治疗至关重要[11]。
肺功能等级的评价主要取决于患者的配合程度,其波动较大,且在COPD急性加重期难以反映真实情况;一些评分系统如COPD评估试验评分和呼吸困难指数评分,由临床医师主导且评估的准确性取决于医生的主观性。因此,需要寻找具有高敏感性和特异性的客观生物标志物来评价AECOPD并确定预后成为临床研究的热点。近年来,研究指出,氧化应激参与AECOPD的发生、发展[12]。正常情况下,人体内会产生氧化物,且存在可去除氧化物的抗氧化酶系统,如过氧化氢酶、GSH-Px等,两者保持动态平衡状态。GSH-Px是抗过氧化能力指标,贮存在细胞的胞质和线粒体中,可清除体内过氧化氢和脂质过氧化物,防止细胞膜等生物组织受损。当其水平降低时可破坏抗氧化与氧化间的平衡,使氧化物不能有效清除,引起氧化应激反应,导致内皮细胞损伤,引起肺功能障碍[13,14]。MDA是脂质过氧化反应的标志物,可反映体内氧化应激水平,判断氧化损伤程度[15]。既往研究表明,COPD患者MDA升高,推测COPD患者体内存在氧化应激[16]。张锋等[17]研究表明,MDA与COPD病情相关。8-OHDG是DNA氧化损伤的修饰终产物,是将鸟嘌呤基的第8个碳原子与胸腺嘧啶基进行反向交换而生成的,在体内静态存在,在内、外源性因素作用下,机体产生活性氧自由基,可致DNA氧化性损伤[18,19]。结果显示,观察组GSH-PX水平较对照组低,MDA、8-OHdG水平较对照组高,与胡蝶等[20]研究结果一致,说明外周血GSH-PX、MDA、8-OHdG水平参与AECOPD的发生发展,分析原因为SH-PX水平下降及MDA、8-OHdG水平升高时氧化物可作用于细胞膜中的不饱和脂肪酸,促进脂质过氧化,损伤肺泡和间质肺皮质,致肺功能障碍,致使AECOPD发生[12,21]。同时本研究结果显示,重度组GSH-PX水平低于中、轻度组,MDA、8-OHdG水平高于中、轻度组,中度组GSH-PX水平低于轻度组,MDA、8-OHdG水平高于轻度组,且Spearman相关分析显示,AECOPD严重程度与GSH-PX和MDA、8-OHdG呈负相关和正相关,进一步证实了外周血GSH-PX、MDA、8-OHdG水平与AECOPD病情严重程度密切相关,GSH-PX水平随AECOPD严重程度的加重而降低,而MDA、8-OHdG水平随疾病严重程度的加重而升高,故临床应对上述指标进行监测,可为临床治疗提供一定参考。ROC曲线显示,GSH-PX、MDA、8-OHdG联合预测AECOPD的灵敏度为95.32%%、AUC为0.943,均高于单独诊断,说明外周血GSH-PX、MDA、8-OHdG水平联合预测AECOPD的价值较高,因此对COPD患者应进行上述指标的监测,并及时给予针对性干预,以降低AECOPD发生率。由于AECOPD导致全身炎症反应可累及脑血管及心脏等部位,导致死亡[22]。故为降低病死率,本研究对患者进行28 d的预后随访发现,AECOPD患者28 d死亡率为23.44%,并分析不同预后患者外周血GSH-PX、MDA、8-OHdG水平变化,结果显示,存活组GSH-PX水平高于死亡组,MDA、8-OHdG水平低于死亡组,提示高水平的和低水平的GSH-PX可导致预后不良,分析原因可能为:氧化物会破坏破坏肺组织中的弹性蛋白形成肺气肿,降低肺功能,增加预后风险[23]。ROC曲线显示,GSH-PX、MDA、8-OHdG联合预测AECOPD预后价值较高,临床可对AECOPD患者上述水平进行监测,并进行干预,以改善预后。
综上, 随AECOPD患者病情加重,外周血GSH-PX水平降低,而MDA、8-OHdG水平升高,且三者联合对预测AECOPD及预后价值较高,临床监测其水平,并予以干预,以降低AECOPD发生,改善预后。

