黄土高原不同种植年限苜蓿土壤固氮微生物群落结构和丰度特征*
王晓菲 ,罗珠珠,** ,李玲玲 ,牛伊宁 ,孙鹏洲 ,海龙 ,李林芝
(1. 甘肃农业大学资源与环境学院 兰州 730070;2. 省部共建干旱生境作物学国家重点实验室 兰州 730070)
氮(N)作为高等植物的必需营养元素,是蛋白质、核酸、生物碱等重要有机化合物的组分,在作物生长发育过程中发挥着不可替代的作用[1]。生物固氮是在固氮微生物的作用下将大气中的分子态氮还原成氨的过程,每年约有40~70 Tg N 通过该途径进入农业生态系统[2-3]。研究表明[4],生物固氮与固氮菌属(Aztobacer)、固氮弧菌属(Azohydromonas)、伯克氏菌属(Burkholderia)和固氮螺菌属(Azospirillum)等需氧或厌氧微生物息息相关。固氮微生物多样性和群落组成直接影响土壤氮循环与固氮速率,可用于衡量土壤质量状况[5]。固氮微生物中普遍存在着编码固氮酶铁蛋白的nifH基因,作为其遗传标记物,序列极度保守、系统发育树与16Sr RNA 具有高度的一致性[6],被广泛应用于土壤固氮菌群落组成的研究[7]。固氮微生物群落组成和多样性与作物类型[8]、土地利用方式[9]及土壤理化特性密切相关[10]。
紫花苜蓿(Medicago sativa)在汉代从西域引入我国,迄今已有2000 多年的种植栽培历史[11]。作为多年生优质豆科作物,紫花苜蓿由于营养物质丰富、抗逆性强、生态价值和经济价值兼具的特性[12],已然成为黄土高原半干旱区退耕还林(草)的首选草种。目前,仅甘肃省苜蓿种植面积已达74.67 万hm2,商品苜蓿产量达204 万t,位居全国首位[13]。然而,苜蓿持续多年种植后,严重消耗土壤水分和磷素[14-15],土壤生态环境恶化,最终使得土壤微生物类群发生改变。李裕元等[16]研究表明,紫花苜蓿草地生长盛期持续时间一般仅为3~5 年,到6~7 年之后草地产草量迅速下降,演化为自然植被;李玉山[17]研究表明,紫花苜蓿连续种植8 年后,产量和水分利用效率开始下降;万素梅等[18]研究发现,苜蓿生长超过6 年产量开始下降,而超过8 年后生长发生明显衰退;才璐等[19]通过Meta 分析发现,随苜蓿种植年限延长其产量和水分利用效率表现出先升后降的趋势,其中种植3~5 年苜蓿产量最高,而种植6~8 年苜蓿水分利用效率最高。
本试验前期先后开展了半干旱黄绵土区种植紫花苜蓿土壤水分和养分[20-21]的相关研究,也针对土壤微生物[14]进行了初步探索。不难发现,目前已有的研究大多聚焦于土壤细菌、真菌群落结构和多样性,如牟红霞等[22]对引黄灌区不同种植年限紫花苜蓿土壤真菌群落多样性特征研究发现,连种苜蓿会增加土壤中真菌菌群的多样性;马欣等[14]对黄土高原不同种植年限苜蓿土壤细菌群落结构和生态功能的研究发现,土壤细菌群落结构受种植作物的影响,长期种植苜蓿能够显著改变土壤细菌群落结构。对于固氮菌,李建宏等[5]研究发现,在草地退化过程中,土壤固氮菌丰度降低的同时也改变了土壤固氮菌的群落结构;陈燕霞等[23]研究发现,相比细菌和真菌,5 年生苜蓿地固氮菌数量在西辽河平原10~20 cm 土层中所占比例最大,而在0~10 cm、30~40 cm 土层中比例较少。但在黄绵土区,关注土壤固氮微生物群落结构和丰度的研究较少,且对于固氮菌群落内部的相互作用关系的研究处于空白,而土壤固氮菌数量和群落结构对土壤固氮速率和氮循环有直接的影响,可作为衡量土壤质量和草地退化程度的重要参考指标[5]。为此,本文运用Illumina MiSeq 高通量测序技术和荧光定量PCR 技术分析了土壤固氮微生物群落结构及丰度,并探讨了土壤固氮菌群落结构随苜蓿种植年限延长而发生的演替特征及其与土壤环境因子的关系,以揭示不同种植年限苜蓿土壤固氮能力及固氮微生物生态功能,从微生物视角来量化不同种植年限苜蓿土壤质量状况,为半干旱黄绵土区苜蓿人工草地的可持续利用和适宜种植年限的确定提供理论支撑。
1 材料与方法
1.1 研究区概况
试验设置在甘肃省定西市安定区李家堡镇甘肃农业大学旱作农业综合试验站(104°44′E,35°28′N),该区属于典型的半干旱雨养农业区,年均降水量和蒸发量约为390 mm 和1531 mm,年均太阳辐射592.9 kJ·cm-2,平均日照时数2476.6 h,年均气温6.4 ℃,无霜期141 d,供试土壤为黄绵土。
1.2 试验设计
试验以2019 年(种植年限为2 年,L2019)、2012年(种植年限为9 年,L2012)、2003 年(种植年限为18 年,L2003)建植的紫花苜蓿人工草地为研究对象,并以农田(farmland)为对照,农田种植当地主栽作物玉米,3 次重复,随机区组排列,小区面积均为3 m×7 m。紫花苜蓿品种为当地传统种植品种‘陇东苜蓿’,播量18 kg·hm-2,行距20 cm,草地建植时施纯氮105 kg·hm-2,P2O5105 kg·hm-2,之后在紫花苜蓿生长期间均未进行施肥。玉米参试品种为‘先玉335’,种植密度 5.25 万株·hm-2,施纯氮200 kg·hm-2,P2O5105 kg·hm-2。
1.3 土壤样品采集和理化指标的测定
1.3.1 样品采集
于2020 年6 月下旬,在紫花苜蓿头茬盛花期,在每个小区内均按五点取样法采集耕层土壤样品,剔除其中掺杂的石砾和植物残渣等杂物后,混匀后装入灭菌自封袋,干冰保存,迅速带回实验室。将土样分为3 部分,一份置于-80 ℃ 冰箱用于微生物群落结构的测定,一份置于4 ℃ 冰箱用于土壤硝态氮和铵态氮测定,另一份自然风干后过筛用于常规理化指标的测定。
1.3.2 测定项目及方法
测定方法均参照《土壤农化分析》[24],采用H2SO4-K2Cr2O7外加热(消煮温度为 180 ℃)法测定有机碳(OC);采用0.5 mol·L-1NaHCO3浸提-钼锑抗比色法测定速效磷;采用HClO4-H2SO4消煮-钼锑抗比色法测定全磷;采用凯氏定氮法测全氮;采用1.0 mol·L-1CH3COONH4浸提-火焰光度法测定速效钾;使用pH 计(液土比为5∶1)测定土壤pH;硝态氮(NO3--N)、铵态氮(NH4+-N)采用2.0 mol·L-1KCl浸提-全自动间断化学分析仪(Smart Chem 450,意大利)测定。
1.4 土壤总DNA 的提取和荧光定量PCR
土样总DNA 依照FAST DNA spin kit for soil(116560-200,MP Biomedicals)提取试剂盒提取,所提取的 DNA 纯度用1.0%琼脂糖凝胶电泳跑胶,再用凝胶成像仪(JY04S-3C,北京君意东方电泳设备有限公司)测定。荧光定量PCR:土壤微生物总DNA 提取后,利用目标基因引物进行PCR 扩增,PCR 仪为博日LineGene9600plus 型荧光定量PCR 仪,PCR 试剂为ChamQ SYBR Color qPCR Master Mix (2X)(南京诺唯赞生物科技有限公司),具体的引物序列及反应条件如表1 所示。反应体系:5 μL Ex Taq buf,4 μL dNTP Mix,0.5 μL Ex Taq,PrimerF、Primer R、Template 各1 μL,12.5 μL ddH2O。将PCR 产物用QuantiFluor™-ST蓝色荧光定量系统(Promega 公司,北京)进行定量检测,之后将每个样本按要求进行混合。利用聚合DNA 产物构建Miseq 文库,然后借助上海美吉生物医药科技公司高通量测序平台(Illumina Miseq PE300)测序,并参照Poly 方法[25]中的标准曲线计算nifH基因丰度,最终计算为每克干土的拷贝数。
1.5 高通量测序
功能基因数据库采用QIIME 平台 (http://qiime.org/scripts/assign_taxonomy.html)将获得的序列按最小样本序列数抽平后进行生物信息学分析。运用RDP classifier 算法(version 2.11 http://sourceforge.net/projects/rdp-classifier/)对97%相似水平下的所有序列的OTU 进行生物信息统计分析,默认置信度阈值为0.7[26],并基于NT (Nucleotide Sequence Database)数据库进行各样本在不同分类水平下的群落组成统计,比对方法:blast,默认e-value 值:1e-5。使用Mothur 软件(version v.1.30.2 http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity)进行多样性指数分析,以上过程均由上海美吉生物医药科技有限公司完成。
1.6 数据分析
土壤理化指标数据借助SPSS 21.0 和Excel 2019软件进行处理,利用单因素(ANOVA)方差分析和多重比较(LSD 法,P=0.05)进行差异显著性分析。固氮菌群落组成和多样性分析借助上海美吉公司ISanger 云平台进行,利用Canoco 5.0 软件对土壤固氮菌群落和理化因子进行冗余分析(RDA),用AI (Adobe Illustrator CS6)软件进行图表修饰。分子生态网络的构建是依赖于高通量测序所获得的OTU 进行的,为确保数据的真实性、可靠性,选择至少在8 个样本中出现的OTU 进行生态网络的构建。在R 平台中使用‘igraph’软件包进行相关性矩阵分析,并在Gephi(Version 0.9.2)软件中绘制网络图。其中,丰富物种定义为在单个样本中相对丰度>1%,在所有样本中平均相对丰度>0.1%的OTU。在单个样本中平均相对丰度<0.01%且在所有样本中平均相对丰度<0.001%的OTU 被定义为区域稀有物种[27]。选择至少在10个(80%)样本中检测到的 OTU 定义为核心物种。
2 结果与分析
2.1 土壤理化性质和固氮微生物nifH 基因丰度
由表2 可知,土壤容重、可溶性氮、速效钾和pH 各处理间均无显著差异;土壤有机碳、全氮和可溶性碳含量随着苜蓿种植年限的延长均呈增加趋势,其中 L2003处理土壤有机碳、可溶性碳含量显著增加(P<0.05),而L2012和 L2003处理土壤全氮含量显著增加(P<0.05);土壤全磷和硝态氮表现为苜蓿地显著低于玉米农田(P<0.05)。不同种植年限苜蓿地比较发现,随着苜蓿种植年限延长土壤全氮含量显著增加(P<0.05),土壤有机碳、可溶性碳和硝态氮含量表现为L2003处理显著高于L2012和L2019处理(P<0.05),土壤全磷含量表现为L2003处理显著低于L2012处理(P<0.05),铵态氮则表现为L2003处理显著低于L2012和L2019处理(P<0.05)。

表2 不同处理土壤理化性状和nifH 基因丰度Table 2 Soil physicochemical properties and nifH gene abundance under different treatments
黄绵土固氮微生物nifH基因丰度范围为2.97×106~5.93×106copies·g-1(干土)。与玉米农田相比,苜蓿地土壤固氮菌nifH基因丰度均显著增加(P<0.05),L2019、L2012和L2003处理土壤nifH基因丰度分别增加75.4%、53.0%和99.5%。不同种植年限苜蓿地表现为L2012处理显著低于L2003处理(P<0.05)(表2)。土壤固氮菌nifH基因丰度与理化因子相关分析表明(表3),土壤nifH基因丰度与容重(P=0.009)和可溶性碳含量(P=0.005)呈极显著正相关,与全氮(P=0.044)和速效钾含量(P=0.013)呈显著正相关,与全磷含量(P=0.000)呈极显著负相关,与硝态氮含量(P=0.023)呈显著负相关关系。

表3 土壤固氮菌nifH 基因丰度与土壤理化性状的相关系数Table 3 Correlation coefficients between nitrogen-fixing bacteria nifH gene abundance and soil physicochemical properties
2.2 土壤固氮微生物群落多样性
土壤固氮菌群落多样性分析结果如图1 所示。其中Sobs 指数(图1A)和Shannon 指数(图1D)表现为不同种植年限苜蓿地均低于玉米农田,Chao 指数(图1B)表现为L2012和L2003处理高于玉米农田,Simpson指数(图1C)表现为不同种植年限苜蓿地均高于玉米农田,但各指数在处理间均无显著差异。研究同时发现,随着苜蓿种植年限的延长,土壤固氮菌Sobs指数、Chao 指数和Shannon 指数逐渐升高,Simpson指数表现为先降低后升高趋势。
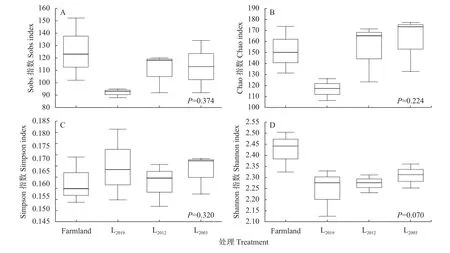
图1 不同处理土壤固氮微生物Alpha 多样性Fig.1 Alpha diversity of soil nitrogen-fixing microbial communities under different treatments
基于OTU 水平对土壤样本进行NMDS 分析(图2),发现应力函数值(Stress)小于0.1,说明NMDS 分析排序较好,可较准确地反映样本点的真实分布。玉米农田与苜蓿土壤样本点呈交叉分布。进一步采用基于距离矩阵的Adonis 检验发现,4 个处理总体组间固氮菌群落构成存在显著差异(P<0.05),但处理间两两差异不显著。
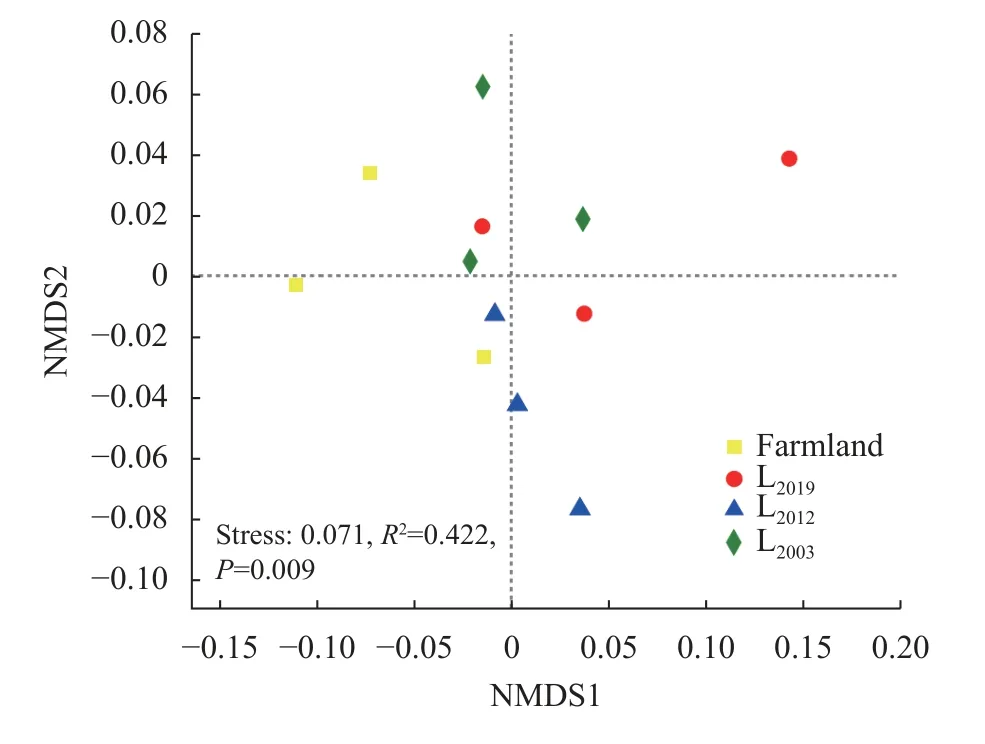
图2 不同处理土壤固氮菌非度量多维尺度分析Fig.2 Nonmetric multidimensional scale analysis of soil nitrogen-fixing microbial communities under different treatments
2.3 土壤固氮微生物群落结构
本研究土壤样品经测序共获得有效序列176 367条,按最小样本序列数抽平后进行OTU 划分和物种注释,共获得698 个OTUs,主要分布在5 门、8 纲、11 个目、15 科、17 属。门分类水平(图3A),黄绵土分类不明确物种(Unclassified)较少,仅占总序列的0.8%~1.8%;已注释的固氮微生物为变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria),其中变形菌门和蓝藻门为优势类群,相对丰度分别为95.9%~98.9%和0.2%~1.8%。疣微菌门(0.03%)为玉米农田土壤特有群落,而放线菌门(0.02%)为苜蓿地土壤特有群落。与玉米农田相比,苜蓿地土壤变形菌门相对丰度显著升高(P<0.05),厚壁菌门相对丰度显著降低(P<0.05);蓝藻门表现为苜蓿地低于玉米农田,但处理间差异不显著。随着苜蓿种植年限的延长,苜蓿地土壤变形菌门和厚壁菌门相对丰度呈先升后降趋势,而蓝藻门表现为先降后升趋势,但差异均不显著。
属水平上,已注释的固氮微生物有17 属,占总序列的86.1%~92.8%,未明确分类物种占7.0%~13.9%,这说明黄绵土中仍蕴藏着一些未知的固氮微生物资源,有待进一步挖掘研究(图3B)。斯克尔曼氏菌属(Skermanella)和固氮弧菌属为土壤主要优势属,相对丰度分别为82.2%~87.6%和1.6%~4.6%。与玉米农田相比,苜蓿地土壤斯克尔曼氏菌属相对丰度显著升高(P<0.05),鱼腥藻属(Anabaena)和类芽孢杆菌属(Paenibacillus)相对丰度显著降低(P<0.05)。随着苜蓿种植年限的延长,苜蓿地土壤斯克尔曼氏菌属相对丰度逐渐降低,且L2003处理显著低于L2012和L2019处理(P<0.05);鱼腥藻属相对丰度呈先降后升趋势,类芽孢杆菌属相对丰度为先升后降,但各处理间差异不显著。此外,本研究还发现长期种植苜蓿后土壤促生了一些特有固氮菌群落,同时也使得另外一些固氮菌群消亡,比如固氮菌属、伯克氏菌属、弗兰克氏菌属(Frankia)、中慢生根瘤菌属(Mesorhizobium)、地杆菌属(Geobacter)和慢生根瘤菌属(Bradyrhizobium)仅在苜蓿地土壤检测到,而在玉米农田土壤并未检测到;梭状杆菌属(Clostridium)、红假单胞菌属(Rhodopseudomonas)和三离藻属(Trichormus)仅在玉米农田土壤中检测到,而在苜蓿地土壤均未检测到。

图3 不同处理土壤固氮微生物群落组成(门和属水平)Fig.3 Soil nitrogen-fixing microbial community composition at the phylum and genus levels under different treatments
2.4 土壤固氮微生物丰富类群和稀有类群分布特征
土壤微生物群落物种丰度作为度量标准仍存在一些不足,一些稀有物种也扮演着生态系统核心物种的角色,其可能会在生物地球化学循环过程中发挥关键作用。为此,本研究进一步分析了土壤固氮微生物丰富类群、稀有类群和核心类群之间的关系。玉米农田和苜蓿地土壤固氮微生物网络中共包括520 个节点(OTUs)、4170 条边(图4A)。其中有24个节点属于丰富类群,93 个节点属于稀有类群,403个节点属于过渡类群。丰富类群内部连接1 条,过渡类群内部连接2187 条,稀有类群内部连接 358 条。丰富类群和稀有类群无连接,而丰富类群、稀有类群和过渡类群间均有连接,共1624 条,这说明稀有类群和丰富类群不易共存,而过渡类群与丰富或稀有群落之间的物质传递、信息交流则比较多。同时发现,有24 个OTUs (4.4%)为核心类群,其内部连接为2 条;496 个OTUs (95.6%)为非核心类群,其内部连接为4167 条;核心类群与非核心类群间仅有一条连接(图4B)。在核心类群子网络共有24 个节点(OTUs),发现其中18 个节点为丰富类群,6 个节点为过渡类群,没有发现稀有类群,且几乎所有的丰富类群及丰富类群内部的连接都存在于这个核心网络中(图4C)。丰富类群内部连接为9 条,丰富类群与过渡类群之间的连线为5 条。
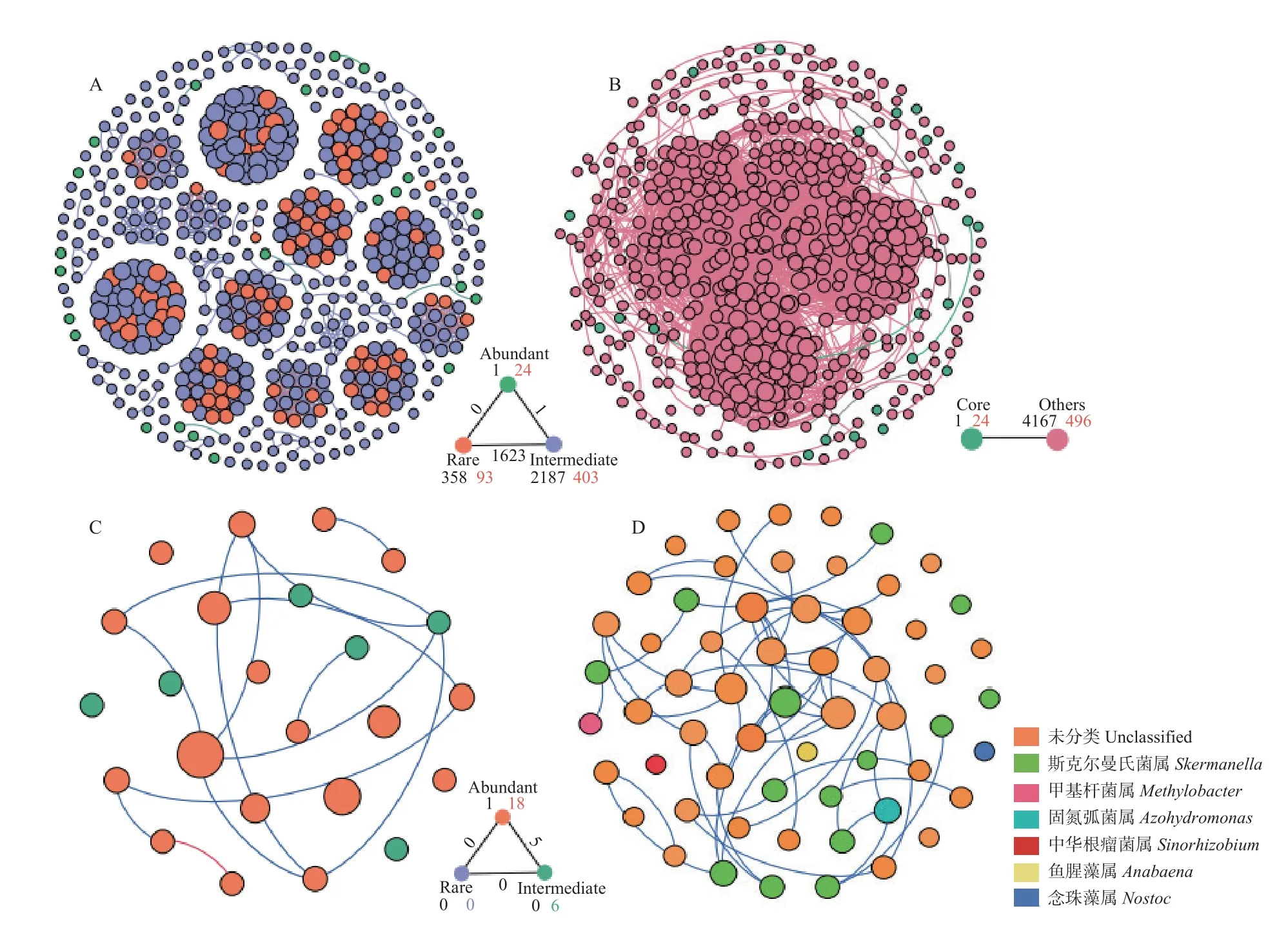
图4 土壤固氮微生物共生网络分析Fig.4 Symbiosis network analysis of nitrogen-fixing microorganisms
进一步对土壤nifH固氮菌属(genus)水平着色(图4D)发现,生态网络共有59 个节点,涉及斯克尔曼氏菌属(23.7%)、固氮弧菌属(1.7%)、甲基杆菌属(1.7%)、念珠藻属(1.7%)、鱼腥藻属(1.7%)、中华根瘤菌属(1.7%)和未分类物种(67.8%),其中斯克尔曼氏菌属占据14 个节点,未分类物种占据40 个节点,其余类群各占据1 个节点。网络中52 条边的连接均为正连接,表明固氮菌生态网络中均为正相互作用。
2.5 土壤固氮微生物群落结构与理化因子的关系
RDA 分析结果表明(图5),第1 轴(RDA1)和第2 轴(RDA2)分别解释了30.09%和27.32%的样本变异,累积解释变异量为57.41%。鱼腥藻属(Anabaena)、类芽孢杆菌属(Paenibacillus)、中华根瘤菌属(Sinorhizobium)与全磷、可溶性氮含量呈正相关关系;念珠藻属(Nostoc)、梭状杆菌属(Clostridium)、三离藻属(Trichormus)、红假单胞菌属(Rhodopseudomonas)与硝态氮含量呈正相关关系;甲基杆菌属(Methylobacter)、红微菌属(Rhodomicrobium)、弗兰克氏菌属(Frankia)、地杆菌属(Geobacter)与速效钾、有机碳、容重、可溶性碳、全氮含量呈正相关关系;斯克尔曼氏菌属(Skermanella)、中慢生根瘤菌属(Mesorhizobium)、固氮弧菌属(Azohydromonas)、伯克氏菌属(Burkholderia)、固氮菌属(Azotobacter)、慢生根瘤菌属(Bradyrhizobium)与pH、铵态氮含量呈正相关关系。由此可见,固氮微生物不同种群对环境因子的响应并不一致,具有各自的生态位。进一步通过Monte Carlo 检验表明,全磷(P=0.014)含量是影响玉米农田及苜蓿地土壤固氮微生物群落结构最主要环境因子,其次为有机碳(P=0.036)和硝态氮(P=0.020)。
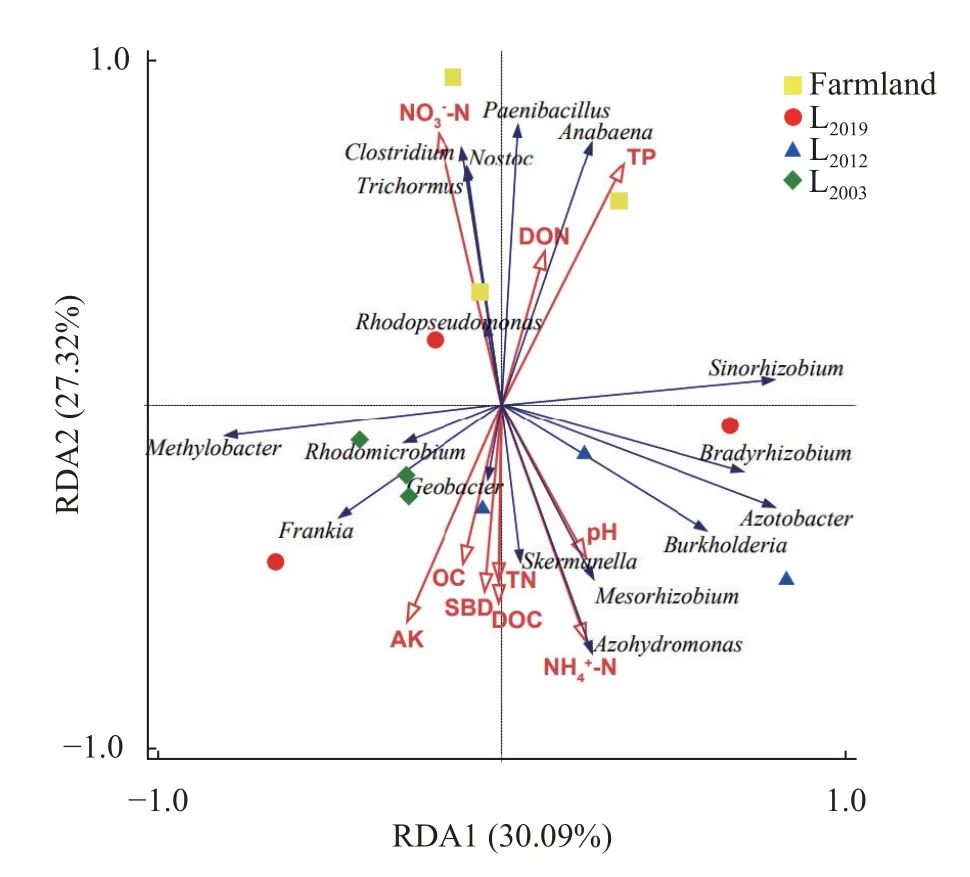
图5 土壤固氮微生物群落与土壤理化因子冗余分析Fig.5 Redundancy analysis of soil nitrogen-fixing microbial community structure at the genus level and soil physicochemical properties
3 讨论和结论
3.1 讨论
固氮菌是土壤微生物中具有特殊功能的类群,可在固氮酶的作用下将大气中的分子态氮还原为可被作物吸收和利用的化合态氮[5],直接影响土壤固氮效率和氮素循环的正常运转[28],研究其功能基因-nifH基因将有助于揭示其功能微生物在生物地球化学循环中的作用。大量研究表明,土壤有机碳[29]、氮[30]和根系分泌物[31]是影响nifH基因丰度的主要因素。本研究发现,不同种植年限苜蓿地土壤固氮菌nifH基因丰度均显著高于农田,因为生物固氮是一个极耗能的过程,是一个需要较多碳源的过程[32],微生物固氮所需能量主要来源于土壤有机碳,每固定1 分子氮至少需要16 个ATP[32]。可见,土壤碳源有效性及其组成是影响土壤微生物活性的关键,充足的土壤有效碳源可为生物固氮过程提供能源,促进固氮微生物固氮基因nifH表达[33]。本试验种植苜蓿提高了土壤有机碳和可溶性碳含量也从侧面印证了这一结论。Coelho等[34]研究认为,土壤氮含量增加将导致nifH基因丰度降低;然而 Juraeva等[30]研究认为,nifH基因丰度随土壤氮含量增加而增加。苜蓿土壤固氮细菌nifH基因丰度显著高于玉米农田,也就意味着苜蓿土壤比玉米农田土壤可以固定更多的氮,本试验苜蓿地只在建植初期施肥,之后生长期均未施肥,但其土壤全氮水平明显高于玉米农田土壤,这是苜蓿地土壤固氮能力增强的体现。值得注意的是,本研究发现nifH基因丰度与硝态氮含量呈负相关,这主要是因为土壤中高浓度的无机态氮素对固氮菌生长反而具有抑制作用[35]。关于土壤磷素对土壤nifH基因丰度影响研究相对罕见,前人在林地土壤的研究发现,毛竹(Phyllostachys pubescens)林土壤全磷和有效磷[36]含量低于阔叶林,但其土壤固氮细菌nifH基因丰度高于阔叶林,这与本研究中土壤磷素和nifH基因丰度呈负相关的结论基本一致,可能与低磷环境中植物产生的根系分泌物有关[37]。
无论农业、草地还是森林土壤,变形菌门都是土壤固氮菌群落的优势类群[38]。本研究中玉米农田与苜蓿地土壤固氮微生物的群落组成亦均以变形菌门为优势菌门,且种植苜蓿提高了土壤变形菌门的相对丰度,因为变形菌门细胞壁较厚,更能抵抗水分胁迫,在受到干旱胁迫后会明显富集,抗旱能力极强[39],而紫花苜蓿根系发达,在生长过程中蒸散强烈、耗水量高[20],苜蓿对土壤水分的消耗反而促进了土壤变形菌门的富集。随着苜蓿种植年限的延长,全磷含量表现为先升高后降低的趋势,与变形菌门相对丰度的变化趋势一致,进一步说明全磷含量是影响变形菌门丰度变化的限制性因素,这也与刘洋等[40]对黄土高原土壤微生物的研究结果相吻合。本研究同时发现,种植苜蓿降低了蓝藻门相对丰度,由于蓝藻门适宜存活在水生环境或湿润环境中[10],本研究农田玉米种植采用全地膜覆盖双垄沟播种技术,保墒蓄墒、就地入渗,良好的土壤环境有利于蓝藻门的繁殖。另外,本试验农田玉米地在播种时一次性施入氮肥和磷肥,而苜蓿地只在建植初期施肥,生长后期均未施肥,而Li等[41]发现施用氮肥会提高蓝藻门的丰度并降低变形菌门的丰度,这与本研究的结论基本一致。种植苜蓿显著降低了厚壁菌门的相对丰度,这归因于苜蓿地较高的土壤有机碳和较低的硝态氮含量,因为厚壁菌门与土壤有机碳呈负相关[42],且硝态氮对厚壁菌门活性有调节作用[43]。
在属水平上,斯克尔曼氏菌属为黄绵土区第一大优势属。斯克尔曼氏菌属为革兰氏染色阴性菌,隶属于变形杆菌门,有鞭毛、好氧,但目前发现的斯克尔曼氏菌属没有固氮能力[44]。苜蓿地土壤类芽孢杆菌属相对丰度显著低于玉米农田,是因为该属目前包括200 多种兼性厌氧菌[45],兼性固氮菌的生长更多地依赖于来自土壤和肥料的资源,苜蓿草地在整个生长期未施肥,不利于该菌属的生长[46]。此外,类芽孢杆菌在苜蓿土壤中丰度较低,是由于种植作物的差异,不同作物的根系分泌物具有异质性,直接或间接影响了微生物的代谢活动和群落组成[47]。与玉米农田相比,L2012和L2003苜蓿地土壤鱼腥藻属相对丰度显著降低。鱼腥藻属是具有异形胞的固氮蓝藻,氮磷比的变化会影响藻类的群落组成[48],L2012和L2003苜蓿土壤全磷含量显著低于玉米农田,全氮含量显著高于玉米农田,氮磷比相对较高,表明鱼腥藻属更适宜于存活在氮磷比低的环境中。此外,本研究还发现长期种植苜蓿后土壤促生了一些特有固氮微生物群落,同时也使得另外一些固氮菌群消亡,比如固氮菌属、伯克氏菌属、弗兰克氏菌属、中慢生根瘤菌属、地杆菌属和慢生根瘤菌属仅能在苜蓿地土壤检测到,而在玉米农田并未检测到;梭状杆菌属、红假单胞菌属和三离藻属仅能在玉米农田土壤中检测到,而在苜蓿地土壤均未检测到。Fan等[46]研究发现,施肥会使氮固定的基本过程和一些重要的固氮微生物受到抑制。比如地杆菌属隶属Delta-变形菌纲,常被归类为寡营养类群,这类土壤微生物的生长在施肥的农田土壤环境中受到抑制,由于该类群具有较低的下调固氮的能力,因此在高氮条件下易被其他类群打败,但在低营养条件下却极具竞争力[46]。慢生根瘤菌属为共生固氮菌,苜蓿与根瘤菌的共生固氮体系为该菌属创造了良好的生存环境。弗兰克氏菌属是一类能与非豆科作物共生形成根瘤并实现生物固氮的放线菌,其独特的泡囊结构能与放线菌结瘤植物进行共生固氮[49]。梭状杆菌属、红假单胞菌属和三离藻属仅分布在玉米农田土壤,很大程度上是因为它们主要是通过施肥消耗土壤资源来支持自身的营养生长,而不是固氮,玉米农田施氮缓解了作物的氮限制,提高了环境中氮的有效性,这在很大程度上降低了作物对固氮类微生物的依赖[50]。
一个生态系统或局域群落中的微生物多样性,在多数情况下的丰度分布模式都是不均衡的,常表现为种类相对较少的高丰度优势类群与种类相对较多的大量低丰度稀有类群共存[51]。丰富物种生长活跃,执行着大部分生态系统功能(包括呼吸、代谢潜能、细胞产量);相反,稀有物种生长极慢,影响相对窄的功能测度(比如群落降解某些特定基质的能力)。分子生态网络分析方法打破了在物种数量和多样性上对微生物群落研究的局限,能够直观地展现土壤微生物物种之间复杂的互作关系以及微生物对土壤环境变化的响应,从而揭示微生物的互作机制及影响因素[52]。土壤微生物不同物种间存在复杂的相互作用关系,包括维持微生物群落稳定性的对抗关系和互利关系。本研究土壤固氮微生物核心类群子网络以丰富类群和过渡类群为主,没有发现稀有物种的存在,说明处于核心生态地位的是丰富类群,其在土壤生态系统物质、能量和信息的交换过程中具有更加关键的作用。生态网络中的正、负相关性可用来推断微生物物种之间的互作关系,其中正相关代表物种之间生态位一致或者协同合作关系,负相关则代表竞争或捕食关系[53]。本研究中土壤固氮微生物生态网络中均为正相关,表明土壤环境中固氮菌群落之间以协同合作关系占优势,物种之间可以共建生物膜或交换代谢产物,土壤固氮微生物群落相对稳定。
3.2 结论
半干旱黄绵土区种植苜蓿显著提高了土壤碳、氮固持能力,且随着种植年限的延长效果越好,但同时也使得土壤磷素亏缺。种植苜蓿显著提高了土壤固氮微生物nifH基因丰度,改变了土壤固氮微生物nifH群落结构。土壤已注释出的固氮菌群落以变形菌门和蓝藻门为优势门,优势属为斯克尔曼氏菌属和固氮弧菌属。固氮微生物不同种群对环境因子的响应并不一致,具有各自的生态位,其群落结构的改变与土壤全磷、有机碳和硝态氮的变化密切相关。与农田相比,长期种植苜蓿后土壤促生了固氮菌属、伯克氏菌属、弗兰克氏菌属、中慢生根瘤菌属、地杆菌属和慢生根瘤菌属等类群,同时也使得一些固氮菌群消亡,比如梭状杆菌属、红假单胞菌属和三离藻属。分子生态网络分析表明,丰富类群而非稀有类群占据生态系统核心地位,且固氮微生物类群间均为协同合作关系,群落结构相对稳定,对环境变化有较强的适应能力。此外,本研究中约有15%的物种无法注释,表明还有一些未知的固氮微生物资源有待挖掘,在今后的研究中有必要优化测序方法和深度,丰富高通量测序对比文库的基础数据,提高分类的准确度,深入探索黄绵土区土壤固氮微生物的群落特征、生态功能及物种间的互作关系。
——固氮微生物

