生物有机肥配施化肥对生菜生长和土壤环境的影响*
张庆 ,胡春胜** ,刘彬彬 ,张玉铭 ,董文旭 ,李晓欣 ,刘秀萍,王晶,张睿媛,吴坤燕,吴洁,3
(1. 中国科学院遗传与发育生物学研究所农业资源研究中心/中国科学院农业水资源重点实验室/河北省土壤生态学重点实验室 石家庄 050022;2. 中国科学院大学 北京 100049;3. 河北科技大学经济管理学院 石家庄 050018)
化肥投入有效提高了蔬菜产量,但长期单一施肥和过量施肥不仅降低了蔬菜产出投入比和品质,而且加剧了土壤环境退化、温室气体排放、氨挥发以及硝酸盐污染等环境问题[1-2]。此外,来自种植业、养殖业、中药业、城市污泥、厨余垃圾等的有机废弃物数量庞大,无法从源头上有效控制,堆置、填埋、焚烧等传统处理方式不仅污染环境而且浪费潜在资源[3-4]。如何优化施肥以在减少化肥投入的同时维持或提高蔬菜产量和品质,如何减轻化肥和有机废弃物对环境的污染并促进废弃物资源化,成为构建绿色蔬菜产业和实现可持续发展战略所要面对的重大课题。以有机肥和生物有机肥为代表的新型肥料不仅在废弃物资源化、化肥减施以及土壤环境和作物品质改良等方面表现出巨大潜力,而且有利于缓解化肥生产和使用过程以及有机废弃物不合理处理带来的污染[5-6]。其中,生物有机肥不仅具备有机肥养分全、肥效长的优势[7],而且兼具功能菌剂的土壤改良和植物促生功效[8],因此成为近些年的研究热点。大量研究表明生物有机肥能够改善土壤养分和微生物群落[9-10],抑制植物病害[11],促进植物生长并提高产量和品质[12]。
生物有机肥富含有机质,能够有效提高土壤有机质含量,改善土壤物理、化学和生物性质,其所含植物促生菌以有机质为载体在土壤中能够维持较高活力,可通过调控土壤微生物多样性、促进土壤有机质分解和养分转化、抑制病原菌或病虫害或者直接作用于植物等途径进而发挥土壤改良和植物促生功效。地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、巨大芽孢杆菌(B.megaterium)作为常见的植物促生菌,在土壤改良和植物促生方面表现出巨大的潜力[13-14],是生物有机肥产业的优质微生物资源。以往关于芽孢杆菌生物有机肥促生或生防方面的研究所使用的生物有机肥一般是多种芽孢杆菌混合接种型,或者单一芽孢杆菌与植物秸秆、畜禽废弃物组合而成的单菌剂接种型。有关单菌剂接种型芽孢杆菌中药渣生物有机肥配施化肥在土壤改良和植物促生效果以及效果差异方面的报道比较少,因此有待进一步研究。
生菜(Lactuca sativavar.ramosa)富含维生素和矿物质以及膳食纤维,对人体的肠胃蠕动、机体免疫和血液循环都能够起到促进作用[15],且其生育期较短,生物量适中,适合做盆栽试验研究。为了探究3种芽孢杆菌单菌剂接种型中药渣生物有机肥配施化肥在土壤改良和植物促生方面的效果和差异,本研究以地衣芽孢杆菌、解淀粉芽孢杆菌和巨大芽孢杆菌中药渣生物有机肥为供试生物有机肥,以中药渣有机肥为供试有机肥,以生菜为供试植物,开展温室盆栽试验,探究生物有机肥配施化肥对生菜生长和土壤环境的影响。该研究有利于推动化肥减施、优化施肥和废弃物资源化,对蔬菜和生物有机肥产业发展以及绿色可持续发展具有重要意义。
1 材料与方法
1.1 试验材料与试验地点
供试有机肥为中药渣有机肥,购自河北神威药业集团有限公司,含有机质218.1 g·kg-1、全氮19.2 g·kg-1、全磷19.4 g·kg-1、全钾24.2 g·kg-1,供试化肥为尿素。生物有机肥所用菌种为地衣芽孢杆菌(B1)、解淀粉芽孢杆菌(B2)和巨大芽孢杆菌(B4),其中B1(ATCC11946)购自美国模式菌种保藏中心,B2(CICC10075)和B4 (CICC20665)购自中国工业微生物保藏管理中心。3 种供试生物有机肥通过分别向中药渣有机肥接种B1、B2、B4 单菌剂后经二次固体发酵制得。供试作物选用半结球生菜(‘耐抽薹402’)。供试土壤取自中国科学院栾城农业生态系统试验站(37°53′N,114°41′E;海拔50.1 m),为砂壤质潮褐土,含有机质20.2 g·kg-1、总氮1.3 g·kg-1、总磷0.8 g·kg-1、总钾0.8 g·kg-1、硝态氮20.12 mg·kg-1、铵态氮0.38 mg·kg-1、碱解氮117.54 mg·kg-1、有效磷6.76 mg·kg-1、速效钾193.93 mg·kg-1,pH 8.02。试验用盆高20 cm,下径15 cm,上径20 cm。盆栽试验于中国科学院遗传与发育生物学研究所农业资源研究中心温室开展,试验地地处华北平原,气候为暖温带半湿润季风气候。
1.2 生物有机肥配制
分别对B1、B2 和B4 进行复活、纯化和扩繁,使用紫外分光光度计在600 nm 波长下测定扩繁后菌液OD 值,按照1 个OD600 单位约相当于8×108cfu粗略估计菌液中活菌数量。将B1、B2、B4 以菌悬液形式分别接种到中药渣有机肥中,接种量分别为5.03×109cfu·g-1、1.89×109cfu·g-1和0.98×109cfu·g-1(以有机肥烘干基重计)。将3 种接种后的有机肥菌剂复合物调节到烘干基重量含水量约为40%,然后置于无菌培养箱(30 ℃,避光,静置)中进行二次固体发酵。培养期间不再测定含水量,使用无菌水调节水分,每次调至用手抓起时能捏成团块但落下时能自行散开的状态即可,连续培养7 d。培养结束后即得试验用地衣芽孢杆菌生物有机肥、解淀粉芽孢杆菌生物有机肥、巨大芽孢杆菌生物有机肥。
1.3 试验设计与处理
采用随机区组布置盆栽试验,试验周期为2021年8-11 月。控制各施肥处理的施氮量一致,设置地衣芽孢杆菌+中药渣有机肥+化肥(B1H)、解淀粉芽孢杆菌+中药渣有机肥+化肥(B2H)、巨大芽孢杆菌+中药渣有机肥+化肥(B4H)、中药渣有机肥+化肥(H)、单施化肥(CF)和不施肥(CK)共计6 个处理,每个处理设3 个重复。5 个施肥处理的氮总施入量均为0.25 g·kg-1(以烘干基计)。其中,B1H、B2H和B4H 所施入的生物有机肥氮量与尿素氮量的比值以及H 所施入的有机肥态氮量与尿素态氮量的比值均为4∶1。每个花盆装土约4 kg (以烘干基计),播种前一次性施肥,所有肥料与盆土混合均匀。施肥后马上播种,播种后第30 天间苗,每盆留3 株幼苗继续培养,根据生菜生长情况每天或隔天等量适量补充自来水,温室内温度控制在20~30 ℃,光照采用自然光。
1.4 样品采集与分析
于收获期(播种后90 d)从每个处理中选择长势均匀的生菜3 株测定鲜重、品质和生理指标;从每个处理中选择长势均匀的生菜3 株取生菜非根际土做土壤理化分析,取非根际土和根际土做细菌多样性分析,每个处理测定3 个重复。
从盆栽中取出生菜地下部,充分抖落根系周围的土粒,将根系浸入装有30 mL PBS 缓冲液的50 mL离心管中振荡1 min,然后将离心管置于离心机在4 ℃和8000×g 转速下离心30 min,弃掉上清,沉淀即为生菜根际土,将其保存于-80 ℃待用。
分别采用油浴-K2Cr2O7法、开氏定氮法、紫外分光光度法和火焰光度法测定有机肥有机质、全氮、全磷和全钾含量;使用pH 计测定土壤pH;分别采用油浴-K2Cr2O7法、蒸馏水浸提法、碱融法、碱解扩散法、碳酸氢钠浸提法、乙酸铵浸提法、硫酸钾浸提法、硫酸钾浸提-氯仿熏蒸法测定土壤总有机碳、水溶性有机碳、总磷和总钾、碱解氮、有效磷、速效钾、硝态氮和铵态氮、微生物量碳氮。生菜叶绿素含量的测定使用叶绿素仪SPAD-502,维生素C、可溶性糖和硝酸盐含量的测定分别采用2,6-二氯靛酚滴定法、蒽酮比色法和紫外分光光度法。
使用 OMEGA M5636-02 土壤 DNA 试剂盒(OMEGA Bio-Tek,Norcross,GA,USA)提取土壤样品总DNA 样本。采用正向引物338F (5′-ACTCCTACGGGAGGCAGCA-3′)和反向引物806R (5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA 基因V3-V4(a)区进行PCR 扩增。使用上海派森诺生物科技有限公司的Illumina NovaSeq 平台对DNA 扩增样本进行双端测序。依托QIIME 2 (2019.4)平台处理测序下机数据:使用DADA2 方法质控得到细菌特征序列;选用Silva_132 数据库进行物种分类学注释,设置抽平深度为最低样本序列量的95%,调用qiime feature-table rarefy 功能对样本特征序列作抽平处理。使用抽平后的ASV 表基于Bray-Curtis 距离计算距离矩阵并作主坐标分析(PCoA)。采用效应量线性判别分析(LEfSe)筛选门水平和属水平上的组间差异贡献标志物种。筛除未分类、未命名或未被培养的细菌门和属后,分别对根际土和非根际土的门水平和属水平细菌群落作与环境因子关联的冗余分析(RDA)。
1.5 数据处理
使用Excel 2016、IBM SPSS statistic 22.0 处理和分析数据,采用单因素方差分析(Duncan 检验)检验处理间生菜生长指标、土壤理化指标和Alpha 多样性指数的差异显著性,通过基于置换检验的非参数多元方差分析(Adonis)检验样本间群落结构差异,通过Kruskal-Wallis 检验和Wilcoxon 检验方法检验LEfSe 中物种组间差异的显著性。通过秩和比综合评价法(采用整秩法编秩,熵权法赋权重,采用方差膨胀因子方法检验变量间是否存在共线性,F检验方法检验线性回归模型显著性,设置7 个评级分档)作效果评价分析。使用randomForest 语言包作随机森林分析。通过基于蒙特卡洛模拟方法的置换检验方法检验RDA 中环境因子的影响显著性。采用Pearson 相关性算法作相关性分析。使用GraphPad Prism8、QIIME 2 (2019.4)和R 语言分析并可视化结果。
2 结果与分析
2.1 生物有机肥配施化肥对生菜生长的影响
收获期生菜生物量和品质指标测定结果显示,与单施化肥(CF)和不施肥(CK)相比,生物有机肥配施化肥(B1H,B2H,B4H)和有机肥配施化肥(H)有效提高了生菜地上部和地下部鲜重以及叶绿素(H 除外)和可溶性糖含量,并降低了生菜硝酸盐和维生素C 含量(P<0.05)。与H 相比,生物有机肥配施化肥显著提高了生菜地上部(B1H 9.64%,B4H 10.69%)和地下部(B1H 31.67%,B2H 26.23%)鲜重以及叶绿素(B1H 34.15%,B2H 35.30%,B4H 17.77%)、维生素C (B1H 34.43%,B2H 40.98%,B4H 47.54%)和可溶性糖(B2H 11.62%,B4H 10.95%)含量,同时降低了硝酸盐含量(B1H 23.77%,B2H 36.38%,B4H 52.00%) (P<0.05) (图1)。

图1 生物有机肥配施化肥对生菜地上部鲜重(A)、地下部鲜重(B)、地上部叶绿素含量(C)、地上部维生素C 含量(D)、地上部可溶性糖含量(E)和地上部硝酸盐含量(F)的影响Fig.1 Effect of combined application of bioorganic fertilizer and chemical fertilizer on shoot fresh weight (A),root fresh weight(B),shoot chlorophyll content (C),shoot vitamin C content (D),shoot soluble sugar content (E),shoot nitrate content (F) of lettuce
2.2 生物有机肥配施化肥对土壤理化性质的影响
收获期生菜非根际土理化性质测定结果显示,与单施化肥(CF)相比,3 种生物有机肥配施化肥(B1H,B2H,B4H)和有机肥配施化肥(H)均提高了土壤水溶性有机碳(DOC)、碱解氮(AN)、微生物量氮(MBN)、有效磷(AP)和速效钾(AK)的含量,同时降低了土壤NO3--N 含量,B1H、B2H 和B4H 均提高了土壤微生物量碳(MBC)含量和pH。土壤NH4+-N 在各处理间无显著差异。与H 相比,生物有机肥配施化肥提高了土壤AN (B2H 9.96%)、AP (B1H 48.18%,B2H 54.65%,B4H 47.57%)、AK (B1H 16.95%,B2H 19.00%,B4H 10.98%)和MBC (B1H 27.18%,B2H 41.35%;B4H 35.54%)含量,同时降低了NO3--N 含量(B1H 46.91%,B2H 50.21%,B4H 43.70%) (P<0.05)。B1H和B2H 的土壤pH 显著高于B4H (P<0.05);但DOC含量显著低于后者,B2H 达显著水平(P<0.05);B1H的土壤MBN 含量显著高于B2H 和B4H (P<0.05);其他土壤理化指标在生物有机肥配施化肥处理间差异不显著(表1)。

表1 生物有机肥配施化肥对土壤理化性质的影响Table 1 Soil physical and chemical properties under combined application of bioorganic fertilizer and chemical fertilizer
2.3 生物有机肥配施化肥对土壤细菌群落结构的影响
2.3.1 细菌Beta 多样性分析
主坐标分析(PCoA)结果(图2)显示,在根际土中,前两轴共解释了样本间细菌群落变异的23.6%,在非根际土中该比例为23.1%,各处理细菌样本的差异情况在根际土和非根际土中相似。B1H、B2H、B4H 和H 与CK 之间的距离均大于CF 与CK 之间,B1H、B2H、B4H 与H 之间的距离均大于这3 种生物有机肥配施化肥处理相互之间的距离,并且B1H和B2H 与H 之间的距离明显大于B4H 与H 之间。这说明生物有机肥配施化肥和有机肥配施化肥对生菜根际土和非根际土的影响大于单施化肥,并且3种生物有机肥配施化肥措施比有机肥配施化肥明显改变了生菜根际土和非根际土的细菌群落,其中B1H 和B2H 的影响大于B4H。Adonis 结果表明根际土各样本之间以及非根际土各样本之间的细菌群落均发生显著变异(P<0.05)。

图2 生物有机肥配施化肥下生菜根际土(A)和非根际土(B)细菌群落主坐标分析Fig.2 Principal coordinate analysis for bacterial community in rhizosphere (A) and bulk (B) soils of lettuce under combined application of bioorganic fertilizer and chemical fertilizer
2.3.2 细菌优势物种组成分析
门水平物种组成如图3 所示,各处理根际土和非根际土中的优势细菌门(相对丰度排名前10)包括放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、棒状杆菌门(Rokubacteria)和髌骨菌门(Patescibacteria)。放线菌门、变形菌门、酸杆菌门和绿弯菌门作为前4 大优势细菌门在各处理根际土和非根际土样本中的总相对丰度占比均超过82%,且各施肥处理均高于CK。在根际土样本中,与不施肥(CK)相比,放线菌门在各生物有机肥配施化肥处理(B1H,B2H,B4H)和单施化肥处理(CF)中的相对丰度分别提高13.15%、17.50%、3.03%和10.90%,在有机肥配施化肥(H)中则降低3.19%。与CF 相比,变形菌门在B1H、B2H 和B4H 中分别降低11.55%、15.18%和8.67%,而在H 中则提高7.39%。酸杆菌门在B4H 中的相对丰度明显高于其他处理。绿弯菌门在B1H、B2H 和B4H 中的相对丰度均高于H、CF和CK (图3A)。在非根际土中,与CK 相比,放线菌门在B1H、B2H、B4H 和CF 中的相对丰度分别提高5.44%、11.45%、8.53%和4.60%,在H 中则降低2.05%。与CF 相比,变形菌门在B1H、B2H 和B4H中的相对丰度分别降低13.94%、6.98%和7.67%,H略低于CF 但差异不大。与CK 相比,所有施肥措施均不同程度降低了酸杆菌门相对丰度,其中B2H降低幅度最大,高达22.67%。绿弯菌门在B1H、B2H、B4H 和H 中的相对丰度明显高于CF 和CK (图3B)。这表明在生菜根际土和非根际土中,不同生物有机肥配施化肥均明显改变了优势细菌门的群落分布。

图3 生物有机肥配施化肥下生菜根际土(A)和非根际土(B)优势细菌门(相对丰度前10)组成Fig.3 Composition of the dominant bacterial phyla (relative abundance top 10) in rhizosphere (A) and bulk (B) soils of lettuce under combined application of bioorganic fertilizer and chemical fertilizer
属水平物种组成如图4 所示,相对丰度排名前15 的优势细菌属在各处理的根际土和非根际土中总相对丰度均超过28%。Subgroup_6、芽球菌属(Blastococcus)、斯科曼氏球菌属(Skermanella)、鞘氨醇单胞菌属(Sphingomonas)和67-14 作为前5 大优势细菌属,其总相对丰度在各施肥处理根际土中明显高于CK,但在B1H、B2H、B4H 和H 的非根际土中均明显低于CK (图4)。在根际土中,Subgroup_6在B4H 中的相对丰度高于其他处理;与CF 相比,生物有机肥配施化肥和有机肥配施化肥措施均不同程度降低了芽球菌属和斯科曼氏球菌属的相对丰度,其中B4H 降低幅度最大,分别降低24.46%和39.52%;与CK 相比,各施肥措施均明显提高了鞘氨醇单胞菌属的相对丰度(图4A)。在非根际土中,与CK 相比,各施肥措施均不同程度降低了Subgroup_6 的相对丰度;与CK 相比,CF 和H 降低了67-14 的相对丰度,而生物有机肥配施化肥则提高该菌属的相对丰度;与CF 相比,生物有机肥配施化肥和有机肥配施化肥措施均不同程度降低了斯科曼氏球菌属和芽球菌属的相对丰度;与CF 相比,鞘氨醇单胞菌属的相对丰度在H 中明显提高,但在B2H 和B4H 中则较低(图4B)。上述结果表明,在根际土和非根际土中,不同施肥措施均对属水平细菌群落产生了明显影响。

图4 生物有机肥配施化肥下生菜根际土(A)和非根际土(B)优势细菌属(相对丰度前15)组成Fig.4 Composition of the dominant bacterial genera (relative abundance top 15) in rhizosphere (A) and bulk (B) soils of lettuce under combined application of bioorganic fertilizer and chemical fertilizer
2.3.3 细菌Alpha 多样性分析
收获期细菌Alpha 多样性结果显示,与CK 相比,各施肥措施(B1H 除外)均显著提高了生菜根际土的细菌Chao1 指数,其中B4H 的Chao1 指数显著高于其他处理(P<0.05) (图5A)。相反地,与CK 相比,各施肥措施均不同程度降低了生菜非根际土的细菌Chao1 指数,其中B4H 的Chao1 指数显著低于CK(P<0.05) (图5B)。与CK 相比,各施肥措施均显著提高了生菜根际土的细菌Shannon 指数,其中B4H 的Shannon 指数显著高于其他处理(P<0.05) (图5C)。此外,B4H 非根际土的Shannon 指数最低且显著低于CK (P<0.05) (图5D)。特别地,与H 相比,B4H 根际土细菌Chao1 指数和Shannon 指数分别提高7.68%和0.85% (P<0.05)。

图5 生物有机肥配施化肥下生菜收获期根际土(A)和非根际土(B)细菌群落Chao1 指数和根际土(C)和非根际土(D)细菌群落香农指数Fig.5 Chao1 index of bacterial community in rhizosphere (A)and bulk (B) soil and Shannon index of bacterial community in rhizosphere (C) and bulk (D) soils of lettuce at harvest under combined application of bioorganic fertilizer and chemical fertilizer
2.3.4 细菌群落组间差异贡献标志物种分析
LEfSe 分析(设置参数P<0.05,LDA>3)结果如图6 所示,在根际土中共筛选出32 个标志物种,其中细菌群落组间差异贡献度排名前13 的物种中包含7个细菌门(按贡献度从高到低排名依次为放线菌门、变形菌门、蓝藻菌门、拟杆菌门、芽单胞菌门、厚壁菌门、髌骨菌门)和6 个细菌属[按贡献度从高到低排名依次为BIrii41、溶杆菌属(Lysobacter)、芽球菌属、JG30_KF_CM45、气微菌属(Aeromicrobium)、乔治菌属(Georgenia)]。其中所有细菌门均属于相对丰度排名前10 的优势细菌门,芽球菌属和JG30_KF_CM45 则属于相对丰度排名前15 的优势细菌属。此外,放线菌门、厚壁菌门、JG30_KF_CM45、气微菌属、乔治菌属在B2H 中的丰度显著高于其他处理;变形菌门、拟杆菌门、BIrii41、溶杆菌属、髌骨菌门在H 中的丰度显著高于其他处理;芽单胞菌门、芽球菌属和蓝藻菌门分别在B4H、CF 和CK 中的丰度显著高于其他处理(图6A)。
在非根际土中共筛选出13 个标志物种,其中包含3 个细菌门(按贡献度大小从高到低排名依次为变形菌门、蓝藻菌门、髌骨菌门)和10 个细菌属[按贡献度大小从高到低排名依次为Subgroup_6、溶杆菌属、Saccharimonadales、OLB13、Gitt_GS_136、SBR1031、红杆菌属(Solirubrobacter)、噬甲基菌属(Methylophaga)、Amaricoccus、交替赤杆菌属(Altererythrobacter)]。其中所有细菌门均属于相对丰度排名前10 的优势细菌门,Subgroup_6、溶杆菌属、Gitt_GS_136、红杆菌属则属于相对丰度排名前15的优势细菌属。此外,SBR1031 属在B2H 中的丰度显著高于其他处理;溶杆菌属、髌骨菌门、Saccharimonadales、OLB13、Gitt_GS_136、交替赤杆菌属在H 中的丰度显著高于其他处理;变形菌门、红杆菌属、噬甲基菌属、Amaricoccus在CF 中的丰度显著高于其他处理;Subgroup_6 和蓝藻菌门在CK 中的丰度显著高于其他处理(图6B)。

图6 生物有机肥配施化肥下生菜根际(A)和非根际(B)土壤细菌群落组间差异贡献标志物种(门水平和属水平)Fig.6 Biomarkers contributing to bacterial community differentiation at phylum and genus level among treatments in lettuce rhizosphere (A) and bulk (B) soils
2.4 生物有机肥配施化肥的影响效果评价
以硝酸盐含量为负向指标,地上部鲜重和其他品质因子为正向指标对各施肥措施的生菜增产提质效果作秩和比综合评价,以土壤各养分因子为正向指标对各施肥措施的土壤培肥效果作秩和比综合评价。在这两项评价中,概率单位与秩和比值之间的线性回归模型均不存在多重共线性问题,并且模型拟合度均比较高(R2>0.83)且达到显著水平(P<0.05),因此评价结果较为可靠。在7 个分档等级中,两项评价结果均注释到第3、4、5 和6 等级,各等级概率单位值分别大于3.72、4.57、5.44 和6.28。两项评价中各施肥措施秩和比(代表生菜增产提质和土壤培肥效果)排名均为B4H>B2H>B1H>H>CF>CK,其中B4H 评级最高,位于第6 等级,B2H 位于第5 等级,B1H 和H 位于第4 等级,CF 和CK 评级最低,位于第3 等级(表2)。

表2 各施肥措施对生菜生长和土壤肥力的综合促进效果评价Table 2 Evaluation of comprehensive promotion effect of various fertilization measures on lettuce growth and soil fertility
2.5 生菜生长和土壤肥力影响因子分析
随机森林分析结果如图7 显示,6 个模型对变量的解释度达到78%以上,说明模型预测准确率较高。土壤AP 对生菜地下部鲜重、叶绿素含量、维生素C 含量和硝酸盐含量的影响最大,AK 和AN 分别对生菜地上部鲜重和可溶性糖含量的重要性最高。土壤AP 和AK 对生菜所有已测定生长指标的重要性均排在前5 位,对生菜生长影响最大,而NO3--N、DOC、MBC 和pH 分别对部分生长指标影响较大,也是影响生菜生长的重要因子。
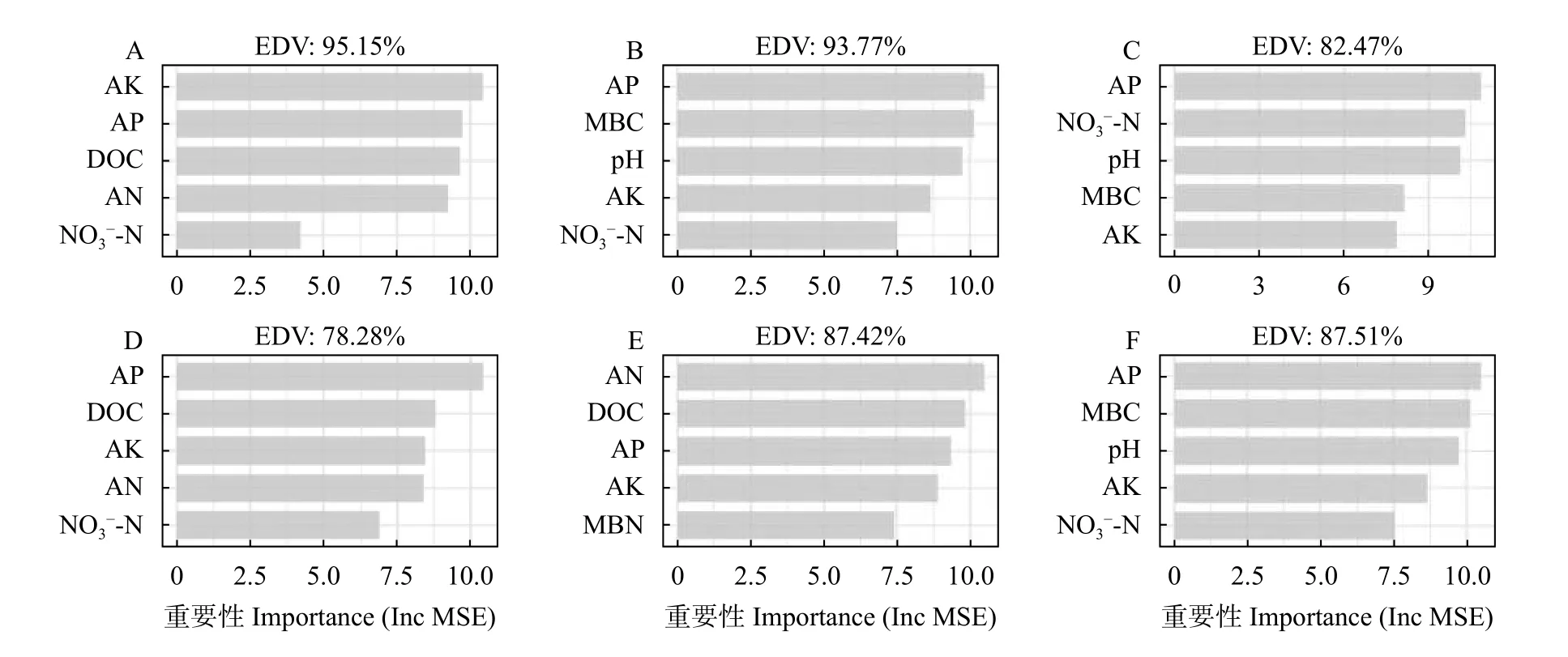
图7 土壤理化性质与生菜地上部鲜重(A)、地下部鲜重(B)、地上部叶绿素含量(C)、地上部维生素C 含量(D)、地上部可溶性糖含量(E)、地上部硝酸盐含量(F)之间的随机森林分析Fig.7 Random Forest analysis of soil physical and chemical properties with the shoot fresh weight (A),root fresh weight (B),shoot chlorophyll content (C),shoot vitamin C content (D),shoot soluble sugar content (E),shoot nitrate content (F) of lettuce
细菌群落与环境因子间的冗余分析(RDA)结果显示,除土壤NH4+-N 外,所有环境因子均与细菌群落表现不同程度关联。其中土壤pH、AP、AK 对根际土和非根际土在门和属2 个水平上的细菌群落均表现出显著相关性(P<0.05),而AN、MBC、NO3--N、DOC、TOC 和MBN 对部分水平细菌群落的影响达显著水平(P<0.05) (表3)。

表3 生菜根际和非根际土壤细菌群落与环境因子的相关性Table 3 Relationship between bacterial community and environmental factors at in lettuce rhizosphere and bulk soils
生菜生长指标与土壤理化因子的相关性分析结果显示,生菜地上部和地下部鲜重、可溶性糖含量与土壤pH、TOC、DOC、MBC、AN、AP、AK 含量均呈显著正相关(P<0.05,P<0.01,P<0.001),生菜叶绿素含量与pH、MBC、AN、AP、AK 含量均呈显著正相关(P<0.01,P<0.001),除生菜维生素C 和硝酸盐含量与土壤NO3--N 含量呈显著正相关外,其他生菜生长指标均与NO3--N 呈显著负相关(P<0.05,P<0.01,P<0.001)。此外,生菜维生素C 和硝酸盐含量均与土壤DOC、AN、AP 和AK 含量呈显著负相关(P<0.05,P<0.01,P<0.001),并分别与TOC 和pH 呈显著负相关(P<0.01) (图8)。

图8 生菜生长指标与土壤理化性质之间的皮尔森相关性Fig.8 Pearson correlation between soil physicochemical properties and growth indicators of lettuce*:P<0.05;**:P<0.01;***:P<0.001。AN:碱解氮;AK:速效钾;
生菜根际土和非根际土中的标志物种(LDA 得分排序前13)和细菌Alpha 多样性(Chao1 指数和Shannon 指数)与土壤理化因子的相关关系显示,在根际土中,除BIrii41和髌骨菌门与所有土壤理化因子均无显著相关性以外,其他标志物种均与多个土壤环境因子显著相关(P<0.05,P<0.01,P<0.001),而NH4+-N 和MBN 与所有标志物种均无显著相关性(P>0.05)。AP、AN、MBC 和DOC 对细菌Chao1 指数和Shannon 指数均呈显著正相关(P<0.05,P<0.01),并且AK 与Shannon 指数呈显著正相关(P<0.05)(图9A)。在非根际土中,除髌骨菌门和Saccharimonadales仅与pH 显著负相关(P<0.01)以及交替赤杆菌属仅与TOC 显著正相关以外(P<0.01),其他标志物种均与多个土壤理化因子表现出显著相关性(P<0.05,P<0.01,P<0.001),但各标志物种与NH4+-N均无显著关联。AP、AK 和MBC 与细菌Chao1 指数和Shannon 指数均呈显著负相关(P<0.05) (图9B)。

图9 生菜根际土(A)和非根际土(B)的细菌标志物种、Chao1 指数和Shannon 指数与土壤理化性质之间的皮尔森相关性Fig.9 Pearson correlation between soil physicochemical properties and biomarkers,Chao1 index,Shannon index of rhizosphere soil (A) and bulk soil (B) of lettuce
生菜生长指标与根际土和非根际土中的标志物种(LDA 得分排序前13)和细菌Alpha 多样性(Chao1指数和Shannon 指数)的相关关系显示,生菜生长与细菌标志物种和Alpha 多样性呈显著相关性(图10)。在根际土中,标志物种多与生菜地上部和地下部鲜重、叶绿素和可溶性糖含量呈显著正相关(P<0.05,P<0.01,P<0.001),多与生菜维生素C (P<0.05,P<0.001)和硝酸盐含量(P<0.05,P<0.001)呈显著负相关;相反地,变形菌门与生菜叶绿素含量呈显著负相关(P<0.05),蓝藻菌门与生菜地上部和地下部鲜重、叶绿素和可溶性糖含量呈显著负相关(P<0.05,P<0.01,P<0.001),与生菜维生素C 和硝酸盐含量呈显著正相关(P<0.05),芽球菌属则与生菜地上部鲜重和硝酸盐含量分别呈显著负相关和正相关(P<0.05)。Chao1指数和Shannon 指数均与生菜地上部和可溶性糖含量呈显著正相关(P<0.05,P<0.01),与硝酸盐含量呈显著负相关(P<0.05),并且Shannon 指数与生菜地下部鲜重也呈显著正相关(P<0.01) (图10A)。在非根际土中,蓝藻菌门、噬甲基菌属与生菜维生素C 和硝酸盐含量呈正相关,与其他指标呈负相关;OLB13、Gitt_GS_136 与生菜地上和地下生物量呈显著正相关(P<0.05,P<0.01),而红杆菌属、噬甲基菌属Amaricoccus与其呈显著负相关(P<0.05,P<0.01,P<0.001);Chao1 指数和Shannon 指数均与生菜地上部和地下部鲜重以及可溶性糖含量呈显著负相关(P<0.05),而Shannon 指数与生菜硝酸盐含量呈显著正相关(P<0.05) (图10B)。

图10 生菜生长指标与根际土(A)和非根际土(B)细菌标志物种、Chao1 指数和Shannon 指数之间的皮尔森相关性Fig.10 Pearson correlation between biomarkers,Chao1 index,Shannon index of rhizosphere (A) and bulk (B) soils and growth indicators of lettuce
3 讨论
3.1 生物有机肥对生菜产量和品质的影响
在不合理施肥和土壤质量退化的大背景下,蔬菜产量和品质很难二者兼顾或进一步提高,但是生物有机肥配施化肥措施被证明可以在保产或增产的同时提高蔬菜品质[16]。以往研究发现,生物有机肥配施化肥提高了生菜[17]和番茄(Solanum lycopersicum)[18]的产量、可溶性糖和维生素C 含量,同时降低了硝酸盐含量。本研究与前人研究结果相似,与单施化肥相比,生物有机肥配施化肥和有机肥配施化肥措施均显著提高了生菜地上部和地下部鲜重以及可溶性糖含量,同时显著降低了生菜硝酸盐含量,而且生物有机肥配施化肥措施显著提高了生菜叶绿素含量(图1)。各施肥措施对生菜的增产提质综合效果排序为B4H>B2H>B1H>H>CF>CK (表2)。说明中药渣有机肥配施化肥对生菜具有明显的增产提质效果,并且接种3 种芽孢杆菌均能有效提高中药渣有机肥的效果,其中巨大芽孢杆菌中药渣生物有机肥对生菜的增产提质综合效果最好。植物生长需要多种大量元素如氮、磷、钾等以及微量元素如铁、锌、锰等充足且均衡供应[19]。生物有机肥配施化肥和有机肥配施化肥相比单施化肥向土壤中额外施入的有机态磷、钾、钙、镁等物质经微生物分解转化为土壤有效态养分,满足了生菜对多元养分的均衡需求,并且外源有机质的输入在一定程度上改善了土壤理化和生物性质,促进了养分在土壤中的转化、转运和生菜的吸收效率,这可能是生菜产量和品质提高的主要原因。此外,生物有机肥配施化肥对生菜的增产提质效果优于有机肥配施化肥的原因可能是芽孢杆菌属具有分泌植物生长素、解磷解钾、固氮以及拮抗病原微生物等植物益生功能,能够有效促进植物生长,并且能够加快有机质分解进而释放无机养分供植物利用[13]。然而不同芽孢杆菌在有机质分解、植物生长素分泌和解磷解钾以及固氮等方面的效果有所不同[13-14],这可能是造成3 种芽孢杆菌中药渣生物有机肥对生菜作用效果产生差异的主要原因。
3.2 生物有机肥对土壤养分环境的影响
NO3--N、NH4+-N、AN、AP 和AK 是植物所需的有效态养分,其含量反映了土壤供肥能力和植物养分吸收情况。DOC 在土壤中有较好的移动性,容易被微生物利用或矿化后被植物吸收,因此其对土壤养分和微生物环境以及作物生长均具有重要意义[20]。土壤养分以微生物躯体形态(MBC 和MBN)保存可以减少淋失和排放损失,起到土壤保肥功效[21]。TOC 是表征土壤肥力的一个指标,其在土壤中的积累有益于土壤健康[22]。秩和比综合评价结果显示,各施肥措施对土壤养分环境的综合改良效果排名和等级分档与生菜增产提质综合效果评价的结果相同(表2)。这表明配施生物有机肥或有机肥均能够有效提高土壤供肥和保肥能力,并且生物有机肥的效果优于有机肥,其中巨大芽孢杆菌生物有机肥对土壤的综合培肥效果最好。在本研究中,相比单施化肥,生物有机肥配施化肥和有机肥配施化肥均有效提高了土壤TOC、DOC、MBC、AN 和MBN、AP 和AK 的含量,其中生物有机肥配施化肥对土壤MBC、AN、AP 和AK 含量的提升效果优于有机肥配施化肥,并且显著提高了土壤pH。此外,3 种生物有机肥配施化肥处理之间在土壤pH 以及DOC 和MBN 含量方面也表现出差异(表1)。
外源物质输入、微生物代谢和植物-土壤物质交换是影响土壤养分环境的关键因素。生物有机肥和有机肥的施用直接向土壤中输入了有机质,因此土壤TOC 含量有所提高,伴随着有机质分解,土壤中DOC 含量将有所提高,而这进一步促进了土壤微生物的生长,扩大了微生物量碳库(MBC)和氮库(MBN)。其他学者的研究也表明,施用生物有机肥能够有效提高土壤微生物量碳氮[23]。微生物活动增加了有机质的分解,进一步提高了土壤中易水解态有机氮和有效态磷钾等有效态养分的含量[24],这可能是生物有机肥配施化肥和有机肥配施化肥处理的土壤AN、AP 和AK 含量得到显著提高的原因。研究表明,高强度的有机质分解可能会增加土壤pH,微生物对固持态养分的活化过程可能会降低土壤pH,并且养分有效性通过影响植物根系向土壤分泌有机酸也会影响土壤pH[17,19]。因此推断,生物有机肥配施化肥处理土壤pH 显著上升的原因可能是这些处理中有机质分解强度较大。芽孢杆菌随生物有机肥接入土壤,可能进一步改善了土壤微生物环境,加强了微生物对有机质的分解作用,并且芽孢杆菌被证明有固氮和活化土壤磷钾的作用[13],这可能是生物有机肥配施处理中土壤AN、AP 和AK 含量高于有机肥配施处理的主要原因。生菜属于喜硝植物[15,25],配施生物有机肥和有机肥的处理中土壤养分较为均衡,生菜生长比较旺盛,对土壤NO3--N 的消耗比较大,因此这些施肥措施下的土壤NO3--N 含量比较低,并且生物有机肥配施化肥处理低于有机肥配施化肥处理。地衣芽孢杆菌、解淀粉芽孢杆菌、巨大芽孢杆菌在有机质分解、固氮、解磷解钾、植物激素分泌等功能方面的差异以及生菜与土壤的互作则可能是导致3种生物有机肥培肥效果差异的主要原因[13-14]。
3.3 生物有机肥对土壤细菌群落的影响
土壤微生物参与了土壤肥力演变和植物生长过程,细菌作为其中一大类群,在土壤养分转化和植物养分吸收中扮演着重要角色[26-27]。研究表明,生物有机肥等外源肥料施入会改变土壤细菌群落,其中放线菌门、变形菌门、酸杆菌门和绿弯菌门在多种土壤细菌群落中占据优势地位,但优势细菌属在不同土壤中的分布差异比较大[17,28-29]。在本研究中,各施肥处理的生菜根际土细菌群落之间以及非根际土细菌群落之间均产生显著差异,并且生物有机肥配施化肥处理和有机肥配施化肥处理与CK 的差异大于单施化肥处理与CK 的差异(图2)。这说明:一方面,土壤细菌群落对施肥因素较为敏感,以至于在短期内便对不同施肥措施表现出明显不同的反应;另一方面,有机质和化肥组合输入对土壤细菌群落的重塑作用大于单一化肥输入。以往研究表明,土壤细菌多样性受土壤物理、化学和生物等多个动态过程的影响[30],同时微生物接种剂对土壤细菌群落也具有重塑作用[31],这意味着,土壤理化性质的改变和植物促生菌的接种都可能在一定时间尺度上改变土壤细菌群落。本研究中,不同施肥措施下土壤的理化性质均发生较大的变异,尤其是生物有机肥配施化肥处理和有机肥配施化肥处理(表1),这与各处理之间细菌群落的差异情况相似,说明土壤理化性质与细菌群落密切相关。此外,3 种生物有机肥配施化肥处理之间土壤理化性质差异不大,但其细菌群落之间差异明显变异,说明不同功能菌剂的外源接种对土壤细菌群落的直接影响以及其通过影响土壤理化性质而对土壤细菌群落的间接影响均可能是生菜根际和非根际土壤细菌群落发生改变的原因[31]。
从物种组成来看,各处理生菜根际土和非根际土的前四大优势细菌门是放线菌门、变形菌门、酸杆菌门和绿弯菌门(图3),与前人研究结果相似[17,28-29];而前五大优势细菌属是Subgroup_6、芽球菌属、斯科曼氏球菌属、鞘氨醇单胞菌属和67-14 (图4),与其他学者关于马铃薯(Solanum tuberosum)和香蕉(Musa nana)土壤属水平细菌群落的研究结果不同[32-33],这说明土壤细菌群落在优势细菌属水平上受土壤和植物类型的影响一般大于在优势细菌门水平上。此外,根际土和非根际土中优势细菌门和优势细菌属的相对丰度在各处理间表现出不同程度的差异(图3 和图4)。土壤微生物包括细菌可以被分为寡营养和嗜营养两大类,对土壤养分的富盈或匮缺表现出不同的反应[34]。植物代谢通过影响土壤理化性质以及向土壤释放根系分泌物等生物化学过程也会间接或直接影响到根际土和非根际土的细菌物种组成[35]。微生物接种剂对土壤细菌的作用以及土壤微生物相互之间的协作或竞争作用也是土壤细菌物种组成和分布发生变异的重要原因[27,31]。结合前人研究推断,本研究中生菜根际土和非根际土细菌优势物种组成在各施肥处理之间的变异可能是由土壤-细菌互作、植物-细菌互作和微生物互作的差异所造成的。土壤理化性质、植物养分吸收和代谢物分泌、芽孢杆菌接种剂和土壤微生物互相作用在各处理间的差异可能是导致不同施肥措施下细菌群落差异的主要原因,这在主坐标分析(图2)和冗余分析(表3)中得到部分证实。
在自然情况下,较高的Alpha 多样性与土壤微生物环境健康密切相关[36]。不同研究之间,植物根际土和非根际土细菌Alpha 多样性对施肥的响应存在明显差异。一项田间试验发现生物有机肥表现出提高生菜非根际土细菌丰富度的趋势,但是对细菌多样性没有明显影响[17]。孙薇等[37]研究发现生物有机肥能够有效提高核桃(Juglans regia)非根际土微生物丰富度和多样性。另有研究发现生物有机肥显著降低了三七(Panax notoginseng)根际土细菌丰富度和多样性[28],但提高了西瓜(Citrullus lanatus)根际土的细菌丰富度和多样性[29]。张明宇等[38]研究发现生物有机肥提高了生长旺盛期烟草(Nicotiana tabacum)根际土细菌丰富度和多样性,但成熟期根际土细菌丰富度和多样性却低于对照组。本研究结果表明,施肥能够明显提高根际土细菌丰富度和多样性,其中生物有机肥和有机肥的促进作用优于化肥,巨大芽孢杆菌生物有机肥的效果最好,同时非根际土细菌丰富度和多样性在各施肥措施下均表现出下降的趋势,尤其在巨大芽孢杆菌生物有机肥配施化肥措施下的下降程度达显著水平(图5)。这可能是因为外源养分输入在促进植物生长的同时也加强了植物根系与土壤和细菌的互作[39],有利于构建更加适合细菌生长和富集的根际环境,促使土壤细菌从非根际土向根际土富集。总的来看,生物有机肥在不同试验中对植物根际土和非根际土细菌Alpha 多样性的影响不同,这可能是由生物有机肥种类(功能菌剂和有机质载体)、试验类型(田间或盆栽)、土壤类型以及植物类型等多方面因素共同决定的。通过LEf-Se 分析在根际土和非根际土中分别筛选出32 和13个组间差异贡献标志物种。在贡献度排名前13 的标志物种中,根际土和非根际土中分别筛选到9 和7个优势细菌物种(图6)。这在一定程度上表明不同施肥措施对根际土细菌群落的影响比对非根际土细菌群落的影响大。研究表明,与非根际土相比,植物根际土环境中富含更多的有效态养分和根系分泌物等细菌可利用物质,因此细菌在根际土的代谢活动强度高于非根际土[40]。此外,植物与细菌的互作效应主要发生在根际[39],这也是根际土细菌群落对环境变化响应较为敏感的可能原因。
3.4 生物有机肥对生菜生长和土壤环境的影响效果和影响因子
秩和比综合评价结果显示,各施肥措施在土壤养分环境改良效果方面的排名和分档等级与其在生菜增产提质效果方面的排名和分档等级一致,秩和比排序为B4H>B2H>B1H>H>CF>CK,分档等级排序为B4H>B2H>(B1H,H)>(CF,CK) (表2)。由此可知,一方面,生物有机肥配施化肥和有机肥配施化肥的土壤培肥和生菜增产提质效果优于单施化肥,其中生物有机肥配施化肥优于有机肥配施化肥,巨大芽孢杆菌生物有机肥配施化肥的土壤培肥和生菜增产提质综合效果最佳;另一方面,两项评价结果的高度一致暗示了生菜产量和品质与土壤养分环境质量之间呈正相关关系。此外,B4H 的生菜根际土细菌Alpha 多样性高于其他施肥处理,为生菜生长提供了更加健康的根际微生物环境(图5)。这说明巨大芽孢杆菌生物有机肥在生菜增产提质以及土壤养分环境和微生物环境的改良方面效果最好。
相对其他理化指标而言,土壤AP、AK 和AN 对生菜生长的重要性比较大(图7)。有效态氮磷钾是植物生长三要素,其对植物生长的影响相对于其他土壤理化指标而言一般较大。生菜虽然属于喜硝植物[15,25],但是土壤AP 和AK 以及氨基酸态氮[41]如甘氨酸态氮[42]等其他形式有效态氮等也是其生长代谢所需的养分,收获期各处理土壤的NO3--N 供应能力都比较充足,因此土壤NO3--N 含量对生菜生长的影响相对其他养分(土壤AP、AK 和AN)而言有所下降。相关性分析结果显示,生菜生长与除了NH4+-N和MBN 以外的其他8 个土壤理化因子均存在不同程度显著相关性。从相关性程度来看,AP、AK、AN 与收获期生菜生长之间的关联程度也大于其他土壤理化指标(图8)。这表明生菜生长受到土壤多种土壤理化指标的综合调控,其中AP、AK、AN 是主要调控因子。土壤AP、AK、AN、NO3--N 和TOC 反映了土壤的综合肥力,DOC 和MBC 则表征土壤微生物活性和生物量[20-21],pH 与土壤酶活和养分转化密切相关,也是影响土壤肥力的关键因子,因此这些环境因子与植物生长密切相关[43]。此外,生菜生长与根际土和非根际土细菌标志物种之间也密切相关,并且与根际土细菌Alpha 多样性呈显著正相关(图10)。植物与土壤微生物存在着广泛的互作,益生细菌通过提高养分有效性或分泌促生长激素间接或直接促进植物生长,病原细菌则可能导致植物根系腐烂等疾病[40]。较高的Alpha 多样性意味着根际土细菌群落比较健康,不利于病原菌大量繁殖进而引发植物病害[36]。前人研究发现,放线菌门在土壤中参与养分活化,具有提高养分有效性的潜力,也能分泌植物激素[44];变形菌门包含很多与植物生长和土壤肥力相关的固氮菌和光合细菌,能够促进土壤和植物固氮,也能够活化土壤固持态磷提高土壤有效磷含量[45];蓝藻菌门能够进行光合作用[46],厚壁菌门具有降解木质素和纤维素的功能[47],均有利于提高土壤肥力;溶杆菌属能够分泌抗生素,拮抗病原菌,有利于植物健康[48]。由此推断,这些标志物种很有可能通过参与土壤养分转化或调节植物生长而间接或直接影响生菜的产量和品质。
Li等[10]研究发现,土壤电导率和AP 对土壤细菌群落产生显著调控作用。陈德乐等[49]则发现土壤pH 是土壤细菌群落的重要调控因子。本研究与前人研究结果相似,pH、AP 和AK 是生菜根际土和非根际土细菌群落最为关键的影响因子(表3)。土壤pH 参与调控土壤一系列物理、化学和生物反应,与有机质降解和养分活化等微生物参与过程密切相关,因此是土壤细菌群落的关键调控因子[19,43]。此外,土壤养分有效性和有机质与微生物代谢活动密切相关,本研究处理间土壤AP、AK 变化较大,因此其对微生物群落结构的影响大于其他有效态养分和TOC[19],MBC 和MBN 直接反映土壤微生物生物量,因此也与细菌群落变化有关[21]。以往研究发现,在土壤细菌群落中,α-变形菌门、β-变形菌门、放线菌门、厚壁菌门属于嗜营养物种,一般在营养丰富的土壤中相对丰度较高,酸杆菌门、γ-变形菌门、δ-变形菌门、芽单胞菌门、绿弯菌门则属于寡营养物种,一般在贫瘠土壤中相对丰度较高[50]。此外,蓝藻菌门具有固氮活性,在氮营养缺乏时代谢活动增强,具有解磷解钾功效的细菌如芽孢杆菌则在土壤AP 和AK 缺乏时代谢活动增强[34]。在本研究中,组间差异贡献标志物种与土壤理化因子之间表现出密切相关性,并且AP、AK、AN、DOC 和MBC 与生菜根际土Alpha多样性呈显著正相关,AP、AK 和MBC 与非根际土Alpha 多样性呈显著负相关(图9)。这说明,土壤细菌群落与土壤养分特征密切相关,土壤有效态氮磷钾和水溶性有机碳有利于细菌在生菜根际土中的富集,但是在不同土壤、栽培和施肥条件下,细菌群落变异的主要驱动因子可能会发生变化。
4 结论
本研究发现,生物有机肥配施化肥对生菜的综合增产提质效果优于其他施肥处理,其有效提高了土壤AN、AP、AK、TOC、MBC 和DOC 的含量,提高了土壤供肥和保肥能力,改善了土壤养分环境,同时提高了生菜根际土细菌物种丰富度和多样性,改善了土壤微生物环境。其中巨大芽孢杆菌中药渣生物有机肥配施化肥对生菜的综合增产提质效果以及对土壤环境的综合改良效果最佳。随机森林模型和相关性分析表明,生物有机肥配施化肥对生菜生长的促进作用主要是通过调控土壤有效态氮磷钾供应能力而发挥的。冗余分析和相关性分析表明,生物有机肥配施化肥主要通过调控土壤pH 和AK、AP 含量影响土壤细菌群落,并有助于提高生菜根际土细菌物种丰富度和多样性。此外,组间差异贡献标志物种与生菜生长也表现出明显相关性,预示着生菜生长不仅与土壤理化性质紧密相关,而且也可能受土壤特定细菌物种的调控。总的来说,相对单施化肥或有机肥配施化肥而言,生物有机肥配施化肥作为优化施肥策略有利于在减施化肥的背景下进一步优化生菜生长和土壤环境,相比其他2 种芽孢杆菌中药渣生物有机肥,推荐配施巨大芽孢杆菌中药渣生物有机肥。此外,建议对该生物有机肥在蔬菜田间面源污染和温室气体排放等方面的影响做进一步评估。本研究为清洁施肥、废弃物资源化利用、土壤环境改良、蔬菜产量和品质改善等提供了新的理论支持和技术参考。

