活血益气方对miR-484 过表达脐静脉内皮细胞增殖、迁移和成管能力的影响
杨 睿,程 序,赵梦竹,国倩倩,张馨月,刘梦华,魏 琼,张冬梅
(北京中医药大学东直门医院/中医内科学教育部和北京市重点实验室,北京 100700)
急性心肌梗死后治疗性血管新生是在原有的脉管系统基础上,通过刺激新生血管网的生成来提高心肌侧支循环的代偿能力,从而改善心肌缺血症状。血管生成受多种因素的调控,其中微小RNA(microRNA,miRNA)是关键调控因子。miRNAs是一簇长度为21~23 个核苷酸的小非编码RNA,主要在转录后水平调控基因表达。越来越多的研究者发现,miRNA 可调节血管生成相关因子的表达,调控内皮细胞增殖、迁移和管腔形成[1]。而在众多的miRNAs 中,miR-484 可能是血管生成的创新基因治疗候选者,miR-484 可以协同调节血管内皮生长因子(vascular endothelial growth factor,VEGF)-B 和VEGF-R2(KDR)的表达[2]。VEGF 家族主要包括VEGFA、VEGFB、VEGFC、VEGFD、VEGFE、VEGFF 和胎盘生长因子(placental growth factor,PLGF)7 个亚型[3],其中VEGFA 是最主要的血管调控因子,也是在血管生成中最活跃的异构体[4]。活血益气方是针对缺血性心脏病尤其是冠心病气虚血瘀病机而构建的临床经验方,前期研究表明,活血益气方可以通过直接诱导缺血心肌局部VEGF 及其mRNA 的表达[5],促进梗塞边缘区血管新生或下调VEGFA mRNA 的负向调控因子miR-126 或Spred1 的表达,间接上调VEGF 及其mRNA 的表达,促进血管新生[6,7]。为明确miR-484对血管新生的调控作用并进一步探索活血益气方促血管新生的作用机制,本研究在建立miR-484 过表达人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)模型的基础上给予活血益气方进行干预,探索miR-484 对HUVEC 增殖、成管和VEGFA mRNA 表达的影响及活血益气方的作用。
1 材料和方法
1.1 细胞
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)(Cat.#:DFSC-EC-01)购自上海中乔新舟生物科技有限公司。
1.2 药物与主要试剂
ECM 培养基(上海中乔新舟生物有限公司,Cat.#:1001);牛源纤维黏连蛋白(Sciencell,Cat.#:O113);miR-484 mimics 和mimics negative control(mimics NC)由上海吉玛制药技术有限公司合成;HiPerFect Transfection Reagent(Qiagen 公司,Cat.#:301705);磷酸盐缓冲液(DPBS,Solarbio 科技有限公司,Cat.#:D1040-500);胰酶/EDTA 消化液(ScienCell,Cat.#:0103);Matrigel 基底胶(Solarbio科技有限公司,Cat.#:M8371);CCK-8 试剂盒(日本同仁化学研究所,Cat.#:CK04-1);FastKing RT Kit(With gDNase)(Cat.#:KR116)、SuperReal Pre-Mix Plus(SYBR Green)(Cat.#:FP205)、miRcute miRNA Isolation Kit(Cat.#:DP501)、miRcute Plus miRNA First-Strand cDNA Synthesis Kit(Cat.#:KR211-02)、miRcute Plus miRNA qPCR Kit(Cat.#:FP411-02)购自TIANGEN 公司;活血益气方(黄芪60 g,党参60 g,丹参10 g,川芎10 g,赤芍10 g,红花10 g),所有药物由北京中医药大学东直门医院提供饮片,水煎,过滤,浓缩,水分控制在3%以内。浓缩液-40℃过夜,待药液完全凝结后置于冷冻干燥机中1 d,通过低温升华去除水分,收集活血益气方中药冻干粉制剂使用。
1.3 构建miR-484 过表达HUVEC 细胞模型
收集对数生长期HUVEC 制成5×104cells/mL细胞悬液,按100 μL/孔均匀接种于提前用牛源纤维黏连蛋白2 μg/cm2包被好的96 孔板中,培养箱中孵育24 h 使细胞贴壁。将miR-484 mimics/mimics NC 干粉离心后加入DEPC 水配置成20 μmol/L 的工作液;将2 μL miR-484 mimics/mimics NC 工作液加入到50 μL 不添加胎牛血清、生长因子及双抗的基础ECM 培养基中,混匀,再加入0.75 μL HiPer-Fect Transfection Reagent,混匀,室温孵育5~10 min,形成转染混合物。吸弃旧培养基,每孔加入150 μL 基础ECM 培养基,再加入转染混合物,培养箱转染6 h 后换添加胎牛血清、生长因子及双抗的完全ECM 培养基继续培养至48 h,建立miR-484 过表达细胞模型(miR-484 mimics 组)及其阴性对照(Mimics NC 组)。通过实时荧光定量PCR 方法检测HUVEC 中miR-484 表达情况以评价模型是否构建成功。
1.4 分组及给药
建立miR-484 过表达HUVEC 模型后,将细胞分为对照组(Mimics NC 组)、模型组(miR-484 mimics 组)和药物组(miR-484 mimics+活血益气方冻干粉溶液组),药物组加入含2 mg/mL 活血益气方冻干粉的ECM 培养基,对照组和模型组加入等量ECM 培养基。
1.5 CCK-8 法检测缺氧HUVEC 增殖情况
将细胞按5×104个/孔均匀接种于96 孔板中,按1.4 所述方法造模及干预后,吸弃上清,按CCK-8溶液∶基础ECM 培养基=1∶10 的比例混匀后以110 μL/孔加入细胞中,培养箱中孵育3 h,多功能微孔板检测仪测定450 nm 波长处各组的吸光度值(OD 值)。
1.6 细胞划痕实验检测缺氧HUVEC 迁移的情况
将细胞按5×104cells/mL 均匀接种于包被好的6 孔板(在6 孔板底部划标记线,使得每孔有3 条平行线穿过),每孔加入2.5 mL 细胞悬液。按照1.4 所述方法造模及分组。待细胞融合成片,无较大细胞空隙时,用200 μL 枪头垂直于标记线在底部划线。吸弃培养基,DPBS 冲洗去除划下和凋亡的细胞后,换用基础ECM 培养基,培养0 h、X h 分别于倒置显微镜下拍照,每次拍照位置以提前划好的标记线作为定位点,保证同一位置进行对比。使用Image J 软件对两次照片之间划痕面积进行统计分析。迁移率(%)计算如下:迁移率(%)=(A0-AX)/A0×100%,其中A0 表示初始伤口面积(t=0 h),AX 表示测量时的残留面积点(t=X h)
1.7 Matrigel 基质胶实验检测缺氧HUVEC 管状形成能力的情况
将Matrigel 基质胶按50 μL/孔平铺于提前预冷的96 孔板内,培养箱中孵育30 min 使其凝固。按照1.4 所述方法造模及分组。胰酶消化后收集各组细胞悬液,离心后加入基础ECM 培养基重悬,按2×105cells/mL 将细胞接种于含凝固Matrigel 基质胶的96 孔板中,每孔100 μL,培养箱中孵育6 h 后,倒置显微镜下观察各组HUVEC 成管情况,并拍照记录。使用Image J 软件对成管情况进行统计分析。
1.8 实时荧光定量PCR 检测VEGFA mRNA 的表达
取2 μg 提取的总RNA,根据反转录试剂盒说明书操作:5×Buffer 2 μL、RNase-freewater,配置10 μL gDNA 去除反应体系混合液,在42 ℃反应3 min;RT-Mix 1 μL、10×Buffer 2 μL、FQ-RT Primer Mix 2 μL、RNase-freewater 5 μL 配置反转录反应体系混合液,42 ℃ 15 min、95 ℃ 3 min 条件下进行反转录,得到cDNA 链。以cDNA 为模板进行PCR 反应,按荧光定量试剂盒说明书操作:2×Pre Mix 10 μL、10 nmol/L 上下游引物各0.6 μL、cDNA 2 μL、RNase-free water 6.4 μL、50×Dye 0.4 μL,配置20 μL 的反应体系,放入PCR 仪,95 ℃ 15 min 激活FastStart DNA Taq 聚合酶后,95 ℃ 10 s,60 ℃ 32 s,40 个循环,进行实时荧光定量PCR,接着检测PCR溶解曲线。以GAPDH 作为内参照。用NCBI PrimeR-BLAST 设计引物,由生工生物有限公司合成,引物序列(5'-3'):VEGFA,上游:CTGTCTTGGGTGCATTGGAG,下游:ACCAGGGTCTCGATTGGATG;GAPDH,上游:GGGTGTGAACCATGAGAAGT,下 游 :GACTGTGGTCATGAGTCCT。每个样品设立3 个复孔,取均值,所得CT 值按照2-△△ct的方法,进行均一化处理后再进行统计学分析。
1.9 统计学处理
采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,服从正态分布两组比较用独立样本t检验,多组比较方差齐时用单因素方差分析(one-way ANOVA),方差不齐时用Welch 检验,方差齐时组间比较用LSD 检验,方差不齐时组间比较采用Dunnett's T3 检验;不服从正态分布者用非参检验,均以P<0.05 为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR 评价miR-484 过表达HUVEC 细胞模型
如表1 所示,与Mimics NC 组相比,miR-484 mimics 组miR-484 表达显著升高(P<0.01)。miR-484 过表达HUVEC 细胞模型构建成功。见表1。
表1 各组HUVEC 中miR-484 表达情况(n=3,±s)Tab 1 miR-484 expression in HUVEC of each group(n=3,±s)

表1 各组HUVEC 中miR-484 表达情况(n=3,±s)Tab 1 miR-484 expression in HUVEC of each group(n=3,±s)
注:与Mimics NC 组相比,*P<0.01;。
miR-484 相对表达量1.003±0.092 140.341±20.068*12.026 0.007组别Mimics NC 组miR-484 mimics 组tP
2.2 各组HUVEC 增殖情况
与对照组(Mimics NC 组)相比,模型组(miR-484 mimics 组)HUVEC 增殖下降(P<0.01);与模型组相比,药物组(miR-484 mimics+活血益气方冻干粉溶液组)HUVEC 增殖上调(P<0.01)。见表2。
表2 各组HUVEC 增殖情况(n=8,±s)Tab 2 HUVEC proliferation in each group(n=8,±s)

表2 各组HUVEC 增殖情况(n=8,±s)Tab 2 HUVEC proliferation in each group(n=8,±s)
注:与对照组相比,*P<0.01;与模型组相比,**P<0.01。
OD 值0.534±0.039 0.485±0.011*0.561±0.042**10.356 0.001组别对照组模型组药物组FP
2.3 各组HUVEC 迁移情况
与对照组相比,模型组HUVEC 迁移面积下降(P<0.05);与模型组相比,药物组HUVEC 迁移面积增加(P<0.05)。与对照组相比,模型组HUVEC迁移率有下降的趋势;与模型组相比,药物组HUVEC 迁移率有下调的趋势,但差异均不具有统计学意义(P>0.05)见表3、图1。

图1 各组HUVEC 迁移情况(50×)Fig 1 HUVEC migration in each group (50×)
表3 各组HUVEC 迁移情况(n=3,±s)Tab 3 HUVEC migration in each group(n=3,±s)
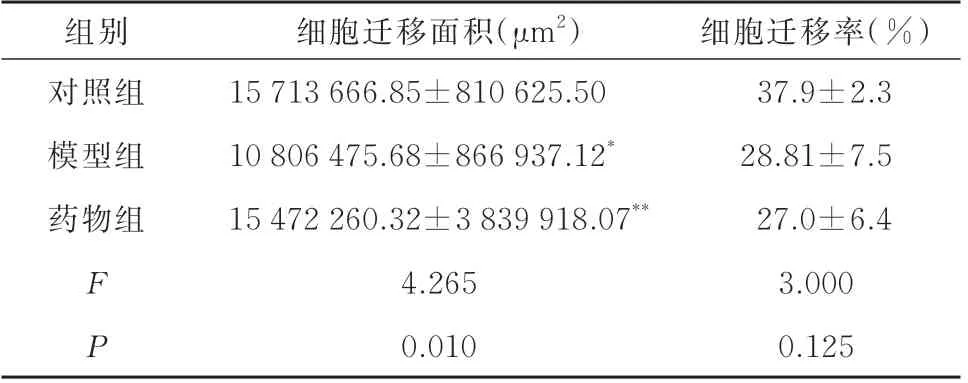
表3 各组HUVEC 迁移情况(n=3,±s)Tab 3 HUVEC migration in each group(n=3,±s)
注:与对照组相比,*P<0.01;与模型组相比,**P<0.01。
组别细胞迁移面积(μm2)细胞迁移率(%)对照组模型组药物组FP 15 713 666.85±810 625.50 10 806 475.68±866 937.12*15 472 260.32±3 839 918.07**4.265 0.010 37.9±2.3 28.81±7.5 27.0±6.4 3.000 0.125
2.4 各组HUVEC 成管情况
与对照组相比,模型组HUVEC 参与成管的长度、分支数、节点数减少,成管能力显著下降(P<0.01);与模型组相比,药物组HUVEC 参与成管的长度、分支数、节点数增多,成管能力显著提升(P<0.05)。见表4、图2。

图2 各组HUVEC 成管情况(100×)Fig 2 Formation of HUVEC tubes in each group (100×)
表4 各组HUVEC 成管情况(n=4,±s)Tab 4 HUVEC tube formation in each group(n=4,±s)
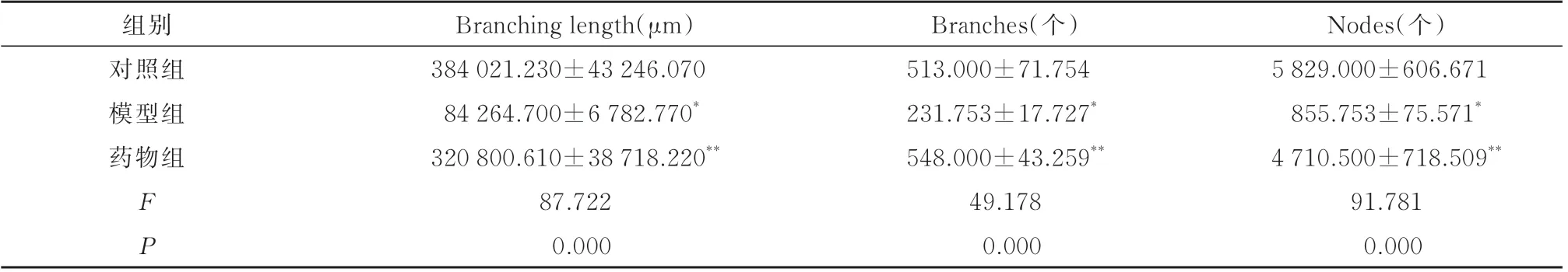
表4 各组HUVEC 成管情况(n=4,±s)Tab 4 HUVEC tube formation in each group(n=4,±s)
注:与对照组相比,*P<0.01;与模型组相比,**P<0.01。
Nodes(个)5 829.000±606.671 855.753±75.571*4 710.500±718.509**91.781 0.000组别对照组模型组药物组FP Branching length(μm)384 021.230±43 246.070 84 264.700±6 782.770*320 800.610±38 718.220**87.722 0.000 Branches(个)513.000±71.754 231.753±17.727*548.000±43.259**49.178 0.000
2.5 各组中VEGFA mRNA 表达情况
与对照组相比,模型组VEGFA mRNA 表达水平下调(P<0.05);与模型组相比,药物组VEGFA mRNA 表达水平上调(P<0.01)。见表5。
表5 各组中VEGFA mRNA 表达情况(n=3,±s)Tab 5 VEGFA mRNA expression in each group(n=3,±s)

表5 各组中VEGFA mRNA 表达情况(n=3,±s)Tab 5 VEGFA mRNA expression in each group(n=3,±s)
注:与对照组相比,*P<0.01;与模型组相比,**P<0.01。
VEGFA mRNA 1.016±0.336 0.522±0.120*1.327±0.268**11.247 0.009组别对照组模型组药物组FP
3 讨论
急性心肌梗死属于祖国医学“胸痹”、“真心痛”等范畴,由于脉络的突然痹阻,血液不得濡养心肌,不通、不荣皆可导致胸痛。故而在心肌梗死初期,血瘀为主要损伤,血液不能循常道濡养四周,日久则心失所养而致心气虚,心气不足则行血之力愈弱,血流缓慢而易淤堵成瘀,如此循环往复而成气虚血瘀之本虚标实之证。《血证论》中言,“凡血者必先以去瘀为要”,瘀血不去,新血不生,“祛瘀”是“生新”的前提基础,而“生新”则既包括了生成新的血液,又包括了生成新的血管[8];万物生长皆赖气的充足,气虚不补,则无力生发,又气为血之帅,气旺则血畅,血为气之母,血足则气才得以充足,血不足则生发无源,气血互根,相辅相成。许多学者认为“心气虚证”与心肌能量代谢障碍有关,补气可以提高能量代谢,加快瘀血的祛除以及新血的生成[9,10]。可见益气活血法在心肌梗死后血管新生阶段发挥了重要作用。现代研究证实,益气、活血类中药能够直接作用于内皮细胞,通过促进增殖、抑制凋亡或上调VEGF 表达等途径来显著地促进血管的生成。活血益气方集补中益气之黄芪[11]、党参,活血祛瘀之丹参[12,13]、赤芍、红花、川芎[14]于一方之中,可以益气活血,化瘀生新。在课题组前期的研究结果中发现,活血益气方可以通过多靶点多途径的方式作用于血管新生的各个相关环节,促进缺氧后内皮细胞增殖、迁移、成管等,达到促进血管新生的作用,并且2 mg/mL 活血益气方冻干粉溶液使细胞活力明显上调。
研究显示,miRNAs 可以直接靶向促血管新生因子或其上游因子,如miR-195[15]、miR-150[16]可以直接与VEGF mRNA 的3‘UTR 结合,抑制其表达,从而抑制血管生成;也可以通过靶向VEGF 下游而负调控VEGF 信号通路,如miR-23、miR-132、miR-221 促进血管生成[17]。由于miRNA 的作用方式是多靶点、多途径的,可能同时靶向多个mRNA,部分miRNA 对血管新生的调控可有两种趋势,如内皮细胞特异性表达的miR-126 既可以抑制VEGF表达从而抑制血管性新生[18],又可以靶向VEGF 的负性调控因子的表达,对血管新生过程起协同作用[19]。以往的研究发现,miR-484 在缺血性心脏病及肿瘤疾病患者/实验模型中存在显著地差异性表达,其差异表达可能会影响到血管的生成[20,21]。Li等[22]研究证实miR-484 可以抑制胃癌组织的血管新生,而在另一项研究中miR-484 可能与抗血管新生药物有协同作用[23]。本研究中继续以2 mg/mL 活血益气方冻干粉溶液干预miR-484 过表达HUVEC细胞模型。结果发现,活血益气方可以减轻过表达miR-484 后对内皮细胞增殖、迁移和成管能力的抑制作用,表明活血益气方对miR-484 靶向VEGFA抑制血管新生的过程有一定的负向调控作用,并可以改善miR-484 对VEGFA mRNA 表达的抑制作用,进而促进VEGFA 的表达,促进血管新生。
VEGFA 主要通过与三种酪氨酸激酶受体(VEGFR1、VEGFR2、VEGFR3)和两种非酪氨酸酶激酶的跨膜受体(NP-1、NP-2)结合来传递信号。VEGFR2(Flk-1/KDR)是促血管内皮细胞增殖、迁移和有丝分裂过程主要的VEGF 信号转导受体[24],可通过下游PLCγ/Ca2+、MAPK 信号通路调节血管内皮细胞的增殖,通过Src、FAK 信号通路调节血管内皮细胞的迁移,通过PI3K/Akt 信号通路调节内皮细胞的存活。MiR-484 靶向VEGFA 抑制血管新生或许与这些信号通路有关[25]。
综上所述,活血益气方可促进HUVEC 增殖、迁移和成管,其机制可能与减轻miR-484 对HUVEC增殖、迁移、成管和VEGFA mRNA 表达的抑制作用有关,这可能是活血益气方促进血管新生的作用机制之一。然而活血益气方是否直接抑制miR-484尚不十分清楚。本课题组将在在今后的实验中进一步验证活血益气方通过miR-484 调控心肌梗死后血管新生的分子机制。
作者贡献度说明:
张冬梅:负责实验设计,实验指导及文章审校;赵梦竹,国倩倩:对实验提供技术指导;杨睿,程序,张馨月,刘梦华,魏琼负责实验实施、指标检测、数据分析;杨睿、程序:执笔撰写文章。
所有作者声明不存在利益冲突关系。

