霍山石斛抗炎及肿瘤细胞毒活性研究
李艳茹,陈箫箫,2,许凤清,3,王仁中,吴德玲,3*
(1.安徽中医药大学 药学院,安徽 合肥 230012; 2.六安市中医院 药剂科,安徽 六安 237000;3.安徽中医药大学 中药饮片制造新技术安徽省重点实验室,安徽 合肥 230012)
霍山石斛又名米斛,为兰科植物霍山石斛Dendrobium huoshanenseC.Z.Tang et S.J.Cheng 的新鲜或干燥茎。作为传统名贵中药在我国具有悠久的药用历史,具有益胃生津、滋阴清热等功效[1],被誉为“九大仙草”之首。霍山石斛主要分布于安徽省霍山县、金寨县等地[2],是我国兰科石斛类药材中的特有品种。
霍山石斛作为药食同源的中药材,具有抗炎[3]、抗氧化[4-6]、抗肿瘤[7-11]以及免疫调节[12-13]等药理活性。霍山石斛西洋参颗粒、霍山石斛胶囊等都是具有保健食品批准号的产品。霍山石斛的物质基础研究主要集中于现代分析手段对其中的联苄类、黄酮类及生物碱类成分进行辨识[14-17]。本研究在前期完成霍山石斛乙醇提取物的系统化学分离工作的基础上[18-19],研究霍山石斛各组分以及单体化合物的抗炎以及肿瘤细胞毒活性,以期为霍山石斛的深度开发提供参考。
1 材料
1.1 仪器与试药
FORMA 700 型超低温冰箱(美国Thermo 公司);Direct-Q with pump 型超纯水仪(美国Millopore 公司);SW-CJ-2FD 型超净化工作台(苏州净化设备有限公司);FACSCanto II 流式细胞仪(美国BD 公司);FA2104B 型分析天平(十万分之一,上海右一仪器有限公司);CO2培养箱(美国Thermo 公司);KH22R 型冷冻离心机(凯达科学仪器有效公司);SpectraMax i3x 型酶标仪(美谷分子仪器有限公司)。DCFH-D 试剂盒(Beyotime Biotechnology, China);NO检测试剂盒(碧云天生物技术有限公司);胎牛血清(FBS, GIBCO, Invitrogen Corporation,NY,USA);RPMI1640 培 养 基(GIBCO,Invitrogen Corporation,NY,USA);青霉素(Sigma,St.Louis,MO,USA);链霉素(Sigma,St.Louis,MO,USA);胰蛋白酶(Gibco,Grand Island,NY,USA);Griess Reagent(格里斯试剂)、LPS、L-NMMA(单精氨酸)、MTS、Cisplatin(顺式二胺二氯铂)、paclitaxel(紫杉醇)均购自Sigma 公司;小鼠单核巨噬细胞(RAW 264.7 细胞)、HL-60(人白血病细胞)、A-549(人肺癌细胞)、SMMC-7721(人肝癌细胞)、MCF-7(人乳腺癌细胞)、SW480(人结肠癌细胞)均购自American Tissue Culture Collection(ATCC,Rockville,MD,USA)。
霍山石斛购自安徽省霍山县长冲中药材开发有限公司,经安徽中医药大学刘守金教授鉴定为兰科植物霍山石斛Dendrobium.huoshanenseC.Z.Tang et S.J Cheng 的干燥茎。用于测试的单体化合物均来自于安徽中医药大学中药化学研究室。
2 方法
2.1 样品的制备
霍山石斛粗粉(9.8 kg),依次用95%和50%乙醇渗漉提取,合并渗漉液,减压回收溶剂得乙醇浸膏(1.6 kg)。浸膏加水溶解,依次用石油醚、乙酸乙酯、正丁醇萃取,浓缩回收溶剂,分别得到石油醚部分(425 g,编号为A,得率为4.3%)、乙酸乙酯部分(160 g,编号为B,得率为1.6%)、正丁醇部分(340 g,编号为C,得率为3.5%)和水层(减压回收至无醇味)。药渣粉末挥去乙醇后,加8倍量水煎煮2次,每次2 h,水煎液浓缩后,加乙醇至浓度达80%乙醇,静置,过滤,上清液浓缩后与萃取后的水层合并得水部分(1 042 g,编号为D,得率为10.6%)。利用各种色谱法(硅胶柱色谱、MCI 柱色谱、Sephadex LH-20柱色谱、ODS 反相柱色谱、高效液相制备色谱等)进行分离纯化得到化合物1 ~ 11,分别为aduncin C(1)、michehedyoside C(2)、3,4-二羟基-5-甲氧基 苯 甲 醛(3)、5-hydroxyisobenzofuran-1 (3H)-one(4)、柚皮素(5)、4,4'-二羟基-3,5-二甲氧基联苄(6)、钩状石斛素(7)、3,4,5-trimethoxyphenol-1-O-β-D-glucopyranoside(8)、(+)-syringaresinol-4-Oβ-D-glucopyranoside(9)、丁香脂素-4, 4'-O-β-D-二葡萄糖苷(10)、erythrosyringoylglycerol-4-O-β-Dglucoside(11)[19]。
2.2 抗炎活性
2.2.1 RAW 264.7 细胞培养 参考文献[20]的方法,并稍作调整。RAW 264.7 细胞接种于培养瓶中,采用含10% FBS 并加有青霉素(终浓度为100 U/mL)和链霉素(终浓度为100 μg/mL)的RPMI-1640 培养基,置于37℃、5% CO2培养箱中培养。当细胞融合至90%时,弃去培养基,加2 mL PBS洗涤细胞2次,弃去PBS 后加入2 mL 的0.25% (w/v) Trypsin-0.53 mM EDTA 混合消化液,置显微镜下观察约30 s,当细胞变圆后迅速加入2 mL 完全培养基终止消化,4℃以转速800 r/min 离心5 min,弃去上清液,收集细胞,用培养基重新悬浮细胞,分瓶培养,隔天换液。
2.2.2 RAW 264.7 细胞的ROS 测定 参考文献[21]的方法,并稍作调整。采用二氯荧光乙酰乙酸盐(DCFH-DA)荧光探针测定RAW 264.7 细胞内产生的ROS 含量。将对数生长期的细胞以1×106cells/孔接种于6 孔板上,置于37℃、5% CO2培养箱中培养,细胞80%融合后,空白组加入含等体积溶媒(0.1%DMSO)培养基处理RAW 264.7 细胞,模型组和给药组分别加入含LPS(200 ng/mL)的培养基孵育RAW 264.7 细胞2 h 后,将模型组更换为不含LPS的培养基孵育细胞24 h,将给药组更换为霍山石斛乙醇提取物以及不同极性部位样品(低、中、高剂量组终浓度分别为50、100、200 mg/mL)的培养基,继续孵育24 h。孵育结束后,按照分组情况分别收集细胞,将其放置在流式管中,每管加入0.5 mL 细胞培养液,重悬浮后再加入0.5 mL DCFH-DA 染色工作液,混匀,放置在37℃、5% CO2培养箱中孵育30 min 后,4℃以转速600 r/min 离心4 min,除去上清液,加入1 mL PBS 缓冲液洗涤两次,最后使用0.5 mL PBS 缓冲液悬浮细胞,30 min 内利用流式细胞仪在470/530 nm 下测定细胞内ROS 水平。
2.2.3 RAW 264.7 细胞内NO 的测定 参照“2.2.1”项下方法培养细胞。采用Griess 试剂显色法检测NO生成量[22]。实验方法参照“2.2.2”,将RAW 264.7 细胞接种至96 孔板,用1 μg/mL LPS 进行诱导刺激,同时加入霍山石斛乙醇提取物(终浓度为50 μg/mL)、不同极性部位(终浓度为50 μg/mL)和单体化合物1 ~ 11(终浓度为50 μmol/L)处理,阳性对照组加入NG-L-单甲基精氨酸单醋酸盐(L-NMMA,总NOS 抑制剂)(50 μmol/L)。孵育细胞24 h 后取培养基检测NO,在570 nm 处测定吸光度值(OD),计算各组分对NO 释放的抑制率。
2.3 体外抗肿瘤活性评价
2.3.1 5 株肿瘤细胞培养 HL-60、A-549、SMMC-7721、MCF-7 和SW-480 参照“2.2.1”项下方法培养,将培养基更换为含10% FBS 的RPMI-1640 培养基[23-24]。
2.3.2 测定肿瘤细胞的抑制率 参考文献[25]的方法,并稍作调整。采用MTS 法将细胞提前24 h 接种培养,以每孔3 000 ~ 15 000 个的细胞接种到96 孔板。空白对照组加入含等体积溶媒(0.1% DMSO)的培养基处理细胞,给药组分别加入霍山石斛乙醇提取物,不同极性部位样品100 μL (100 μg/mL)和单体化合物1 ~ 11(终浓度为40 μmol/L),阳性对照组分别加入Cis-platin 100 μL(40 μg/mL)和paclitaxel100 μL(5 μg/mL),每种处理均设3 个复孔。37℃条件下培养48 h 后,细胞贴壁后除去孔内培养液,在每孔内加MTS 溶液20 μL 和培养液100 μL,每个样品设3 个空白复孔(空白组,含MTS 溶液20 μL 和培养液100 μL 的混合液),继续孵育4 h,使用酶标仪(492 nm)测定各孔的吸光度值(OD),记录实验结果。
2.3.3 测定化合物6的IC50实验方法参照“2.3.2”,用不同浓度的单体化合物6(40、8、1.6、0.32、0.064μmol/L)处理HL-60、SMMC-7721、MCF-7 细胞。计算化合物6 的IC50值。
2.4 统计学方法
3 结果
3.1 霍山石斛乙醇提取物及不同极性部位对ROS 的影响
炎症的病理状态与细胞内ROS 的产生量密切相关,本研究采用DCFH-DA 荧光探针测定RAW 264.7细胞内ROS 的水平。与空白组相比,模型组(LPS 200 ng/mL)RAW 264.7 细胞内ROS 的水平明显升高(P<0.01)。与模型组相比,石油醚部位的低、中、高剂量组细胞内ROS 水平均降低,但差异无统计学意义(P>0.05),说明石油醚部位对细胞内ROS 水平的抑制作用较弱。与模型组相比,霍山石斛乙醇提取物和水部位的中、高剂量组细胞内ROS 的水平降低(P<0.05),说明上述部位对细胞内ROS 水平的抑制作用较强。与模型组相比,乙酸乙酯部位和正丁醇部位的低、中、高剂量组均能降低细胞内ROS的水平(P<0.05),说明乙酸乙酯部位和正丁醇部位与其它部位相比对细胞内ROS 水平的抑制作用较强,见图1。
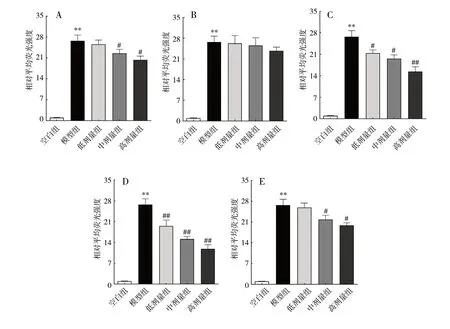
图1 霍山石斛不同提取部位对RAW 264.7 小鼠巨噬细胞的ROS 水平的影响(±s,n = 3)Fig.1 Effects of different extraction sites of D. huoshanense Tang et Cheng on ROS level of macrophages in RAW 264.7 cell lines(±s,n = 3)
3.2 霍山石斛乙醇提取物及不同极性部位对NO 的影响
NO是LPS诱导RAW 264.7细胞炎症模型过程中产生的一种重要的炎症介质,其产生量随着细胞炎症反应的增强而增加。本实验采用Griess 试剂显色法检测NO 生成量。阳性对照药L-NMMA 浓度为50 μmol/L,乙醇提取物及不同极性部位浓度均为50 μg/mL,测定结果见表1。霍山石斛乙醇提物以及不同极性部位对LPS 诱导的RAW 264.7 巨噬细胞内NO 生成均具有一定的抑制作用(P<0.05),其中,乙醇提取物、石油醚部位和正丁醇部位对NO 生成的抑制作用较弱,其NO 生成抑制率分别为16.05%、18.95%、15.75%。乙酸乙酯部位对NO 生成的抑制作用较强,NO 生成抑制率为26.39%(P<0.05)。
表1 霍山石斛乙醇提取物及其不同极性萃取部位对NO 生成抑制率(±s,n = 3)Tab.1 The inhibitory rate of ethanol extracts from D. huoshanense and its different polar extracts on NO production(±s,n = 3)

表1 霍山石斛乙醇提取物及其不同极性萃取部位对NO 生成抑制率(±s,n = 3)Tab.1 The inhibitory rate of ethanol extracts from D. huoshanense and its different polar extracts on NO production(±s,n = 3)
注:同列字母完全不同,表示差异有统计学意义(P <0.05),表2 ~ 4 同。
样品 抑制率/%L-NMMA 53.52±0.53a乙醇提取物 16.05±1.53c石油醚部位 18.95±2.54c乙酸乙酯部位 26.39±2.84b正丁醇部位 15.75±1.72c水部位 4.91±3.20d F 109.564 P 0.000
3.3 单体化合物对NO 生成的影响
对霍山石斛中分离得到的化合物1 ~ 11 进行LPS诱导的RAW264.7 巨噬细胞内抑制NO 活性筛选,阳性对照药L-NMMA 浓度为50 μmol/L,11 个化合物浓度均为50 μmol/L,测定结果见表2。化合物3 和化合物6 表现出较好的抑制NO 生成的作用,NO 生成抑制率分别为21.88%和23.32%。其它化合物在50 μmol/L 浓度下抑制NO 生成的作用均较弱。
表2 化合物NO 生成抑制率(±s,n = 3)Tab.2 Results of NO generation inhibition rate of compounds(±s,n = 3)
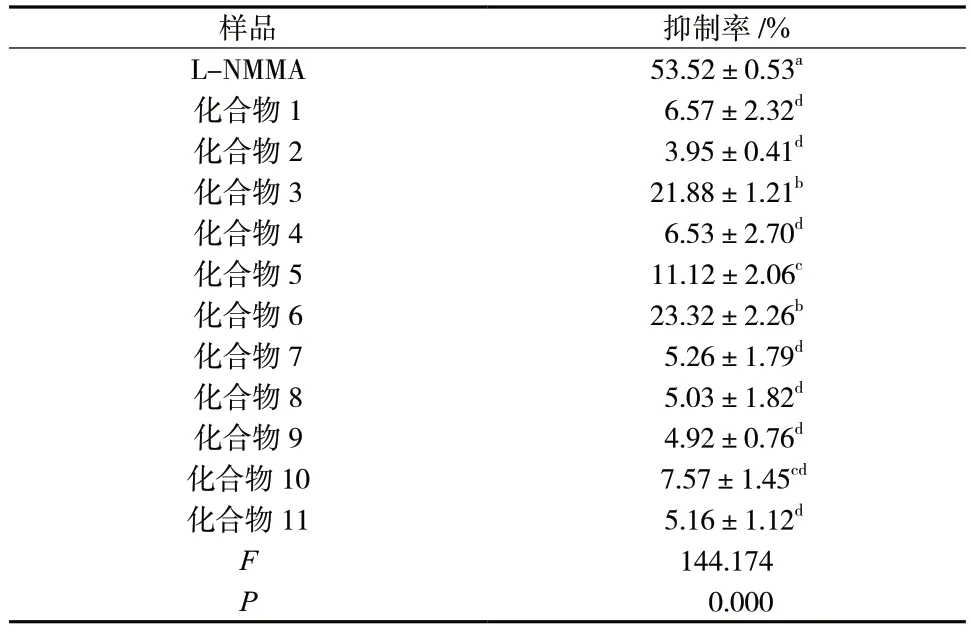
表2 化合物NO 生成抑制率(±s,n = 3)Tab.2 Results of NO generation inhibition rate of compounds(±s,n = 3)
样品 抑制率/%L-NMMA 53.52±0.53a化合物1 6.57±2.32d化合物2 3.95±0.41d化合物3 21.88±1.21b化合物4 6.53±2.70d化合物5 11.12±2.06c化合物6 23.32±2.26b化合物7 5.26±1.79d化合物8 5.03±1.82d化合物9 4.92±0.76d化合物10 7.57±1.45cd化合物11 5.16±1.12d F 144.174 P 0.000
3.4 霍山石斛乙醇提取物及不同极性部位对5 株肿瘤细胞的细胞毒性
本研究采用MTS 法对霍山石斛乙醇提取物及不同极性部位进行抑制细胞增殖活性筛选。阳性对照药Cis-platin 浓度为40 μg/mL,paclitaxel 浓度为5 μg/mL;乙醇提取物及不同极性部位浓度均为100 μg/mL。乙醇提物和石油醚部位均对除HL-60 细胞外的其他细胞具有一定的抑制细胞增殖的作用(P<0.05)。石油醚部位对A-549 细胞、SMMC-7721 细胞、MCF-7细胞、SW-480 细胞的细胞抑制率分别为49.76%、33.28%、31.40%、49.96%;其它部位也具较弱的抑制细胞增殖的作用,见表3。
表3 霍山石斛乙醇提取部位及其不同极性萃取部位对5 株肿瘤细胞的细胞抑制率(%,±s,n = 3)Tab.3 Cell inhibition rate of ethanol extracted parts of D. huoshanense and its different polar extraction sites on 5 tumor cells (%,±s,n = 3)
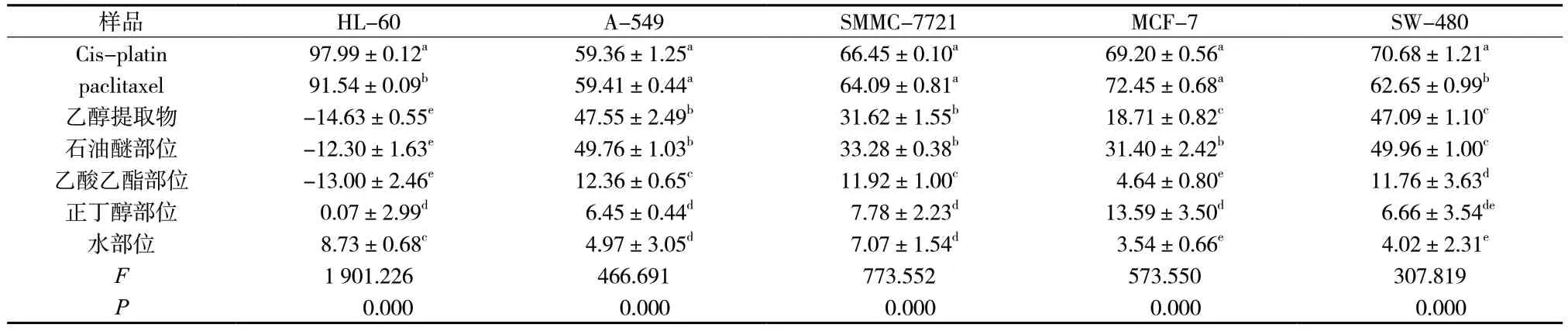
表3 霍山石斛乙醇提取部位及其不同极性萃取部位对5 株肿瘤细胞的细胞抑制率(%,±s,n = 3)Tab.3 Cell inhibition rate of ethanol extracted parts of D. huoshanense and its different polar extraction sites on 5 tumor cells (%,±s,n = 3)
样品 HL-60 A-549 SMMC-7721 MCF-7 SW-480 Cis-platin 97.99±0.12a 59.36±1.25a 66.45±0.10a 69.20±0.56a 70.68±1.21a paclitaxel 91.54±0.09b 59.41±0.44a 64.09±0.81a 72.45±0.68a 62.65±0.99b乙醇提取物 -14.63±0.55e 47.55±2.49b 31.62±1.55b 18.71±0.82c 47.09±1.10c石油醚部位 -12.30±1.63e 49.76±1.03b 33.28±0.38b 31.40±2.42b 49.96±1.00c乙酸乙酯部位 -13.00±2.46e 12.36±0.65c 11.92±1.00c 4.64±0.80e 11.76±3.63d正丁醇部位 0.07±2.99d 6.45±0.44d 7.78±2.23d 13.59±3.50d 6.66±3.54de水部位 8.73±0.68c 4.97±3.05d 7.07±1.54d 3.54±0.66e 4.02±2.31e F 1 901.226 466.691 773.552 573.550 307.819 P 0.000 0.000 0.000 0.000 0.000
3.5 单体化合物对5 株肿瘤细胞的细胞毒性
采用MTS 法对霍山石斛所分离得到11 个化合物进行抑制细胞增殖活性筛选,阳性对照药Cis-platin浓度为40 μg/mL,paclitaxel 浓度为5 μg/mL;化合物浓度均为40 μmol/L。化合物6 具有较好的体外抑制细胞增殖的作用,对HL-60、SMMC-7721 和MCF-7 三株肿瘤细胞的细胞抑制率依次为66.18%、59.47%、67.07%。其它化合物均具较弱的抑制细胞增殖的作用,见表4。
表4 单体化合物对5 株肿瘤细胞的细胞毒性 (±s,n = 3)Tab.4 Cytotoxicity of monomeric compounds on 5 tumor cell(±s,n = 3)
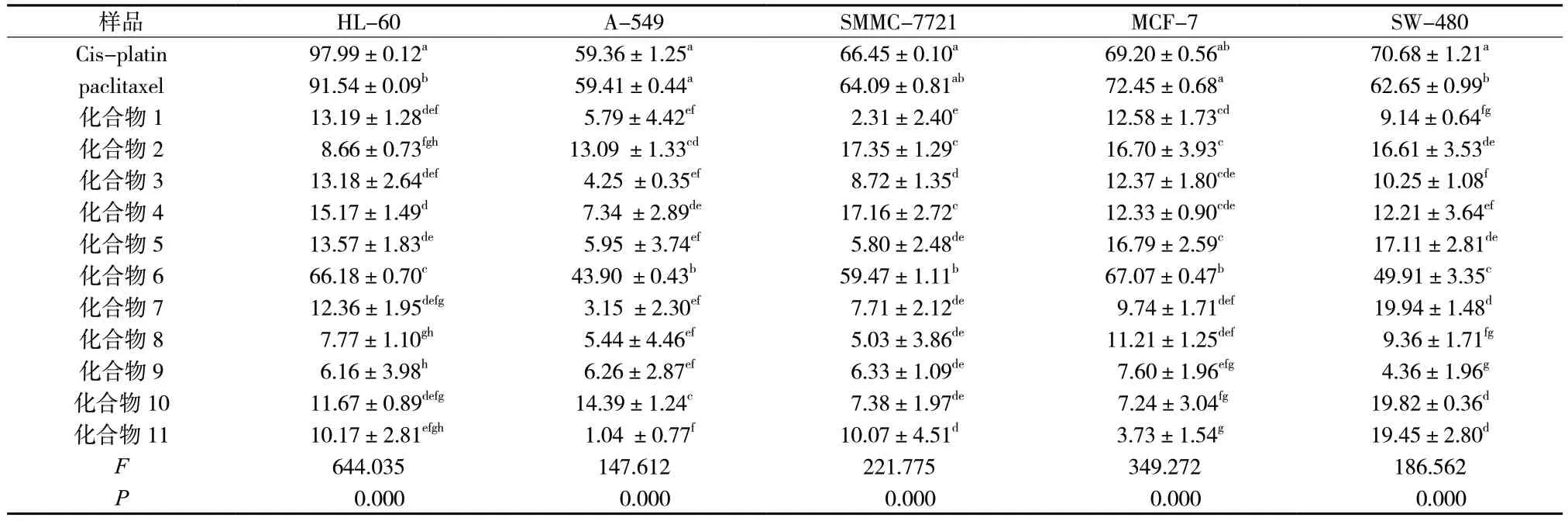
表4 单体化合物对5 株肿瘤细胞的细胞毒性 (±s,n = 3)Tab.4 Cytotoxicity of monomeric compounds on 5 tumor cell(±s,n = 3)
样品 HL-60 A-549 SMMC-7721 MCF-7 SW-480 Cis-platin 97.99±0.12a 59.36±1.25a 66.45±0.10a 69.20±0.56ab 70.68±1.21a paclitaxel 91.54±0.09b 59.41±0.44a 64.09±0.81ab 72.45±0.68a 62.65±0.99b化合物1 13.19±1.28def 5.79±4.42ef 2.31±2.40e 12.58±1.73cd 9.14±0.64fg化合物2 8.66±0.73fgh 13.09 ±1.33cd 17.35±1.29c 16.70±3.93c 16.61±3.53de化合物3 13.18±2.64def 4.25 ±0.35ef 8.72±1.35d 12.37±1.80cde 10.25±1.08f化合物4 15.17±1.49d 7.34 ±2.89de 17.16±2.72c 12.33±0.90cde 12.21±3.64ef化合物5 13.57±1.83de 5.95 ±3.74ef 5.80±2.48de 16.79±2.59c 17.11±2.81de化合物6 66.18±0.70c 43.90 ±0.43b 59.47±1.11b 67.07±0.47b 49.91±3.35c化合物7 12.36±1.95defg 3.15 ±2.30ef 7.71±2.12de 9.74±1.71def 19.94±1.48d化合物8 7.77±1.10gh 5.44±4.46ef 5.03±3.86de 11.21±1.25def 9.36±1.71fg化合物9 6.16±3.98h 6.26±2.87ef 6.33±1.09de 7.60±1.96efg 4.36±1.96g化合物10 11.67±0.89defg 14.39±1.24c 7.38±1.97de 7.24±3.04fg 19.82±0.36d化合物11 10.17±2.81efgh 1.04 ±0.77f 10.07±4.51d 3.73±1.54g 19.45±2.80d F 644.035 147.612 221.775 349.272 186.562 P 0.000 0.000 0.000 0.000 0.000
3.6 化合物6 的IC50 测定结果
化合物6 对HL-60、SMMC-7721 和MCF-7 细胞的IC50进行研究,实验结果所示,对HL-60、SMMC-7721 和MCF-7 细胞的IC50值分别为27.79 μmol/L、6.66 μmol/L 和25.01 μmol/L,见表5。
表5 化合物6 对3 株肿瘤细胞的IC50 测定结果(μmol/L,±s,n = 3)Tab.5 Determination results of IC50 to compound 6 on 3 tumor cells(μmol/L,±s,n = 3)
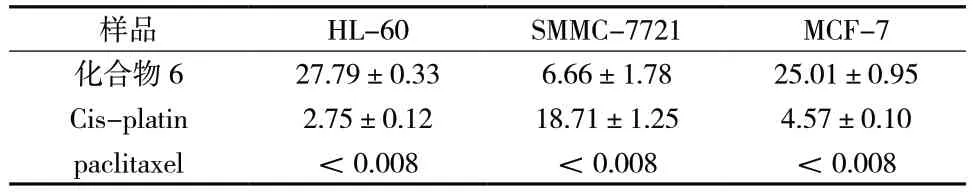
表5 化合物6 对3 株肿瘤细胞的IC50 测定结果(μmol/L,±s,n = 3)Tab.5 Determination results of IC50 to compound 6 on 3 tumor cells(μmol/L,±s,n = 3)
样品 HL-60 SMMC-7721 MCF-7化合物6 27.79±0.33 6.66±1.78 25.01±0.95 Cis-platin 2.75±0.12 18.71±1.25 4.57±0.10 paclitaxel <0.008 <0.008 <0.008
4 讨论
本实验通过LPS 诱导的细胞炎症模型(细胞内ROS 水平检测和抑制NO 生成活性)和MTS 法对霍山石斛各组分以及单体化合物进行抗炎以及抗肿瘤活性筛选。实验结果表明霍山石斛乙醇提取物具有一定降低ROS 水平以及抑制NO 生成的作用,石油醚部位对降低ROS 水平作用相对较弱,二者对除HL-60 细胞外的其它癌细胞均具有一定的抑制细胞增殖活性。与其它部位相比,正丁醇部位对降低ROS 水平作用较强并且呈现出剂量依赖性,乙酸乙酯部位抑制NO 生成的作用较强,说明霍山石斛各组分之间的生物活性存在差异。在11 个单体化合物中,化合物3 来自于石油醚部位、化合物6 来自于乙酸乙酯部位,二者抑制NO 生成的作用较好,并且化合物6 具有较好的体外抑制细胞增殖活性。化合物6 (4,4'-二羟基-2,5-二甲氧基联苄)为联苄类化合物,在之前的报道中,已有研究者从其它石斛中分离得到这一类化合物,发现这一类化合物在抗炎方面具有很好的生物活性[26-27]。
5 结论
通过对霍山石斛乙醇提取物、不同极性部位以及从中分离得到的单体化合物的抗炎以及抗肿瘤活性研究发现,霍山石斛的石油醚部位、乙酸乙酯部位和正丁醇部位与其它部位相比生物活性较强,后续可以重点研究。化合物3 和6 具有较好的抑制NO 生成的作用,并且化合物6 具有较好的体外抑制细胞增殖活性。本实验为霍山石斛后续化学成分、抗炎活性以及资源综合开发利用提供方向,但是药理活性研究目前处于浅显阶段,其作用机制有待进一步研究。

