葛根素治疗血管性痴呆作用机制研究进展
王 丹,史宏硕,王宗浩,彭 健,王春宝,司国民
(1.山东中医药大学 中医学院,山东 济南250014;2.山东省立医院 中医科,山东 济南 250000)
目前全球有近5 000 万人患有痴呆症[1],《2020—2050 年中国阿尔兹海默病患病情况预测研究》显示中国痴呆患者约占全球患者总数的25%[2]。血管性痴呆是唯一可以防治的痴呆类型,脑小血管疾病是其主要危险因素,会造成脑部神经元功能障碍和微血管损伤[3]。目前治疗血管性痴呆的方式有营养脑神经细胞、改善脑微循环、改善脑代谢、调脂稳斑及治疗原发疾病等,主要使用兴奋性氨基酸受体拮抗剂、乙酰胆碱抑制剂等药物,但均不能有效逆转血管性痴呆进程,远不能满足临床需要[4]。因此,寻找治疗血管性痴呆的有效药物是临床上亟待解决的问题。
近年来,中药材葛根及其主要活性成分葛根素在血管性痴呆的防治方面显示出了良好治疗效果[5]。气滞血瘀是痴呆发病的主要病机,葛根辛散通痹的作用在治疗痴呆中发挥重要作用。《本草经解》记载: “葛根辛甘和散,气血活,诸痹自愈”,明确了葛根疏通气血的疗效[6]。研究表明葛根素能够保护脑部神经血管功能,达到治疗血管性痴呆效果[7],现对葛根素治疗血管性痴呆的研究现状进行综述,为葛根素新药开发利用提供参考。
1 葛根素促进神经元功能恢复
1.1 抑制神经元凋亡信号通路
血管性痴呆患者神经元凋亡与多条信号通路有关,PI3K/Akt 是调控神经元凋亡的重要信号通路。当膜外信号激活PI3K 通路时,能使其转移到胞膜及磷脂肌醇激酶磷酸化,造成Caspase3、糖原合成酶激酶3β(GSK3β)、抗凋亡蛋白B 细胞淋巴瘤-2(Bcl-2)等蛋白增加[8]。JNK 则属于丝裂原活化蛋白激酶通路信号通路,可直接使其核内转录因子活性增强,加速Caspase 的级联反应,使细胞凋亡[9]。P53 作为细胞周期负性调节因子,可上调Bax 表达,加快细胞凋亡[10]。Bcl-2 和Bax 可形成异源二聚体,反之可加速促进细胞凋亡[11]。
葛根素可基于多条信号通路抑制神经元凋亡。MAOR-NOF M 等发现葛根素能通过激活PI3K/Akt1/GSK3β 信号通路,使血管性痴呆大鼠模型中Bcl-2蛋白表达上调,抑制Bax、Caspase-3 表达[12]。葛根素又能通过上调microRNA-214 基因表达,激活PI3K/Akt 信号通路,上调Bcl-2/Bax 比值,直接抑制caspase-3 和caspase-9 表达[13]。陈媛等[14]研究表明葛根素可抑制Janus 激酶信号传导和转录激活因子信号通路,降低P53 蛋白表达。YANG W 等[15]研究表明葛根素通过抑制NMDAR 通路,使Bax 及Bax/Bcl-2比值降低,减轻细胞内Ca2+超载和氧自由基累积。
1.2 抑制神经元自噬信号通路
MTOR/AMPK 及JNK 信号通路在神经元自噬方面发挥重要作用。其中,mTOR 属于磷脂酰肌醇激酶相关激酶,mTORC1 可增强相关蛋白磷酸化及防止Unc-51 样激酶1 的外源活化,减少自噬泡形成[15]。而AMPK 信号通路能通过磷酸化肿瘤抑制因子抑制TSC1/TSC2 下游靶点mTORC1,起到达到负性调控mTOR,抑制神经元自噬发生[15]。JNK 信号通路则能激活c-Jun 、c-Fos 蛋白,增强Beclin1 转录活性,使Bcl-2 磷酸化及与Beclin1 分离,促使自噬发生[16]。其中Beclin1 可将微管相关蛋白3(LC3)转化为LC3-II,是细胞自噬的重要标志[17]。P62 是典型的自噬受体,其与自噬程度呈负相关。AMPK 则是启动细胞能量重要平衡机制[18]。
汪露等[19]研究发现,葛根素可抑制JNK/MAPK信号通路,降低磷酸化p-JNK-1 /JNK-1、p-JNK-2 /JNK-2 及LC3-II/LC3-I 比值,上调p62 蛋白表达。FÎLFAN M 等[20]研究发现葛根素能通过抑制AMPK/mTOR 信号通路,降低LC3、Beclin-1 表达及 LC3-II/LC3-I 比值,增加p62 蛋白表达。葛根素又能使Bcl-2 蛋白上调结合Beclin1,形成稳定的复合体,抑制自噬发生[21]。
1.3 清除脑内Aβ
Aβ 形成斑块样沉积是引发神经退行性病变的核心原因[22]。Aβ 是由淀粉样前体蛋白切割而成,淀粉样前体蛋白使由β-淀粉样前体蛋白水解酶1(BACE-1)酶切割为Aβ40及Aβ42[23],其中,Aβ40可加重脑部血管样病变,Aβ42则聚集成寡聚体[23]。脑部脑啡肽酶、胰岛素降解酶等降解酶的活性常受到Aβ 抑制而活性降低[23]。Aβ 又能诱导神经元内微管Tau 蛋白过度磷酸化,加重神经变性坏死[24]。BACE-1 被视为最重要的β 分泌酶,淀粉样前体蛋白可经BACE-1 生成 sAPPβ 和C99,C99 则在γ 分泌酶作用下生成Aβ[25]。胰岛素降解酶则作为Aβ 降解酶,进一步降解内源性Aβ[26]。
葛根素可基于多条信号通路清除脑内Aβ 聚集。GOURAS G K 等[27]研究表明葛根素不仅通过PKB/Akt 信号通路抑制GSK-3β 表达,减轻Aβ25-35继发的氧化应激反应。蔡巧英等[28]发现,葛根素能通过抑制NF-kB 信号通路,抑制由Aβ25-35诱导小鼠BV-2 小胶质细胞中炎性因子一氧化氮的产生、核转录因子kBp65 及诱导型一氧化氮合酶表达。葛根素也能通过抑制Aβ25-35诱导GSK-3β 表达,并激活Wnt/β-catenin 信号通路,减轻Tau 蛋白磷酸化[29]。另外,实验证明葛根素能显著改善双侧血管性痴呆大鼠的学习记忆能力,提示葛根素可以抑制BACE-1活性表达,增强胰岛素降解酶基因表达[30]。SATO N等[31]研究也证明,葛根素治疗可以抑制Aβ1-42诱导血管性痴呆大鼠脑部丙二醛(MDA)水平升高及超氧化物歧化酶(SOD)水平降低,恢复脑源性神经营养因子(BDNF)水平。
1.4 改善神经突触可塑性
突触可塑性相关蛋白的表达变化可反映突触功能并影响突触传递[32]。大脑树突棘形态和密度有高度的动态变化,会经历发生、修剪、成熟、消失4 个阶段[33]。其中BDNF 和NMDAR 是参与突触传递的重要分子[33]。突触素1 作为BDNF 介导轴突生长的下游分子蛋白,与突触的可塑性密切相关[34]。神经元NMDAR 受体表达上调,可促使BDNF 转录表达,使γ-氨基丁酸释放障碍,可激活PKC 信号途径,在脑内长时程增强效应中发挥作用[34]。
WU L 等[35]研究表明葛根素可改善血管性痴呆大鼠海马区突触形态学结构,有效促进树突棘生长,可直接影响神经元间信息传递的效率和信息储藏及传递能力。张冰清等[36]在脑缺血再灌注所致血管性痴呆大鼠模型中发现,葛根素可显著增强长时程增强效应诱导率,促进BDNF 表达及突触素1 磷酸化,提高突触传递效能可塑性。
1.5 调节神经递质
肾上腺皮质激素和兴奋性氨基酸的变化是导致血管性痴呆认知障碍发生的关键[37]。兴奋性氨基酸和抑制性氨基酸在脑内维持兴奋和抑制平衡,兴奋性氨基酸可急剧增高产生神经毒性,影响神经元突触后膜上NMDA 受体产生的长时程增强效应,可影响学习记忆能力[37]。肾上腺皮质激素由胆碱乙酰转移酶合成,血管性痴呆患者海马区可出现乙酰胆碱酯酶活性增高及胆碱乙酰转移酶活性下降情况[38]。
纪慧等[39]研究发现葛根素能抑制大脑皮层和海马区内肾上腺皮质激素活性,可降低乙酰胆碱酯酶水解肾上腺皮质激素能力,同时提高细胞Na+-K+-ATP酶活性,可稳定钾离子通道及抑制钙通道的开放,减少Ca2+通过L 型通道内流线粒体内钙超载。脑梗死是血管性痴呆的主要病因,韩进等[40]通过实验证明,病变大鼠脑内谷氨酸和天门冬氨酸比值增高,而兴奋性氨基酸升高幅度与脑缺血程度成正比,使用葛根素能通过抑制过度激活NMDA 受体,降低天门冬氨酸、谷氨酸浓度,使抑制性氨基酸Tau 蛋白、γ-氨基丁酸含量降低,避免神经损伤发生。
2 葛根素促进损伤血管功能恢复
研究表明血管性痴呆患者脑白质存在缺血区,可使免疫细胞能浸润并释放多种促炎细胞因子,造成血脑屏障通透性增加、内皮细胞损伤及血管功能紊乱[41]。血脑屏障是高度特化的内皮细胞膜,其高度选择性使其可控制转运血脑两侧物质[42]。脑血管内皮细胞可以封闭血管内皮细胞之间缝隙[42],其与神经元、胶质细胞构成脑部神经血管单元,发病初期脑部缺血缺氧,导致神经元活动与血管的反应功能不匹配,紊乱的神经血管单元可引起神经炎症和细胞焦亡[43]。
丁小丽等[44]研究表明葛根素可有效抑制血管性痴呆大鼠大脑皮质中神经元型一氧化氮合酶、一氧化氮合酶、基质金属蛋白酶-9、白蛋白基因及一氧化氮含量水平升高,提示葛根素能通过抑制氧化应激反应,减轻大鼠血脑屏障损伤。马鹍鹏等[45]通过实验证明葛根素可以减轻脑缺血再灌注造成的血脑屏障超微结构损伤和通透性增加。孙姝婵等[46]则发葛根素能调节NLRP3/Caspase-1/GSDMD 通路,抑制血管内皮细胞迁移、改善H2O2引起的内皮细胞损伤,同时降低消皮素D-N 端蛋白、天冬氨酸蛋白水解酶-1、Nod 样受体蛋白及P2X7 受体蛋白的表达。何苗[47]研究发现,葛根素还能上调血管内皮生长因子、血管紧张素Ⅰ及酪氨酸激酶-2 受体基因表达,使损伤的血管内皮细胞的新生,防止炎症因子渗透。
3 葛根素可降低氧化应激和炎症反应
炎症反应和氧化应激被认为是血管性痴呆发展过程中的重要启动因素[48]。脑部炎症可进一步通过调控神经胶质细胞改变神经元传导及兴奋性[48]。肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)作为炎症发生的启动因子,能诱导产生IL-6、IL-8 等促炎因子,激活NF-κB 通路,使M1 胶质细胞产生神经毒素[49]。
汪春燕等[50]研究发现,葛根素可显著降低血管性痴呆大鼠模型细胞间黏附分子-1(ICAM-1)、IL-6、IL-1β、TNF-α 水 平。LIAN D 等[51]发 现,葛根素可抑制减轻由高糖诱导NOD 样受体热蛋白3炎性小体激活,抑制caspase-1 产生。WANG J 等[52]通过实验证明葛根素能显著抑制血管性痴呆大鼠脑部NF-κB p65 表达,上调PI3K 和Akt 相关蛋白水平及降低TNF-α、IL-1β 及IL-6 水平。
研究表明血管性痴呆发病后的脑部缺血缺氧能诱发氧化应激反应,活性氧自由基产生可加重血脑屏障的通透性及Aβ 沉积[53]。MDA 则是ROS 与膜磷脂脂肪酸发生过氧化反应的产物,为机体氧化应激标志物[54]。而SOD 作为机体的抗氧化酶,不仅能调控过氧化氢酶或谷胱甘肽过氧化物酶抑制氧化应激损伤,又可以抑制NO 形成及血小板黏附聚集[54]。核因子E2 相关因子被激活后,能转移至细胞核内,诱导下游抗氧化基因血红素加氧酶-1(HO-1)转录表达,可进一步催化降解ROS、NO[54]。
葛根素能激活TRPM2/NMDAR 信号通路,下调血管性痴呆大鼠脑部ROS、MDA 水平,上调SOD 水平,使NR2A 蛋白表达增加[54]。ZHU T 等[55]研究发现葛根素能降低血管性痴呆大鼠脑部MDA、谷胱甘肽过氧化物酶水平,显著清除ROS,增加E2 相关因子2、叉头框蛋白O 等蛋白表达。ZHOU Y 等[56]研究则发现,葛根素能通过激活Akt/GSK-3β 信号通路,降低MDA 水平,上调GSH 及HO-1 蛋白表达。此外,朱慧渊[57]发现葛根素可以直接降低血管性痴呆大鼠脑部NO、NOS 水平。刘晓丽等[58]也证明葛根素能抑制小胶质细胞过度增殖,减少脑部TNF-α 和L-1β 表达。
血管性痴呆以其复杂的脑部神经血管损伤严重影响患者的预后和恢复,葛根素通过调节神经递质、改善神经突触可塑性、抑制神经元凋亡、抑制神经元自噬及清除脑内Aβ 等途径促进患者神经血管功能恢复,见图1。
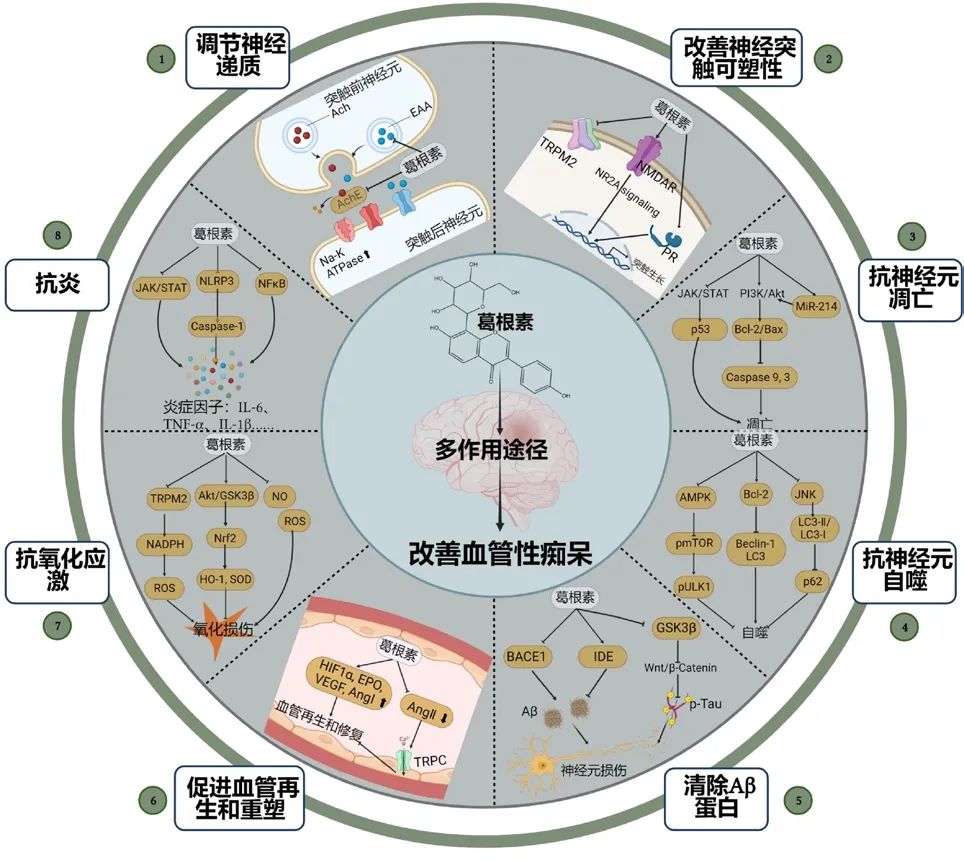
图1 葛根素治疗血管性痴呆作用机制Fig.1 Mechanism of action of puerarin in treatment of vascular dementia
4 结语
葛根素对于血管性痴呆的治疗机制以抑制神经元凋亡和清除脑内过多的Aβ 为主。在其介导的抑制神经元凋亡机制中,主要通过激活PI3K/Akt1/GSK-3β 信号通路,抑制凋亡蛋白表达。同时,葛根素不仅直接使脑内Aβ 生成减少,还能间接减轻Aβ 异常沉积造成的氧化应激、炎症等神经毒性反应,充分体现了葛根素多途径、多靶点防病治病优势。
近年来研究发现,葛根素在治疗血管性痴呆方面具有较高的应用价值。葛根素除能促进血管性痴呆患者神经血管功能恢复外,在抑制铁死亡、影响肠道微生物改善脑肠轴等方面也可以发挥疗效。目前对于葛根素的研究局限于基础研究,具体调控信号通路方面证据仍不足;另一方面,葛根素直接应用在体内具有较低的溶解度和生物利用度,临床应用研究相对较少。因此,在今后的研究中应使用网络药理学等现代技术,明确葛根素治疗血管性痴呆的作用靶点及信号通路,探索使用葛根素新剂型,采用大样本临床研究,为葛根素的临床应用提供可靠依据。

