莱菔硫烷抑制转化生长因子β1诱导的大鼠心肌纤维化的机制
张莉,张磊,王艳梅,章辰琛,王鑫
(皖西卫生职业学院临床医学系,安徽六安 237005)
心血管疾病是我国疾病死亡的主要原因,许多心脏疾病治疗过程中都会出现心肌纤维化[1-2]。莱菔硫烷(sulforaphane,SFN)是我国的传统中药,主要存在于十字花科植物,如西兰花、甘蓝、花椰菜等[3]。SFN的有效成分是异硫氰酸盐,具有抗氧化、抗炎、抗癌、诱导凋亡等作用,对心血管、神经和癌症等疾病均具有预防治疗的潜力[4-5]。SFN尚具有抑制心肌、结膜、肝的纤维化的功能[6-8],但是其发挥作用的具体机制尚不十分清楚。本研究拟以心肌成纤维细胞为研究对象,检测SFN对其增殖、侵袭、氧化应激和纤维化的影响,并揭示其与TGFβ1/Smads信号通路之间的关系。
1 材料与方法
1.1 实验动物 10周龄普通级雌性SD大鼠3只,体重(220±30)g,购自广东医学实验动物中心,实验动物许可证号:SCXK(皖)2019-0004。适应性喂养1周。本研究符合实验动物的伦理原则。
1.2 材料 SFN(货号:S10740)购自上海吉至生化科技有限公司;TGF-β1(货号:TR-1003-50UL),购自上海浩然生物公司;DMEM培养基购自美国Gibco公司;Transwell小室购自美国Corning公司;兔抗人MMP-9、α-SMA、ColⅠ、ColⅢ、TGF-β1、p-Smad3、p-Smad2、Smad2/3抗体均购自上海艾博抗公司;辣根过氧化物酶标记的二抗购自北京博尔西科技公司;活性氧(ROS)、丙二醛(MDA)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)检测试剂盒均购自上海碧云天生物技术有限公司。
1.3 方法
1.3.1 细胞的分离培养 30 mg/kg的剂量腹腔注射3%戊巴比妥钠麻醉正常饲养的大鼠,无菌摘取心脏,放入青霉素小瓶中。再将心脏剪成约1 mm3的小碎块,均匀铺在培养瓶底部,用含15%胎牛血清的DMEM 培养基倒置培养,4 h翻转瓶身,每隔1 d更换1次培养液。直至细胞生长至铺满瓶底,进行传代。使用传至3代的心肌成纤维细胞用于本研究。
1.3.2 实验分组与处理 将培养的心肌成纤维细胞分为对照组、TGF-β1组及SFN处理组(5、10、20 μg/ml)。对照组为正常培养的心肌成纤维细胞;TGF-β1 组为10 ng/ml TGF-β1处理的心肌成纤维细胞;SFN处理组为使用5、10、20 μg/ml的SFN联合TGF-β1共同处理的细胞。
1.3.3 CCK8法检测细胞的活性 细胞培养48 h后调整浓度至1×105个/ml。将细胞悬液接种于96 孔板中,100 μl/孔,培养12 h 使其充分贴壁于96 孔板后,加入新鲜培养基并予以相对应的刺激处理,分别培养12 、24、48 h。弃去旧液加10 μl CCK-8溶液,孵育2 h 后于酶标仪490 nm 处测吸光度。每个样本设置3个重复,实验重复3次。
1.3.4 Transwell法检测细胞迁移 先对需要检测的细胞用不含血清的培养液饥饿处理12 h,将细胞调整至105个/ml,待用。取200 μl细胞涂抹在小室的上室表面,下室加入500 μl含营养因子血清的培养液,37 ℃常规培养12 h。用结晶紫溶液染色后,显微镜下观察发生迁移的细胞数量,计数、取平均值。
1.3.5 Western blot法检测细胞中MMP-9、α-SMA、Col Ⅰ、 Col Ⅲ、 p-Smad3、 p-Smad2、 Smad4、Smad2/3的蛋白表达 将培养至对数生长期的细胞用细胞裂解液在冰上充分裂解,提取总蛋白。对蛋白进行定量、沸水浴变性处理后,用上清液作为蛋白电泳的上样模板。电泳结束后,琼脂胶上的蛋白用转膜仪在4 ℃环境下,采用湿转法转移到PVDF膜。将膜在室温下用2%的脱脂奶粉封闭30 min,在将膜浸入一抗稀释液(兔抗人MMP-9、α-SMA、Col Ⅰ、Col Ⅲ、TGF-β1、p-Smad3、p-Smad2、Smad2/3抗体)(1∶1 000~1∶2 500)孵育过夜(4 ℃),取出膜充分清洗。接着将膜浸入二抗稀释液(辣根过氧化物酶标记的二抗)(1∶500),37 ℃孵育2 h,洗涤。滴加ECL显色液进行显影,曝光。蛋白的相对表达量用目的蛋白的灰度值与β-actin的灰度值之间的比值表示。
1.3.6 ELISA法检测细胞上清液中氧化应激相关因子的含量 收集需要检测的细胞上清液,使用ROS、MDA、GSH、SOD试剂盒检测不同组细胞上清液中ROS、MDA、GSH、SOD的含量。实验重复3次,每次做3个复孔。
1.4 统计学方法 采用SPSS 22.0软件进行统计学分析。计量资料采用均数±标准差表示,多组比较采用单因素方差分析,组内比较采用LSD-t检验;2组比较使用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 SFN对TGF-β1诱导心肌成纤维细胞增殖的影响 与对照组比较,TGF-β1组细胞在24、48、72 h时的细胞增殖均显著升高(P<0.05);与TGF-β1组比较,5、10、20 μg/ml SFN组细胞在24、48、72 h时的增殖均显著降低(P<0.05)。见表1。
表1 SFN抑制TGF-β1诱导的心肌成纤维细胞增殖(±s,n=3)

表1 SFN抑制TGF-β1诱导的心肌成纤维细胞增殖(±s,n=3)
注:与对照组比较,1)P<0.05;与TGF-β1组比较,2)P<0.05
?
2.2 SFN抑制TGF-β1诱导的心肌成纤维细胞迁移 与对照组(87±5)比较,TGF-β1组细胞发生迁移的个数为(233±17),显著升高(P<0.05);与TGF-β1组比较,5、10、20 μg/ml SFN组细胞发生迁移的个数显著降低[分别为(181±22、161±18、156±12)](P<0.05)。
2.3 SFN抑制TGF-β1诱导的心肌成纤维细胞中MMP-9、α-SMA、ColⅠ、ColⅢ蛋白表达 与对照组比较,TGF-β1组细胞中MMP-9、α-SMA、ColⅠ、ColⅢ蛋白表达水平显著升高(P<0.05);与TGF-β1组比较,5、10、20 μg/ml SFN组细胞中MMP-9、α-SMA、ColⅠ、ColⅢ蛋白表达水平显著降低(P<0.05)。见图1、表2。

图1 SFN抑制TGF-β1诱导的心肌成纤维细胞中MMP-9、α-SMA、ColⅠ、ColⅢ蛋白的表达
表2 SFN对MMP-9、α-SMA、ColⅠ、ColⅢ蛋白表达的影响(±s,n=3)
注:与对照组比较,1)P<0.05;与TGF-β1组比较,2)P<0.05
?
2.4 SFN对TGF-β1诱导的心肌成纤维细胞氧化应激的影响 与对照组比较,TGF-β1组细胞中ROS、MDA的表达量显著升高,GSH、SOD的表达量显著降低(P<0.05)。与TGF-β1组比较,5、10、20 μg/ml SFN组细胞ROS、MDA的表达量显著降低(P<0.05),GSH、SOD的表达量显著升高(P<0.05)。见表3。
表3 SFN对氧化应激相关因子表达的影响(±s,n=3)

表3 SFN对氧化应激相关因子表达的影响(±s,n=3)
注:与对照组比较,1)P<0.05;与TGF-β1组比较,2)P<0.05
?
2.5 SFN对TGF-β1/Smads信号通路活性的调控 与对照组比较,TGF-β1组细胞中TGF-β1、Smad2/3蛋白表达水平显著升高(P<0.05),p-Smad3、p-Smad2的蛋白表达显著降低(P<0.05);与TGF-β1组比较,5、10、20 μg/ml SFN 组细胞TGF-β1、Smad2/3的蛋白表达水平显著降低(P<0.05),p-Smad3、p-Smad2的蛋白表达显著升高(P<0.05)。见图2、表4。
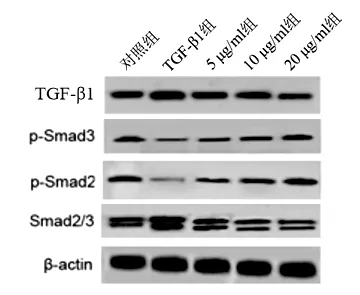
图2 SFN对TGF-β1/Smads 信号通路关键蛋白表达的影响
表4 SFN对TGF-β1/Smads 信号通路关键基因蛋白表达的影响(±s,n=3)
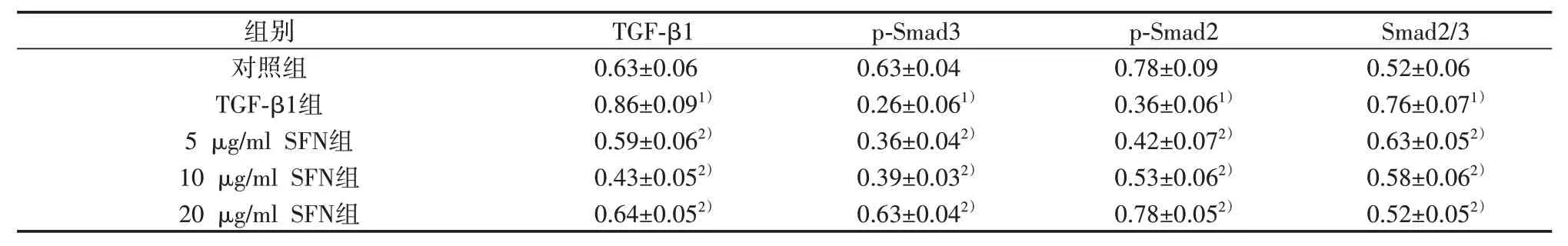
表4 SFN对TGF-β1/Smads 信号通路关键基因蛋白表达的影响(±s,n=3)
注:与对照组比较,1)P<0.05;与TGF-β1组比较,2)P<0.05
?
3 讨论
心肌成纤维细胞发生纤维化的标志物有ColⅠ、ColⅢ、α-SMA等[9]。SFN在动物实验研究中应用普遍。胡丽贞等[10]的研究发现,SFN预处理高脂肪损伤的心肌细胞能够显著地增强受损心肌细胞的活力,抑制氧化应激反应,上调线粒体膜电位、线粒体琥珀酸脱氢酶活性;不仅如此,SFN预处理高糖诱导的损伤心肌细胞后,线粒体琥珀酸脱氢酶活性上调、线粒体膜电位也均显著升高,ROS含量明显降低。这证明,SFN对体外培养的心肌细胞具有保护作用。饶兰兰等[11]制作心肌缺血再灌注损伤的大鼠模型,用SFN治疗后,心脏组织心肌梗死面积明显降低,大鼠血清中4项心肌酶含量均明显降低,心肌细胞凋亡率明显降低。伊雪等[12]在大鼠心脏移植缺血再灌注损伤的研究中报道,SFN处理的大鼠心肌组织中p-Akt和p-GSK-3β表达异常上升,揭示SFN减轻心脏移植缺血再灌注损伤的机制与Akt/GSK-3β信号通路的活性相关。本研究发现,5、10、20 μg/ml SFN均抑制TGF-β1诱导的心肌成纤维细胞增殖和迁移,抑制细胞的氧化应激反应和纤维化标志物α-SMA、ColⅠ、ColⅢ的蛋白表达水平,证实SFN在体外对心肌成纤维细胞纤维化的抑制作用。
TGF-β1、p-Smad3、p-Smad2作为TGF-β1/Smads信号通路的关键因子,对信号通路的活性至关重要[13]。据报道,TGF-β1促进多种组织发生纤维化[14-16],其主要通过TGF-β1/Smad信号通路发挥作用。石斌豪等[17]的研究发现,在心肌梗死中,TGF-β1/Smads信号通路的活性异常升高,促进成纤维细胞转化为纤维细胞,揭示TGF-β1/Smads信号通路抑制剂的研发在心肌梗死后的纤维化中的治疗价值。牛丕莲等[18]的研究发现,在TGF-β1诱导的心肌成纤维细胞纤维化中,TGF-β1/Smads信号通路活性异常升高,而枸杞中绿原酸处理后,该信号通路的活性得到抑制,成纤维细胞的增殖和纤维化程度均明显降低,说明枸杞中绿原酸发挥抑制心肌成纤维细胞纤维化的功能与失活TGF-β1/Smads信号通路有关。本研究发现,SFN也呈浓度依赖性抑制TGF-β1、p-Smad3、p-Smad2、Smad4的表达,失活TGF-β1/Smads信号通路的活性,发挥与枸杞中绿原酸相似的作用。这些结果揭示SFN的抑制TGF-β1诱导的心肌成纤维细胞增殖、迁移、氧化应激和纤维化功能与其对TGF-β1/Smads信号通路活性的抑制相关。
综上所述,SFN可抑制TGF-β1诱导的心肌成纤维细胞增殖、迁移、氧化应激和纤维化,其作用机制之一为抑制TGF-β1/Smads信号通路的活性,为SFN用于临床治疗心脏疾病奠定理论基础。

