超声促进葡聚糖-酪蛋白磷酸肽接枝及其递送钙的应用
修 雨,靳浩文,王紫冰,张曹雅馨,宁 新,李书红
(天津科技大学食品科学与工程学院,天津300457)
钙及其化合物支持着机体的各种运动,从生命诞生起就对生命活动起着极其重要的作用.人类对钙及其化合物的认识越来越清晰,对其利用也越来越细化[1].钙离子在神经传导、细胞内代谢和骨骼结构支持中发挥重要作用.钙缺乏会引起骨质疏松症、高血压、佝偻病[2].人体对钙的吸收受到限制,是由于在胃肠道消化过程中形成不溶性钙盐沉淀,降低了钙的生物利用度[3].为了提高钙的生物利用度,将钙离子和有机配体形成配合物,构建营养递送体系,可达到提高钙的稳定性和生物利用度的目的[4].肽螯合钙不仅可以用作钙的强化,而且有利于机体氨基酸的补充.
酪蛋白磷酸肽(casein phosphopeptide,CPP)是由酪蛋白衍生而来的磷酸化生物活性肽,活性中心可以螯合钙形成可溶且稳定的配合物,促进钙的吸收[3].牛奶和乳制品是具有良好功能活性的生物活性肽的潜在来源[5],但是酪蛋白磷酸肽容易受到蛋白酶、胰酶和胃酸的影响,导致活性中枢失活,直接影响肠道钙的吸收.因此,构建稳定可控的消化道递送材料,用于递送肽钙螯合物,已引起越来越多的关注.
近年来,利用蛋白质和多糖等生物大分子组装保护性的缓释载体有较高的物理化学稳定性,可以降低机体内各种生物活性化合物的反应速率或释放速率.由于葡聚糖呈电中性而阻止了静电络合物的形成,所以它被广泛用于蛋白质糖基化结合.蛋白质-葡聚糖共聚物在食品系统中可能具有提高最终产品质量的潜力[6].多糖作为屏障可以防止酶的降解,而蛋白质用于提供亲和力来结合生物活性化合物[7].糖接枝法作为广泛用于提高蛋白质或多肽的特性的方法,在接枝过程中发生了美拉德反应,然而由于反应进程慢和接枝率较低等问题,使其在食品工业化生产中的应用受到限制.超声处理作为一种新的绿色环保的加工技术,其特有的空穴作用可产生巨大的压力、剪切力、湍流和激烈的搅拌.王忠合等[8]用超声波加速反应进程以及强化提取过程[9],不仅可以改变蛋白质的构象和特性,而且可以改善反应条件,加快反应速率,提高反应产率,具有能够较好地保留食品自身特性等优点.
为了提高葡聚糖和CPP接枝反应的速率和程度,使其更广泛地应用于钙离子递送中,本研究选择中性多糖葡聚糖与CPP通过美拉德反应进行共价结合制备葡聚糖-CPP共聚物,通过超声控制美拉德反应进程,促进二者接枝率的提高,并对葡聚糖-CPP共聚物的微观结构进行分析.构建葡聚糖-CPP-Ca2+递送体系,研究分析葡聚糖-CPP-Ca2+递送体系在不同环境中的稳定性及其微观结构,旨在为蛋白质与多糖共聚物作为钙递送体系的应用与完善奠定基础.
1 材料与方法
1.1 材料
葡聚糖(相对分子质量2×104),上海源叶生物科技有限公司;CPP,上海麦克林生化科技有限公司;氯化钙,天津化学试剂一厂;十二烷基硫酸钠(SDS)、乙二胺四乙酸(EDTA)、胃蛋白酶、胰蛋白酶,北京索莱宝生物科技有限公司;去离子水,实验室自制;邻苯二甲醛(OPA)、磷酸二氢钠、磷酸氢二钠、硼酸、β-巯基乙醇等试剂均为分析纯试剂.
RS-232型电子分析天平,丹纳赫传感工业控制有限公司;TDL-5-A型离心机,上海安亭科学仪器厂;722型紫外-可见分光光度计,上海光谱仪器有限公司;JP-040ST型超声波清洗机,深圳市洁盟清洗设备有限公司;HH型数显恒温水浴锅,金坛市金城国胜实验仪器厂;FD-10型真空冷冻干燥机,北京德天佑科技发展有限公司;透析袋(截留相对分子质量为8×103~1.4×104、500),上海源叶生物科技有限公司;SU1510型扫描电子显微镜,日本日立株式会社;TENSOR 27型傅里叶变换红外光谱仪,布鲁克仪器有限公司.
1.2 实验方法
1.2.1 葡聚糖-CPP共聚物的制备
准确称量一定量CPP和葡聚糖,分别加入pH 7.0、0.2mol/L磷酸盐缓冲液中充分溶解,均配制成质量浓度为5mg/mL的溶液.
将配制好的溶液按CPP与葡聚糖质量比为1∶4使二者均匀混合,常温下调至pH 7.0,取30mL混合物置于烧杯中,分别在功率180W和250W下超声处理0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0h,温度设定为(60±5)℃,恒温水浴槽控温.反应完毕,使用冰水使混合液冷却至室温,将混合液3000r/min离心10min除去沉淀,得到上清液,流水透析24h(截留相对分子质量为8×103~1.4×104)得到葡聚糖-CPP共聚物,24h后冷冻干燥,备用.同时,按上述条件制备CPP和葡聚糖的混合物,以90℃水浴未超声处理作为对照,此条件下处理获得的产物表示为水浴-90.在功率180W、250W超声处理下获得的产物分别表示为MRPs-180、MRPs-250.
1.2.2 接枝率的测定
参考Vigo等[10]的方法并进行适当调整.取4.0mL OPA试剂置于试管中,加入0.2mL制备的各条件下共聚物,摇匀,水浴2min,终止反应,整个过程避光进行.用0.2mL的超纯水替换0.2mL的样品作为空白调零,其余相同.反应结束后,冷却至室温,在340nm处测定吸光度.以0.1~0.5mg/mL的赖氨酸溶液绘制标准曲线(y=1.691x-0.1409,R2=0.9991),计算样品中游离氨基的含量.按照式(1)[11]计算接枝率(G).
式中:c0为零时刻时单一蛋白溶液中游离氨基的浓度,mol/L;ct为t时刻接枝物溶液中游离氨基的浓度,mol/L.
1.2.3 葡聚糖-CPP共聚物微观结构分析
傅里叶变换红外光谱(FTIR)分析:1.0mg样品冻干粉末与(150±10)mg溴化钾混合,置于玛瑙研钵内充分研磨,将混合物倒入模具进行压片.将压至透明的薄皮放入傅里叶变换红外光谱仪中,波数范围400~4000cm-1,分辨率4cm-1,扫描次数32次,使用OMNIC软件对谱图进行数据处理及基线校正.
扫描电子显微镜(SEM)观察:将一定量样品液滴加到1cm的小玻璃板上,自然风干,将干燥的样品均匀分布在样品盘上的导电胶表面,进行真空喷金处理.将喷金处理后的样品盘置于扫描电子显微镜下观察,加速电压10kV,放大倍数1000倍.
1.2.4 葡聚糖-CPP-Ca2+递送体系的制备
准确称取一定量在250W超声处理240min后冻干的葡聚糖-CPP粉末,配制成20mg/mL溶液,加入与之等量的CaCl2,调节pH至7.0,恒温40℃条件下振荡40min.反应完成后,加入10倍体积的95%乙醇醇沉,3000r/min离心10min,弃上清液,取沉淀物进行冷冻干燥,备用.CPP-Ca2+溶液递送体系的制备方法与上述方法相同.
1.2.5 Ca2+递送体系在体外胃(肠)道模拟体系中的稳定性
准确称取0.6g NaHCO3、1.1g KCl和3.1g NaCl,用超纯水将溶液定容至1L,配制成胃电解质溶液,调节pH至2.0,常温贮存.称取150.0mg胃蛋白酶,将其溶解于胃电解质溶液,配制成1mg/mL人工胃液,4℃保存备用.
称取0.65g KCl、5.4g NaCl用超纯水定容至1L,配制成肠电解质溶液,调节pH至7.8.称取4.0g胰蛋白酶并用超纯水定容至100mL,加入100mL肠电解质溶液均匀混合,制成人工小肠液,pH调至7.8,4℃保存备用.
参考Gao等[12]的方法并进行适当调整.配制质量浓度均为100mg/mL的CPP-Ca2+和葡聚糖-CPPCa2+复合物溶液,采用透析袋法测定递送体系的Ca2+在体外胃肠道模拟体系中的释放效果.
取5mL已配制好的复合物溶液置于透析袋(截留相对分子质量为500)中,将透析袋分别置于100mL pH 2.0的胃电解质溶液和人工胃液的烧杯中,37℃水浴振荡2h,每隔15min从烧杯取1mL待测液;待模拟胃消化反应结束后,将透析袋移至肠电解质溶液和人工小肠液的烧杯中,消化4h,每隔30min从烧杯取1mL待测液,利用EDTA法测定溶液中的Ca2+含量.释放率(R)按照式(2)计算.
式中:1ρ和0ρ分别为滴定钙质量浓度和总钙质量浓度,mg/mL.
1.2.6 葡聚糖-CPP-Ca2+递送体系微观结构分析
葡聚糖-CPP-Ca2+递送体系微观结构采用傅里叶变换红外光谱分析与扫描电子显微镜观察,具体操作步骤与参数设置参照1.2.3节.
1.3 数据处理
所有实验重复测定3次,计算结果均以“平均值±标准差”表示.采用SPSS 25.0软件进行一维方差分析,差异显著性采用邓肯检验,不同字母表示差异性显著(P<0.05).
2 结果与讨论
2.1 超声处理对葡聚糖-CPP共聚物的影响
2.1.1 接枝率
OPA法是一种有效检测氨基酸的方法.美拉德反应中残余的游离氨基一般用来评价多糖的反应水平.CPP与葡聚糖的接枝反应主要是在游离氨基和还原性醛基之间发生,还原糖的羰基会使CPP中游离氨基含量降低.采用OPA法测定340nm处的氨基含量,对共聚物的接枝率进行了测定.超声处理对接枝率的影响如图1所示.

图1 超声处理对接枝率的影响Fig.1 Effects of ultrasonic treatment on grafting rates
从图1中可以看出,CPP和葡聚糖的接枝率与超声功率和反应时间呈正相关;超声波处理后,游离氨基含量呈递减趋势,接枝强度也随之增加,且在超声功率为180W和250W下的接枝率差异显著(P<0.05);250W超声处理4h接枝率最高,为62.30%.这是由于超声波产生的空化效应和机械效应促进了CPP与葡聚糖间的接枝反应[11].超声处理加速分子的运动,使葡聚糖与CPP之间的碰撞概率增加,促进游离氨基和还原性醛基之间发生接枝反应,且防止CPP分子间聚集,有利于氨的羰基化.
反应时间是影响美拉德反应[13]过程中褐变程度和中间产物形成的重要因素.在水浴温度90℃、控制CPP和葡聚糖的比例为1∶4时,随着反应时间的延长,接枝率先升高后降低,在4h时接枝率最高;与水浴法相比,超声处理组达到与之相同接枝率时的处理时间明显缩短,即1h后,水浴组接枝率明显低于相同处理时间下超声处理组的接枝率(P<0.05),4h后,250W超声处理组的接枝率比水浴组高19.67%.
2.1.2 葡聚糖-CPP共聚物的表征
(1)FTIR分析
傅里叶变换红外光谱分析可用于分析多糖和多肽的结构变化以及共聚物的相互作用,是分析美拉德反应产物结构的有力手段,其在红外谱区都有若干特征吸收带[14].不同样品的傅里叶变换红外光谱图如图2所示.与葡聚糖和CPP对比,共聚物的吸收峰在3400cm-1附近发生变化,这表明在美拉德反应后引入葡聚糖导致O—H在3200~3700cm-1处产生了伸缩振动;C—H在2800~3000cm-1处产生了伸缩振动,与Pirestani等[15]的研究一致.
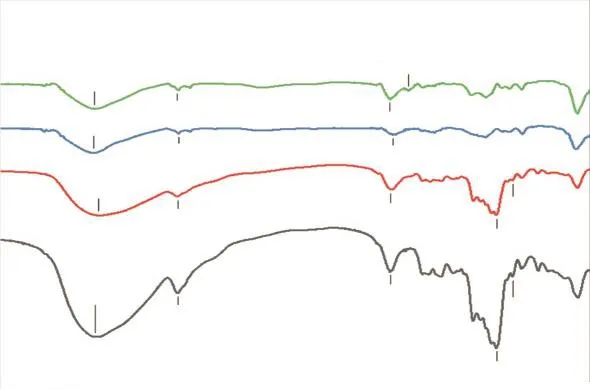
图2 不同样品的傅里叶变换红外光谱图Fig.2 FTIR spectra of different samples
在1650cm-1波数附近的吸收峰对应于羧基中的C=O,这是酰胺Ⅰ带(1600~1700cm-1)的特征吸收峰.与CPP相比,水浴处理组共聚物在这里的吸收峰强度稍有减弱,是由于羰基含量减少而逐渐聚合成大分子;与水浴处理组相比,超声处理组的最大吸收波长有所降低.超声处理组在1651cm-1酰胺Ⅰ带吸收峰变化明显,说明超声会影响CPP的二级结构[16].1070cm-1附近超声处理组相较于水浴处理组峰强度增加,本研究结果与Wang等[17]的研究结果相似.FTIR谱图变化证明了共价连接的形成,同时,不同处理条件下的共聚物表现出了结构上的差异.
(2)SEM分析
利用SEM观察不同样品表面微观结构变化.如图3所示,CPP为球状,表面粗糙,部分有粘连;葡聚糖,形态以片状为主,其表面平整光滑.水浴处理下的葡聚糖-CPP共聚物,从图3中可以看出两种形态的物质交替覆盖,这是由于CPP与葡聚糖之间的分子间相互作用导致,表明两种物质通过阿马道里重排和共价键紧密地结合在一起[18].通过美拉德反应,葡聚糖分子中的羰基与CPP分子中的氨基相结合发生分子间的交联或桥联现象.同时,葡聚糖可以对CPP起到一定的保护作用,提高CPP的稳定性.

图3 CPP、葡聚糖、水浴处理葡聚糖-CPP共聚物、超声处理葡聚糖-CPP共聚物的扫描电子显微镜图Fig.3SEM images of CPP,dextran,dextran-CPP copolymer under water bath treatment and dextran-CPP copolymer under ultrasonic treatment
超声处理下的葡聚糖-CPP共聚物,CPP附着在葡聚糖上的结合形态相较水浴处理下的共聚物发生变化.这是由于超声可以使蛋白质的结构和表面性质产生变化从而影响共聚过程[17],即超声波可以使酪蛋白发生去折叠现象,改变蛋白质的二级结构,这会导致游离氨基的增加,同时影响活化能[9],还可以通过展开CPP的空间构象增加糖基化点位,这也验证了测得的接枝率有所提高的原因.
2.2 葡聚糖-CPP-Ca2+递送体系的构建
2.2.1 葡聚糖-CPP-Ca2+结构表征
(1) FTIR分析
Jiang等[19]研究发现,可用接枝率反映不同条件下葡聚糖-CPP吸附Ca2+的能力,故对上述超声处理接枝率最高条件下和水浴处理下得到的共聚物进行Ca2+的递送,并进行葡聚糖-CPP-Ca2+结构表征.葡聚糖-CPP-Ca2+的傅里叶变换红外光谱图如图4所示.CPP中3409cm-1处的吸收峰为—NH2的伸缩振动峰,与钙离子螯合后发生了红移,移动至3428cm-1,由此可知钙离子与氨基氮发生反应.

图4 葡聚糖-CPP-Ca2+的傅里叶变换红外光谱图Fig.4 FTIR spectrum of dextran-CPP-Ca2+
与钙离子螯合后葡聚糖-CPP共聚物的-NH2吸收峰也出现蓝移,这是因为CPP或葡聚糖-CPP共聚物中的氨基分别形成C—N共价键和N—Ca离子键的不同也会导致吸收峰的蓝移,且超声处理比水浴处理条件下的波数有所降低,是因为钙离子的加入会增加螯合物中的电子云密度,使得频率升高,电场效应发生改变.1650cm-1附近处为C=O伸缩振动的特征峰[20],螯合反应后该处特征峰均发生了蓝移,表明C=O参与到了钙离子结合中.
共聚物在1000~1200cm-1处的特征峰为磷酸P—O—C基团的伸缩振动,在与钙离子发生结合后,此处吸收峰强度发生了明显的变化,这表明CPP中的磷酸基团在钙配位中发挥着重要作用,磷酸化丝氨酸残基具有钙结合能力,证明了磷酸基团也参与了钙离子的结合过程.
(2) SEM分析
水浴处理、超声处理后的葡聚糖-CPP-Ca2+递送体系在不同放大倍数下的扫描电子显微镜图如图5所示.葡聚糖-CPP共聚物表面均呈现出凹凸不平的形态,主要为片状.共聚物与钙离子结合后的葡聚糖-CPP-Ca2+递送体系呈现出相互交织、疏松多孔的无定形状态.这是因为钙离子的加入破坏了葡聚糖-CPP共聚物的原有结构[21],诱导共聚物中CPP的结构向外展开;同时,多肽之间通过钙离子连接发生交联,形成较大颗粒,钙离子与CPP分子中的氨基端和羧基端作用也会使其表面微观结构发生变化.由图5可以看出,超声处理下的葡聚糖-CPP-Ca2+递送体系的孔隙状态比水浴处理下更加疏松.

图5 水浴处理、超声处理后的葡聚糖-CPP-Ca2+递送体系在不同放大倍数下的扫描电子显微镜图Fig.5SEM images under different magnification of dextran-CPP-Ca2+delivery system under water bath treatment and ultrasonic treatment
2.2.2 Ca2+递送体系的模拟体外消化
通过配制与人体胃肠道的内环境相似的溶液来模拟人体消化,图6为CPP-Ca2+和超声处理下葡聚糖-CPP-Ca2+两种Ca2+递送体系的消化过程.
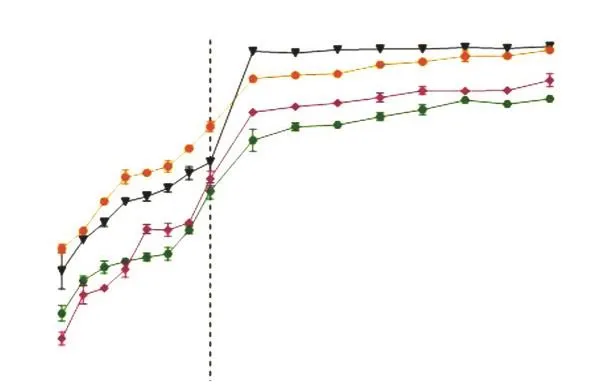
图6 不同Ca2+递送体系的模拟体外消化Fig.6Artificial simulation of in vitro digestion with different Ca2+ delivery systems
在体外模拟胃消化阶段中,CPP-Ca2+在胃电解质溶液和胃消化阶段过程中的钙离子释放率分别达到68.73%和77.78%,葡聚糖-CPP-Ca2+在胃电解质溶液和胃消化阶段过程中的钙离子释放率分别为61.32%和64.48%.对于葡聚糖-CPP-Ca2+递送体系而言,在胃消化结束阶段并没有表现出显著性差异(P<0.05).在肠消化阶段中,CPP-Ca2+在电解质溶液和人工模拟液中的释放率分别为98.31%和97.40%,葡聚糖-CPP-Ca2+在人工模拟液中的释放率达到89.62%,在电解质溶液中为84.86%,这表明葡聚糖-CPP-Ca2+具有更好的抗消化性.
CPP-Ca2+在整个消化阶段表现出的Ca2+释放率均高于葡聚糖-CPP-Ca2+,这可能是因为CPP-Ca2+递送体系中的CPP直接与外界环境接触,更容易受到酶和环境pH的影响,致使钙离子释放得更快.
3 结 论
接枝率测定及共聚物表征研究表明,CPP与葡聚糖共聚物在250W超声处理2h条件下的反应程度与90℃水浴处理4h条件下相当;在反应4h后,超声处理组的接枝率比水浴处理组提高19.67%,且在螯合钙离子后模拟胃肠道消化过程缓释效果较好.超声处理通过展开CPP的空间构象增加糖基化点位,使得CPP与葡聚糖结合点位明显增多,改善了接枝能力,提高了共聚物的反应速度和反应程度,在递送钙离子的应用中呈现出明显的优势,为葡聚糖-CPP作为钙递送体系在后续食品工业化生产中的应用奠定了基础.

