西藏4个盐湖卤虫卵的生物学测定值、营养组成和孵化速率分析
邓洪刚,解 伟,高美荣,杜国儒,李 城,隋丽英
(海洋资源化学与食品技术教育部重点实验室,亚洲区域卤虫参考中心,天津科技大学海洋与环境学院,天津300457)
卤虫生存于盐湖、日晒盐场蒸发池等高盐水环境中,其无节幼体是海水鱼类和甲壳类幼苗重要的活饵料[1].卤虫的品系特征(如卵的孵化质量、初孵无节幼体的大小和营养成分等)对其在水产育苗中的有效利用至关重要.西藏盐湖主要分布于那曲市和阿里地区,海拔4000~4500m,湖水分型多为碳酸盐型或硫酸盐型[2].20世纪90年代以来,西藏双湖县其香错和改则县拉果错的卤虫卵资源逐步得到商业化采收和加工利用.
1998—1999 年,刘俊英等[3-4]首次对西藏拉果错卤虫卵的生物学测定值和营养组成进行分析.2001年,刘凤岐等[5]对西藏卤虫卵(卤虫卵来源盐湖未知)最适孵化温度进行分析.2003年,Van Stappen等[6]研究分析青藏高原拉果错、帮错、博泽错、鲸鱼湖、海雁湖和措勤等卤虫卵的生物学测定值、脂肪酸组成和不同孵化液离子组成对孵化特性的影响.2006年,于秀玲等[7]对西藏改则、双湖、尼玛和扬那蓬错等盐湖的卤虫卵生物学测定值和脂肪酸含量进行分析.2017—2019年,潘正军等[8-9]研究了温度、盐度、光照和pH对西藏卤虫卵孵化率的影响.2018年,李炳乾等[10]对西藏其香错卤虫卵的孵化条件进行研究.2022年,邢明威等[11]对西藏其香错卤虫卵的生物学测定值、粗蛋白、粗脂肪和脂肪酸组分进行分析,并肯定了其在凡纳滨对虾育苗中的积极效果.以上研究表明,不同西藏盐湖卤虫卵具有不同的生物学特性,并且同一盐湖、不同年份所采收加工的卤虫卵的生物学特性也存在一定差异.除这些研究外,还未见有关西藏其他盐湖卤虫卵生物学特性分析的研究.西藏具有较为丰富的盐湖卤虫资源,有必要对西藏盐湖卤虫的生物学特性进行深入研究.
近年来,由气候变化导致的盐湖水环境因子(如盐度和温度)的波动,可能会对西藏卤虫卵生物学特性和营养组成造成影响.并且目前对具有开发潜力的西藏其他盐湖(如班戈错、当穹错)卤虫卵生物学特性的研究还未见报道.基于此,本研究对采自2019—2021年的西藏其香错、班戈错、拉果错和当穹错4个盐湖卤虫卵的生物学测定值、营养组成和孵化速率进行分析,并且对卤虫无节幼体的主要类胡萝卜素中的角黄素的含量进行测定.本研究结果将为西藏卤虫卵在水产养殖中的高效应用提供依据,为西藏卤虫资源的可持续开发提供理论参考.
1 材料与方法
1.1 卤虫卵样本及盐湖水质信息
2019—2021 年,在位于西藏那曲市和阿里地区的4个盐湖采集卤虫卵样本.4个盐湖分别为其香错、班戈错、拉果错和当穹错,它们的地理位置和水体物理化学信息见表1.采集后的样本需要去除杂质并进行脱水,脱水后在-18℃进行冷冻去休眠处理,以便用于后续分析.4个盐湖湖水的盐度为45~100,pH为8.5~9.5,4个盐湖均为碳酸盐型盐湖.
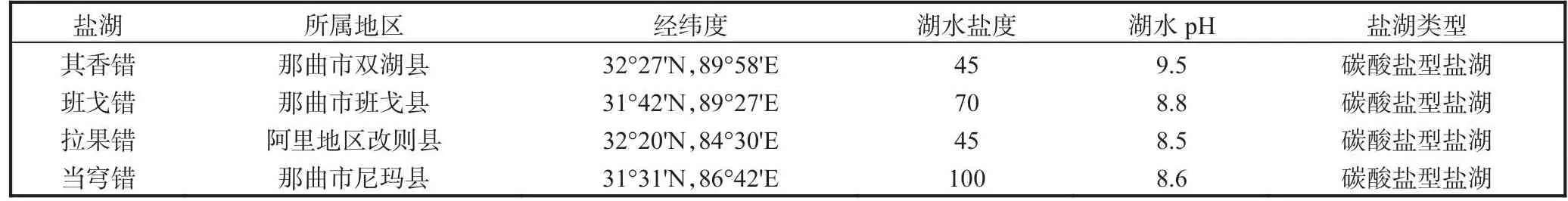
表1 盐湖的地理位置和水体物理化学信息Tab.1 Geographical location of salt lakes and physical and chemical information of water body
1.2 卤虫水合卵径、脱壳卵径和无节幼体体长分析
卤虫卵在淡水中充气1h,进行充分水合,并用卢戈碘液进行固定,用于测定水合卵卵径.用NaClO溶液去除卵壳,将收集到的脱壳卵用清水彻底冲洗,用卢戈碘液固定后用于测定脱壳卵卵径.卤虫卵在28℃、盐度30、pH=8、光照强度2000lx和连续充气的条件下进行孵化,孵化约24h后收集Ⅰ期无节幼体,用卢戈碘液固定后在解剖镜(DM500,德国LEICA)下分别测量水合卵径、脱壳卵径和Ⅰ期无节幼体体长(l),并计算平均卵壳厚度.
式中:hCT为平均卵壳厚度,dHC为水合卵径,dDC为脱壳卵径.
1.3 卤虫脱壳卵粗蛋白、粗脂肪和脂肪酸含量分析
脱壳后的卤虫卵在60℃烘箱内干燥24h,参照GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》,用凯氏定氮仪(2300-Kjeldahl,丹麦FOSS)测定卤虫卵中的粗蛋白含量;参照GB/T 6433—2006《饲料中粗脂肪的测定》,用索氏提取法测定卤虫卵中的粗脂肪含量;提取脂肪酸并甲酯化,采用内标法(C20:2n-6,美国NU-CHEK PREP)用气相色谱仪(GC-2014,日本岛津)分析其脂肪酸甲酯的组成和含量[12].
1.4 卤虫无节幼体角黄素含量分析
收集湿质量约1g的Ⅰ期卤虫无节幼体(每个样品3个平行).用V(氯仿)∶V(甲醇)=1∶2的混合物提取色素,35℃条件下用旋转蒸发仪(RV10,德国IKA)浓缩.用氮气吹干后,用1mL甲醇溶解色素提取物后备用[13].以甲醇为溶剂配制含0.005、0.01、0.02、0.1、0.2g/L角黄素(北京盛世康普化工技术研究院)的标准工作溶液.采用C18色谱柱(5.6μm,4.6mm×250mm,日本岛津),柱温25℃,流动相为V(甲醇)∶V(乙腈)=9∶1的混合物,进样量10μL,流量1mL/min[14],于477nm处测定吸收峰面积.以角黄素的质量浓度为横坐标,以对应的色谱峰面积为纵坐标制作角黄素标准曲线,根据样品峰面积计算得到角黄素含量.
1.5 孵化速率及孵化同步性测定
将2g卤虫卵加入含有1L稀释卤水(盐度为30)的孵化管中,孵化条件同1.2节.每隔4h使用24孔板(每孔取样50 μL,共1.2mL)采样一次,每组3个平行,在显微镜(DM500,德国LEICA)下观察并记录无节幼体、伞状幼体和未孵化卵(胚胎)的数量,计算孵化率[12].以最高孵化率为100%,计算每个采样时间点的相对孵化率.针对相对孵化率,采用二元二次方程拟合计算10%和90%无节幼体的孵出时间,并计算孵化同步性[12].
式中:ts为孵化同步性,t10、t90分别为10%和90%无节幼体的孵出时间.
1.6 数据统计学分析
使用SPSS 25.0软件对实验结果进行统计分析,使用单因素方差分析和Duncan’s多重比较对实验数据进行检验.
2 结 果
2.1 卤虫卵和Ⅰ期无节幼体生物学测定值
4个盐湖卤虫卵和Ⅰ期无节幼体的生物学测定值见表2.西藏4个盐湖卤虫卵水合卵径和脱壳卵径分别在263.6~342.9µm和248.5~315.5µm,Ⅰ期无节幼体体长为519.6~601.1µm.其中,拉果错卤虫卵水合卵径、脱壳卵径和Ⅰ期无节幼体体长值最大,显著高于其他组(P<0.05).当穹错卤虫卵卵壳厚度最小(4.1µm),拉果错卤虫卵卵壳厚度最大(13.7µm).
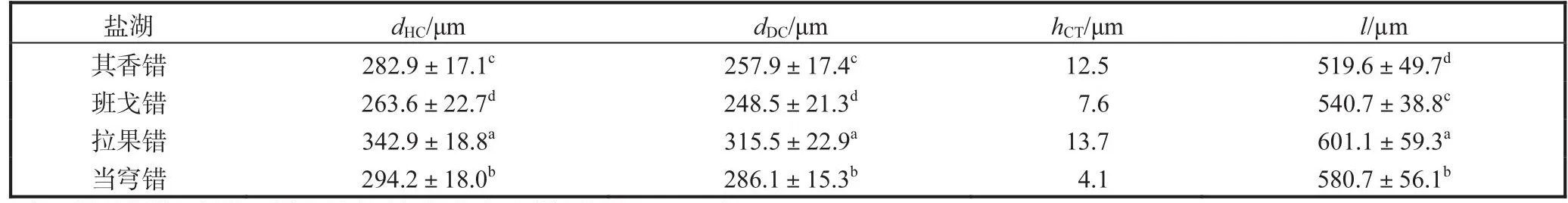
表2 4个盐湖卤虫卵和Ⅰ期无节幼体的生物学测定值(n=100)Tab.2 Biometrics of Artemia cysts and instarⅠnauplii from four salt lakes(n=100)
2.2 卤虫脱壳卵粗蛋白、粗脂肪和脂肪酸含量
4个盐湖卤虫脱壳卵粗蛋白和粗脂肪含量见表3,脱壳卵脂肪酸含量见表4.西藏卤虫卵粗蛋白质量分数为51.87%~57.29% (基于干质量,下同),粗脂肪质量分数为18.02%~22.11%.在脂肪酸水平上,拉果错卤虫卵二十碳五烯酸(EPA,C20:5n-3)含量最高,为42.49mg/g,C16:1(n-7)和C18:1(n-9)含量分别为54.86mg/g和20.34mg/g,也明显高于其他盐湖卤虫卵,且高不饱和脂肪酸(HUFA,C原子数≥20,n≥3)以及总脂肪酸含量最高,分别为47.47mg/g和217.98mg/g.其香错卤虫卵二十二碳六烯酸(DHA,C22:6n-3)含量最高(0.96mg/g),并且C18:1(n-7)含量在4组中最高(55.07mg/g).当穹错卤虫卵EPA含量最低(10.05mg/g),未检测出DHA,但C18:3(n-3)和多不饱和脂肪酸(PUFA,C原子数≥18,n≥2)含量最高,分别为44.67mg/g和75.23mg/g.
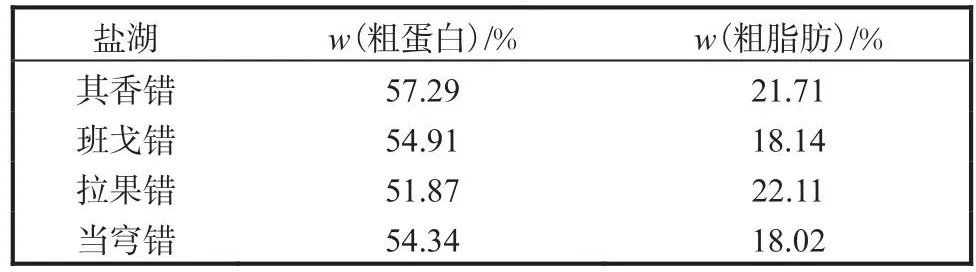
表3 4个盐湖卤虫脱壳卵粗蛋白和粗脂肪含量Tab.3 Crude protein content and crude fat content of the decapsulated Artemia cysts from four salt lakes
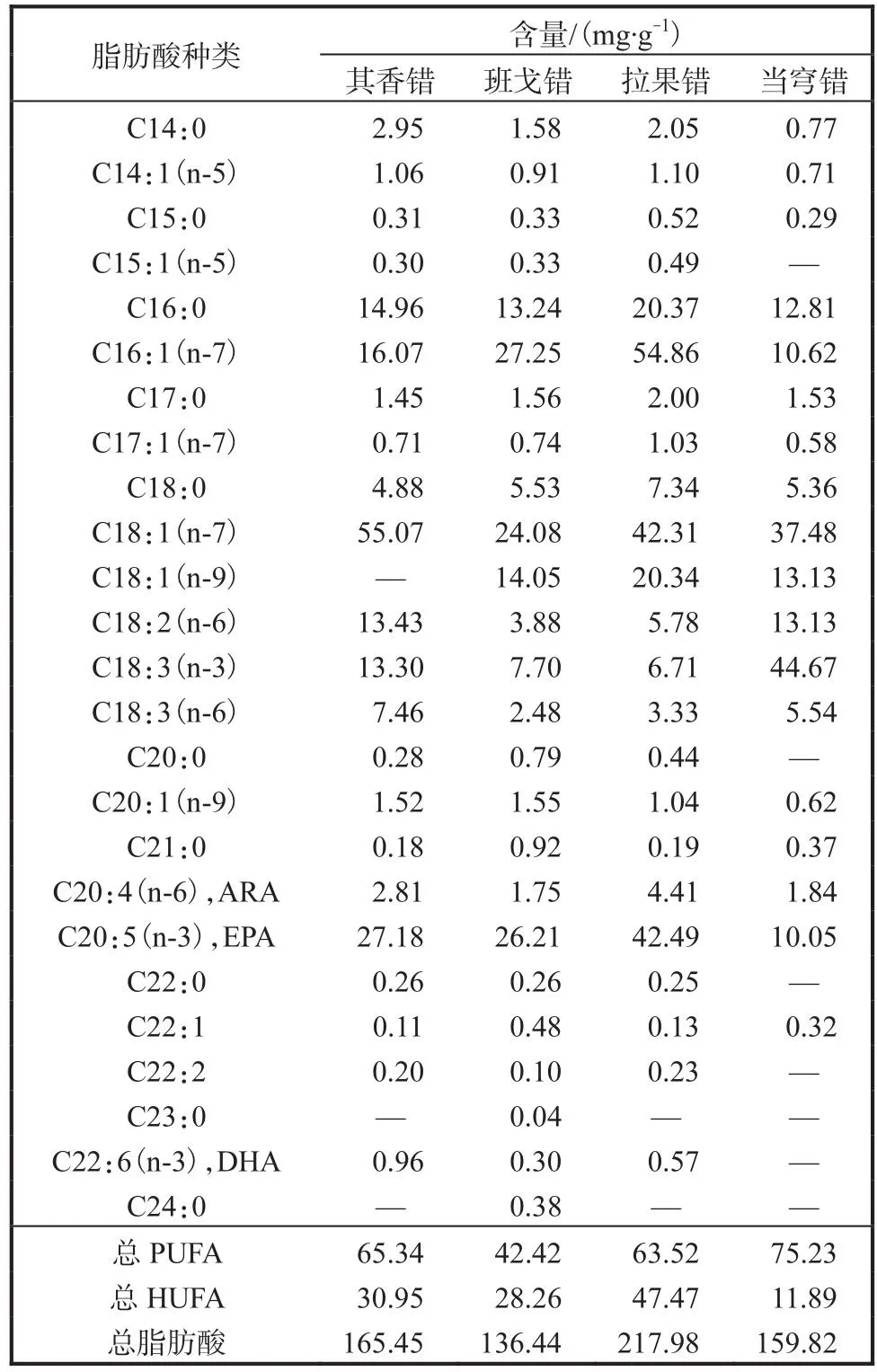
表4 4个盐湖卤虫脱壳卵脂肪酸含量Tab.4 Fatty acid profile of the decapsulated Artemiacysts from four salt lakes
2.3 卤虫无节幼体角黄素含量
4个盐湖卤虫无节幼体的角黄素含量如图1所示,图中数据柱上的不同字母表示组间存在显著差异(P<0.05).4个盐湖卤虫无节幼体中角黄素含量具有一定差异:当穹错卤虫无节幼体的角黄素含量最高,为(1.68±0.17)mg/g,显著高于其香错和拉果错卤虫无节幼体(P<0.05),但与班戈错卤虫角黄素含量差异不显著(P>0.05);拉果错无节幼体的角黄素含量最低,为(0.84±0.03)mg/g.
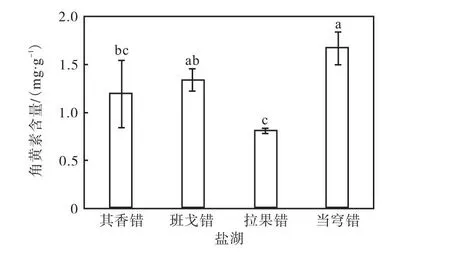
图1 4个盐湖卤虫无节幼体的角黄素含量Fig.1Canthaxanthin content in Artemia nauplii from four salt lakes
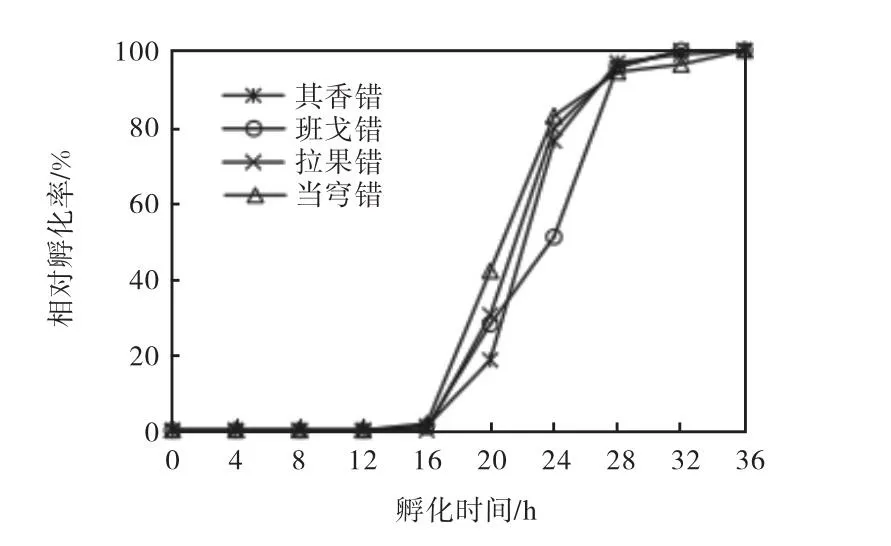
图24 个盐湖卤虫卵在28℃、盐度30条件下的相对孵化率Fig.2Relative hatching rates of Artemia cysts from four origins at 28℃,salinity 30
2.4 卤虫卵的孵化速率
4个盐湖卤虫卵在28℃、盐度30条件下的相对孵化率如图2所示,卤虫卵孵化同步性数据见表5.
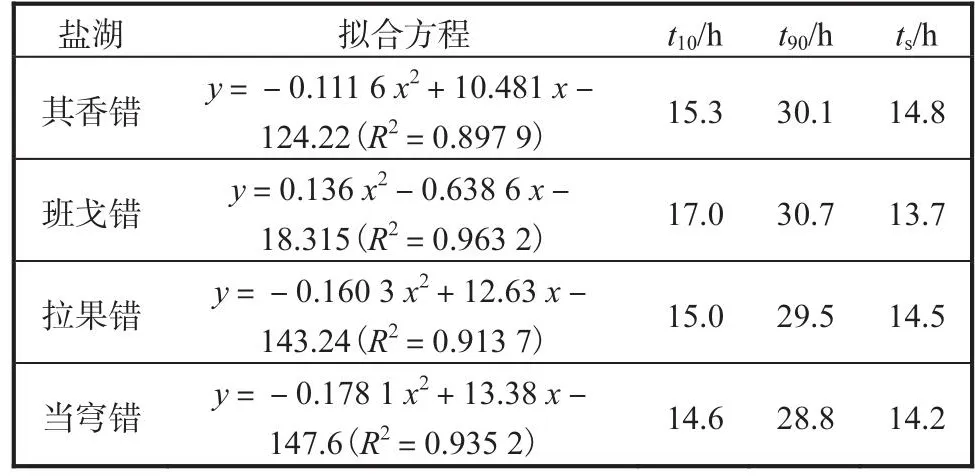
表5 卤虫卵孵化同步性Tab.5 Hatching synchronization of Artemia cysts
4个盐湖卤虫卵均从孵化至16h时开始检测到有无节幼体孵出,16~28h为快速孵化期.孵化至24h时,其香错、拉果错和当穹错卤虫卵相对孵化率为76.1%~82.7%,班戈错为50.9%.孵化至28h时,4个盐湖卤虫卵相对孵化率较高(95%左右).根据每个时间点的相对孵化率绘制曲线并进行拟合,计算后可以得出t10和t90,进而可以求得孵化同步性.4个盐湖卤虫卵的孵化同步性在13.7~14.8h之间.因此,西藏卤虫卵孵化需要更长的时间(28h),孵化速率较慢.
3 讨 论
到目前为止,世界上已经发现7种两性卤虫和许多种孤雌生殖卤虫.20世纪90年代,Abatzopoulos等[15]应用卵和无节幼体的生物特征、成虫的形态特征、遗传、等位基因和DNA分析以及与已知卤虫品系的杂交测试等方法,将拉果错的卤虫种群鉴定为Artemia tibetiana.然而,通过线粒体COI基因和12S-16S rRNA基因的分子标记,以及线粒体基因组测序,西藏不同盐湖的卤虫种群已经出现了一定程度的分化.西藏盐湖卤虫是否存在亚种或隐存种,以及本研究所涉及的4个西藏盐湖卤虫的种属关系还有待进一步研究.
3.1 西藏卤虫卵的特征
同一产地不同批次卤虫卵卵径保持相对恒定,且无节幼体体长和能量等生物学特征也与卵径高度相关,因此根据卤虫卵的这些生物学特性可以区分不同产地(品系)的卤虫[16].本研究结果表明,西藏盐湖卤虫水合卵径和Ⅰ期无节幼体体长均大于美国大盐湖GSL卤虫卵(均值分别为245.1µm和438.9µm)和中国渤海湾塘沽卤虫卵(均值分别为273.7µm和446.2µm)[17].拉果错卤虫卵比报道的鲸鱼湖卤虫卵更大,但两者的Ⅰ期无节幼体体长相似(分别为601.1µm和607.1µm)[6],后者是迄今报道的最大的卤虫无节幼体.藏北盐湖大部分位于海拔4400m以上的高海拔地区,紫外线辐射强,年平均气温低(夏季平均气温为16.9℃,冬季平均气温为-21.3℃),气温日变化大[2].一般而言,生活在高纬度寒冷气候中的生物往往比生活在低纬度地区的生物体型更大[18],如南美洲太平洋沿岸卤虫成虫的体型有随着纬度的增加而增大的趋势[19],淡水桡足类[20]、枝角类[21]和轮虫[22-23]等其他水生浮游动物有同样的现象.本研究中西藏卤虫的卵径和Ⅰ期无节幼体体长均较大,这可能与西藏卤虫的品系特征以及青藏高原独特的地理环境条件有关.
3.2 西藏卤虫无节幼体的角黄素含量
角黄素是卤虫中的主要类胡萝卜素[16].Tsushima等[24]发现大盐湖卤虫卵中角黄素占总类胡萝卜素的97.5%,但初孵无节幼体中角黄素的含量还未见报道.补充角黄素可以促进虹鳟鱼[25-27]和鲑鱼[28-29]肌肉的色素沉积,并提升虹鳟鱼卵[25]的色素含量.本研究中4个盐湖卤虫Ⅰ期无节幼体角黄素含量具有一定的差异,当穹错卤虫无节幼体的角黄素含量最高,为(1.68±0.17)mg/g,而拉果错卤虫无节幼体的角黄素含量最低,为(0.80±0.03)mg/g,推测角黄素含量的差异可能与卤虫种群遗传背景和环境有关.
3.3 西藏卤虫卵的HUFA含量
卤虫卵的营养组成(如粗蛋白、粗脂肪和脂肪酸等)及其代谢产物在不同品系或同一品系不同批次之间具有一定的差异.与美国大盐湖和中国渤海湾卤虫卵相比,西藏其香错、拉果错和班戈错卤虫卵EPA和DHA含量较高,HUFA含量为28.26~47.47mg/g,而大盐湖HUFA含量仅为5.01mg/g,当穹错卤虫卵并未与其他3个盐湖呈现出相同的结果,其EPA含量(10.05mg/g)和HUFA含量(11.89mg/g)与渤海湾卤虫卵的EPA含量(14.96mg/g)和HUFA含量(17.65mg/g)相似[11].卤虫卵的营养组成与卤虫所摄食的饵料(如单细胞藻类、细菌和古菌等)的营养成分差异有关[30-33].不同卤虫种群的脂肪酸组成和含量受物种[32,34-35]和饵料营养[30,36]的影响,当投喂HUFA含量高的饵料时,卤虫HUFA含量也更高[30,36-37].但是,关于西藏盐湖微生物组成及其HUFA含量的信息十分有限.与其他3个盐湖卤虫卵相比,当穹错卤虫卵HUFA含量较低,这可能与该盐湖引进外源HUFA含量低的卤虫品系[38]以及湖中饵料微生物营养缺乏有关.除了品系和饵料因素外,西藏卤虫卵HUFA含量高还可能与高原强烈的紫外线辐射和极低的水温有关.缪锦来等[39]发现增强UV-B紫外线辐射可以增加4种南极冰藻中PUFA的含量.Skerratt等[40]指出,UV-B辐射使南极棕囊藻(Phaeocystis antarctica)PUFA的比例增加.因此,强烈的紫外线辐射可能会增加西藏盐湖微生物中PUFA的含量,从而通过食物吸收促进HUFA在西藏卤虫体内的转化和积累.此外,卤虫对脂肪酸的代谢也会影响HUFA的含量.动物的脂肪酸代谢与温度有关,温度升高会提高脂肪酸的代谢率[41].随着温度的升高,卤虫HUFA的代谢速率变得更快[42-43].因此,可以推测西藏盐湖较低的温度可能会降低西藏卤虫的脂肪酸代谢率,从而导致卤虫体内HUFA的积累.然而,西藏卤虫较高的HUFA含量是否与低温下较低的HUFA代谢有关还有待研究.
卤虫中较高的HUFA含量以及DHA/EPA比有利于鱼和虾幼体的存活和生长发育[1,44-45].本课题组前期研究发现,用其香错初孵无节幼体投喂凡纳滨对虾幼虾[11]和杂交石斑鱼幼体[46],与其他品系的卤虫相比,其香错卤虫表现出良好的育苗效果,显著提升苗种对氨氮胁迫和弧菌攻毒的抵抗力.同时西藏卤虫卵[4,6-7]和无节幼体[11,46]富含HUFA,收获时无节幼体与卵壳分离较好,且收获后不需要进行HUFA强化,可直接投喂,能很好地满足海水鱼类、甲壳类苗种以及发育后期阶段苗种的营养需求.
3.4 西藏卤虫卵的孵化特性
卤虫卵的孵化率和孵化同步性能够显著影响其市场价格.孵化同步性好的卵能在较短的时间内产出较多大小均匀的无节幼体,育苗场倾向于使用在24h内孵化率达到最高且孵化同步性好的卤虫卵[14].优质卤虫卵的孵化同步性ts应小于8h,ts超过10h则被认为孵化同步性较差[12].本研究表明,其香错、班戈错、拉果错和当穹错的卤虫卵孵化率较高,孵化时间较长(28h),其孵化同步性ts为13.7~14.8h,说明西藏卤虫卵孵化同步性较差,孵化结束晚,孵化速率慢,孵化具有滞后性.
4 结 语
西藏盐湖卤虫具有较大的卵径和Ⅰ期无节幼体体长;其香错、班戈错和拉果错卤虫卵营养价值较高,尤其富含EPA,以及少量DHA.其香错、班戈错、拉果错和当穹错卤虫卵孵化率较高,但4个盐湖卤虫卵孵化时间长,孵化结束晚,孵化同步性较差.其香错、班戈错和拉果错卤虫卵具有HUFA含量高的优点,孵化后可直接投喂,不需要额外的强化,因此更适用于海水鱼虾幼苗的培育;而相对较大的初孵卤虫无节幼体也能更好地满足发育后期的水产苗种对饵料适口性的需求.今后需要对西藏盐湖卤虫资源量及其品系特性开展深入的考察和研究,进一步探究西藏卤虫卵的加工工艺和最适孵化条件,以期生产高质量的西藏卤虫卵,可持续地开发和利用西藏卤虫资源.

