2023年高考化学模拟试题B卷参考答案
1.D 提示:A 项,树叶由绿变黄的过程有新物质产生,发生了化学变化。B 项,花等物质落到泥土中,植物体中的蛋白质、纤维素等含C 的物质分解后变成有机肥供植物吸收,蕴含着自然界中的碳循环。C 项,雾有丁达尔效应,是因为胶体粒子对光有散射作用,可形成“光亮的通路”。D 项,碳纤维是一种新型无机非金属材料,是含碳量在90%以上的高强度纤维,主要成分是碳的单质,“心忧炭贱愿天寒”中的炭是由有机物和无机物所组成的复杂混合物,含量最高的元素是碳,两者不能互称为同素异形体。
2.B 提示:苯并降冰片烯与苯结构不相似,故二者不互为同系物,A 项错误。由题给结构简式可知,一个苯环上的6 个碳原子与苯环相连的2 个碳原子共平面,则该分子中最多8 个碳原子共平面,B 项正确。苯并降冰片烯的结构对称,其一个分子中含有5 种不同化学环境的氢原子,则其一氯代物有5种;苯环中无碳碳双键,故1个分子中含有1个碳碳双键,C、D 项错误。
3.A 提示:由反应前后质量数相等,知方程式中x=3,每生成294,即生成1 mol氧原子,释放的中子数为3NA,A 项正确。电解精炼铜时,阳极杂质也被溶解,故溶解的铜小于32g。C项中,当有1 mol Br-转化为Br2时,Fe2+已经被完全氧化,转移电子总数大于NA。D 项,标准状况下,HF 不是气体,不能用气体摩尔体积进行计算。
4.B 提示:A 项,利用装置A 制取SO2,a逸出的气体为SO2,装置C 为尾气吸收装置,用于吸收多余的SO2,应该装有NaOH 溶 液。B 项,SO2在 装 置B 中 与NaClO3发生反应得到ClO2,装置E 为安全瓶,为防止装置B 中的液体进入装置A 中,装置E 应放置在A 与B 之间,所以导管口a应接h或g,装置D 中收集ClO2,导管口c应接e。C 项,ClO2的沸点为11 ℃,在D 中被冷凝收集。D 项,MnO2与浓盐酸反应,1 mol·L-1盐酸是稀盐酸,与MnO2不反应。
5.C 提示:本题考查元素的推断和对热重曲线的理解并进行简单计算的能力。A 元素的族序数是周期数的3倍,A 为氧,B 元素的最外层电子数是次外层电子数的2 倍,B为碳,C是一种过渡金属元素,A 与C 形成的化合物可作双氧水分解的催化剂,C 为Mn。BA2是CO2,不是大气的污染物。设MnCO3的物质的量为1 mol,即质量为115g。据锰元素守恒知m(Mn)=55g,A 点剩余固体质量为115g×75.65%≈87g,m(O)=87g-55g=32g,A 点剩余固体的成分为MnO2,B、D 项错误。B 点剩余固体质量为115g×66.38%≈76.3g,则m(O)=76.3g-55g=21.3g,则n(Mn)∶n(O)=3∶4,故B 点剩余固体的成分为Mn3O4,C项正确。
6.D 提示:A 项,该装置工作时的能量形式有电能、化学能和光能三种。装置中,石墨是阳极,电极反应式为Ce3+-e-==Ce4+,SO2-4移向石墨电极,离子交换膜为阴离子交换膜,SO2-4由右池向左池迁移,B、C 项错误。D 项,由P电极向N 电极转移0.01 mol电子时,根据电极反应式Ce3+-e-==Ce4+,阳极室生成0.01 mol Ce(SO4)2,即3.32g,正确。
7.D 提示:点①H2C2O4的体积为25 mL,恰好完全反应,生成Na2C2O4,根据质子守恒,得到c(H+)+c(HC2O-4)+2c(H2C2O4)=c(OH-),A 项错误。点②溶液呈中性,c(OH-)=c(H+),根据电荷守恒,得出c(Na+)+c(H+)=c(HC2O-4)+2c(C2O2-4)+c(OH-),即c(Na+)=c(HC2O-4)+2c(C2O2-4),B 项错项。点③溶液中的溶质为NaHC2O4,根据图像,此时溶液显酸性,即HC2O-4的电离程度大于水解,因此c(Na+)>c(HC2O-4)>c(C2O2-4)>c(H2C2O4),C 项错误。由图示知,点①时溶质是Na2C2O4,点③时溶质是NaHC2O4,因此在①③两点之间可能出现c(C2O2-4)=c(HC2O-4),则滴定过程中可能出现c(Na+)>c(C2O2-4)=c(HC2O-4)>c(H+)>c(OH-),D 项正确。
8.(除标注外,每空2分,共14分)
(1)+6(1分) MoO3(1分)
(2)搅拌、适当增加H2SO4的浓度、适当加热等任意一项(1分)
(3)4∶1(1分)
(4)分液
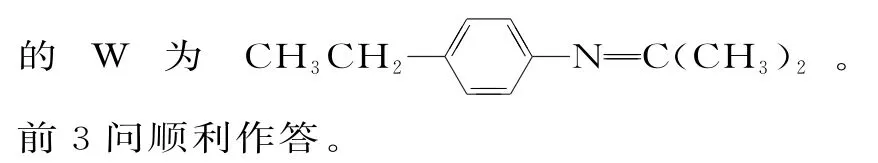
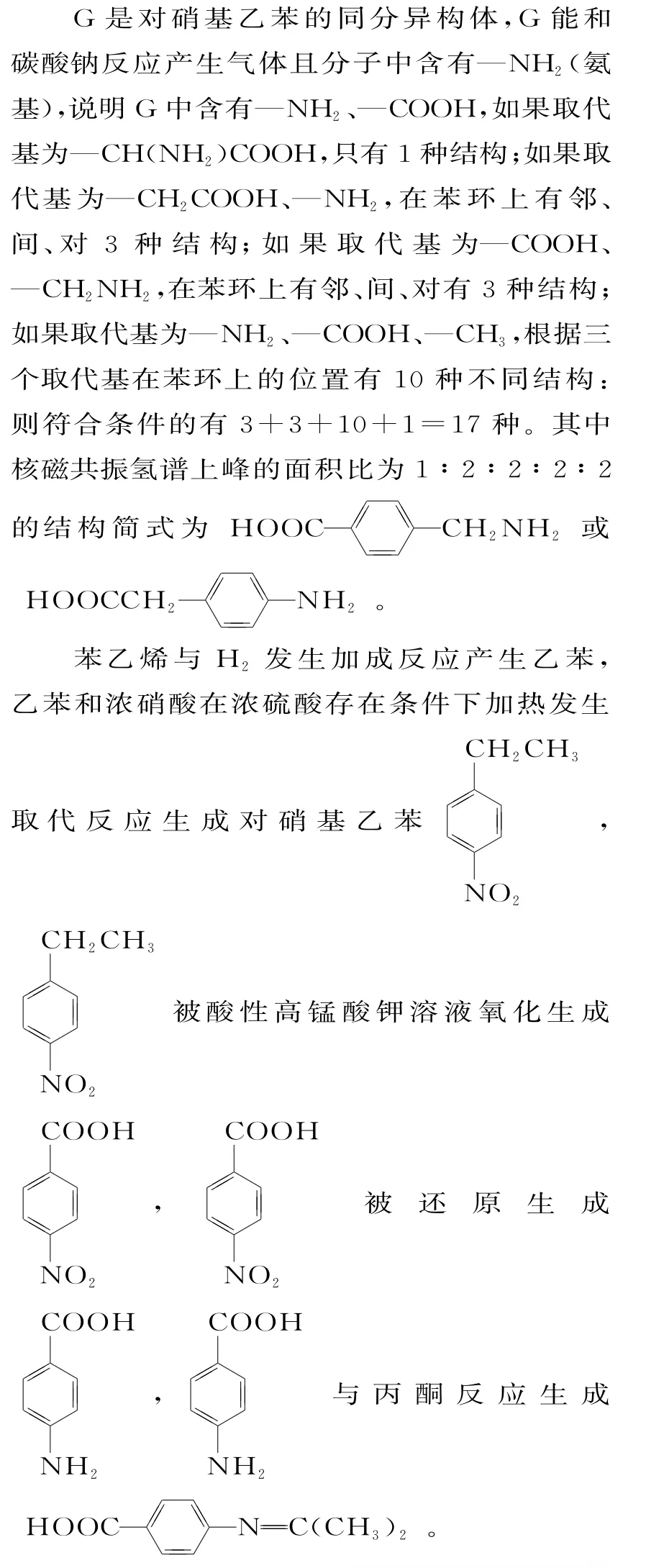
提示:(1)[(NH4)2MoO4]中,铵离子为+1价,O 为-2 价,根据元素化合价代数和为0,Mo的化合价为+6,MoS2和氧气反应的化学方程式为2MoS2+7O2==2MoO3+4SO2,可知生成物有二氧化硫和MoO3两种氧化物。
(2)为了加快酸浸速率,可采取的措施为搅拌或使原料粉碎,可以增大接触面积;也可以适当加热,提高反应温度,加快反应速率;也可以适当增加H2SO4的浓度。
(3)根据图像,可以看出MoO2+2较多、Co2+较少的协萃比为4∶1。
(4)操作Ⅰ是将有机相和水相分开,是分液。

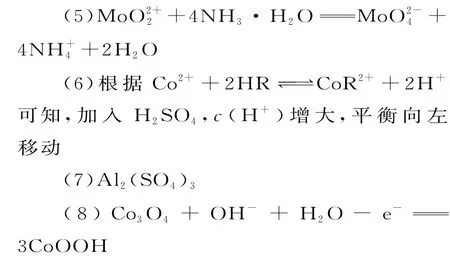
(8)Co3O4可以表示成CoO·Co2O3,在碱性条件下可发生氧化反应,生成CoOOH,电极反应式为Co3O4+OH-+H2O-e-==3CoOOH。
9.(除标注外,每空2分,共15分)
(1)2MnO-4+16H++10Cl-(浓)==2Mn2++8H2O+5Cl2↑ 三颈烧瓶(1分)
(3)3Cl2+2Fe(OH)3+10KOH ==2K2FeO4+6KCl+8H2O
(4)K2FeO4在0~5 ℃的强碱性溶液中较稳定,防止副反应发生
(5)重结晶(1分)
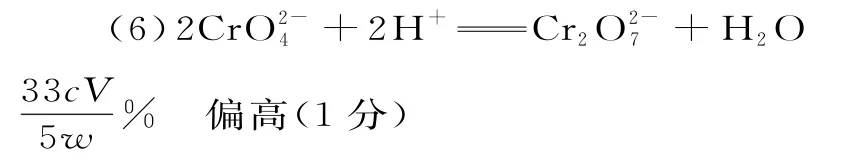
提示:(1)考查仪器的识别,由图知,仪器为三颈烧瓶。装置A 是利用浓盐酸和KMnO4反 应 制 备 Cl2,化 学 方 程 式 为2KMnO4+16HCl(浓)==2KCl+2MnCl2+8H2O+5Cl2↑,改写为离子方程式:2MnO-4+16H++10Cl-(浓)==2Mn2++8H2O+5Cl2↑。
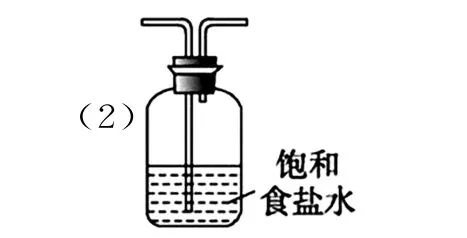
(2)装置B的作用是除去Cl2中的HCl,应选用饱和食盐水,长进短出,装置如图所示。
(3)根据前面的分析可知,装置C中反应生成 K2FeO4的化学方程式为3Cl2+2Fe(OH)3+10KOH ==2K2FeO4+6KCl+8H2O。
(4)产物K2FeO4在0~5 ℃的强碱性溶液中较稳定,因此将装置C置于冰水浴中,防止副反应发生。
(5)K2FeO4易溶于水,结晶后的K2FeO4中含有较多杂质,可以利用重结晶的方法提纯。


10.(每空2分,共14分)
(1)N2H4(l)+4Cu(OH)2(s)==N2(g)+2Cu2O(s)+6H2O(l) ΔH=(4b+ca) kJ·mol-1
(2)2Cu-2e-+2OH-==Cu2O+H2O
(3)B、C
(4)①80% ②100 ③>
(5)相对于N 点而言,M 点温度在500~600 K 之间,温度较高,反应速率较快。M 点CO 的平衡转化率已经达到90%,常压对设备和动力要求低,更经济
提示:(1)根据盖斯定律分析,①+②×4+③可得:
N2H4(l)+4Cu(OH)2(s)==N2(g)+2Cu2O(s)+6H2O(l) ΔH=(4b+ca) kJ·mol-1。
(2)阳极为铜,失去电子生成氧化亚铜,电极反应式为2Cu-2e-+2OH-==Cu2O+H2O。
(3)CO 的消耗速率等于CH3OH 的生成速率,都为正反应速率,不能说明达到平衡,A 项错误;一定条件下,CO 的转化率不再变化,可以说明反应达到平衡,B 项正确;在绝热恒容的容器中,反应的平衡常数不再变化,说明反应体系温度不变,则反应达到平衡,C项正确。
(4)根据“三段式”分析:


(5)从经济和实际情况考虑。
11.(除标注外,每空2分)
(1)B(1分)
(2)①NH3、PH3、AsH3中心原子的孤电子对数均为1,随着N、P、As原子半径的增大,电负性减小,成键电子对之间斥力减小,键角减小 ②sp2
(3)8
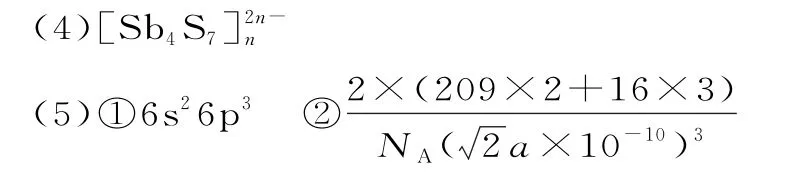
提示:(1)根据能量最低原理,先填充内层,内层填满后,再填充外层。
(2)环状P2-4是平面结构,P 的杂化方式是sp2,由题图可知,4 个P 原子各提供一个电子,又得到2个电子,共同构成大π键,故P2-4中的大π键应表示为π64。
(3)由题图可知,As的最外层有1 个孤电子对,S的最外层有2个孤电子对,2×3+1×2=8。
(4)找出图中重复的结构单元,即可得到结果。

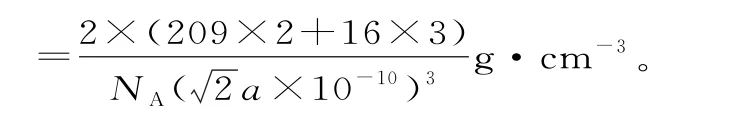
12.(除标注外,每空2分,共15分)
(1)2,3-二甲基-2-丁烯 羰基
(2) 消去反应