生物炭与根际促生菌对辣椒氮素利用率、产量及土壤氮转化的影响
徐达勋 颜振峰


摘要:采用大棚划区试验,设置不施氮肥处理(CK),不施氮条件下施用生物炭和根际促生菌处理(PB),常规施氮处理(NN),常规施氮条件下分别施入根际促生菌处理(NP)、生物炭处理(NB)、根际促生菌+生物炭配施处理(NPB),探索了生物炭与根际促生菌对辣椒氮素利用率、产量及土壤氮转化的影响。结果表明,与CK处理相比,施氮、生物炭、根际促生菌相关处理(NN、NP、NB、NPB)整体提高了辣椒植株的氮素累积量、产量及土壤氮转化,不施氮相关处理(PB、CK)效果相当。在施氮处理中,与NN处理相比,NB、NPB处理均增加了辣椒植株各个器官的氮素累积量,调节了土壤氮代谢酶、提高了生育前期的土壤NO-3-N、NH+4-N含量及土壤硝化螺旋菌屬(Nitrospira)、慢生根瘤菌属(Bradyrhizobium)的丰度,整体以NPB处理较高;NPB处理的产量、氮素利用率(NUE)最高,比NN处理分别显著提高9.13%、6.57%。相关分析结果表明,植株氮含量、产量、NUE与土壤氮组分、氮代谢酶存在显著或极显著相关关系。生物炭和根际促生菌的联合施用,可增加辣椒根际土壤中氮功能菌的增殖和调控N转化酶的活性,增加土壤氮的有效性,从而提高辣椒植株的氮含量、产量及氮素利用率。
关键词:生物炭;辣椒;根际促生菌;氮转化;氮素利用率(NUE);产量
中图分类号:S641.306文献标志码:A文章编号:1002-1302(2023)11-0133-07
根际促生菌(plant growth promoting rhizobacteria,PGPR)指自由生活或附生于植物根系土壤微域的一类有益菌类,它可促进植物生长、提高宿主对矿质营养的吸收和利用,并能抑制有害生物[1]。PGPR具有生物固氮、溶磷、解钾、分泌抗生素及促进激素合成等功能[2]。研究表明,PGPR可以在正常和胁迫环境中促进植物生长,提高土壤肥力和改善土壤质地,因此在农林业中普遍用作生防菌剂、肥料及土壤改良剂,并有望在未来替代化肥和农药[3]。然而,在某些环境中,目标菌株可能无法发挥有效作用,因为菌株在特定环境中可能会因与土著菌株竞争或因条件苛刻而无法生存[4]。载体材料可以通过提供空间保护、改善土壤结构及免受土壤动物取食的特点,使其更有利于微生物的定殖,从而提高微生物接种的成功率[5]。
生物炭(biochar)是植物残体、城市垃圾及畜禽粪便等生物质材料在高温、缺氧条件下热裂解而得到的一类富碳有机物质[6]。生物炭具有良好的孔隙结构、较高的pH值、较大的比表面积及优良的养分底物激发性能[7]。大量研究表明,生物炭可有效降低土壤容重,提高养分有效性,增加土壤保墒性能及吸附金属污染物等,从而改善土壤理化性质,提高土壤肥力[8]。此外,生物炭在调节土壤生物学特性方面也发挥着重要作用。研究表明,外源施用生物炭,可诱导土壤微生物群落发生显著变化,影响土壤微生物的组成和相关种类的丰度[9]。这表明,生物炭有利于土壤微生物的增殖,这些变化可能会驱动养分循环,直接或间接影响植物生长[10]。然而,目前关于生物炭与微生物组配施用的效果知之甚少。
辣椒是全球广泛种植的重要蔬菜之一,是保证民生的重要食材。氮素是辣椒生长发育过程中所需最多的矿质元素之一,氮素对保证辣椒产量、品质及成品风味具有至关重要的作用[11]。然而在辣椒的田间生产中,施氮量与产量间存在阈值。近年来,氮肥的过量施用已成为蔬菜可持续化生产的瓶颈问题,其在造成环境污染的同时伴随着生产成本的增加[12]。目前关于提升辣椒氮素利用率的研究主要集中在优化肥料施用措施、新型肥料研发及新品种培育上,较少关注生物技术对氮素利用及养分周转的影响。基于此,本研究探索了生物炭、根际促生菌对辣椒氮素利用效率、产量及土壤氮转化的影响,以期为农林业可持续发展提供理论依据。
1材料与方法
1.1供试地点与供试材料
试验于2022年4—8月在盐城生物工程高等职业技术学校蔬菜试验大棚中进行。供试辣椒品种为苏椒5号,购自江苏省江蔬种苗科技有限公司。种子于45 ℃水浴中进行表面灭菌15 min,蒸馏水浸泡2 h,采用蔬菜育苗盘培养至4叶期。
供试生物炭购自勤丰众成生物质新材料(南京)有限公司,采用水稻秸秆在低氧、450 ℃条件下连续炭化 45 min 制得,其基本性质为:全碳含量66.72%,总氮含量5.99%,比表面积19.05 m2/g,pH值8.65。PGPR菌株为解胶冻样芽孢杆菌(Bacillus mucilaginosus)、多黏芽孢杆菌(Paenibacillus polymyxa),已证实该复合菌株可有效提高蔬菜植物的生长[4],施用菌落浓度约为2×108CFU/mL。供试氮磷钾肥分别为尿素(46%N)、过磷酸钙(46%P2O5)、氯化钾(60%K2O),均为分析纯,皆购自默克化学试剂(北京)有限公司。大棚0~30 cm表层土壤理化性质:pH值为6.96,有机质、全氮含量分别为31.25、1.69 g/kg,碱解氮、有效磷、速效钾含量分别为130.33、26.01、158.64 mg/kg。
1.2试验设计
试验采用随机区组设计,设置氮素(N)、生物炭(B)、根际促生菌(P)共6个组合处理,分别为:CK处理,不施氮+不接种根际促生菌+不施生物炭处理;PB处理,不施氮+生物炭+接种根际促生菌处理;NN处理,常规施氮+不施生物炭+不接种根际促生菌处理;NP处理,常规施氮+不施生物炭+接种根际促生菌处理;NB处理,常规施氮+生物炭+不接种根际促生菌处理;NPB处理,常规施氮+生物炭+接种根际促生菌处理。每个处理重复3次,共18个小区。每个小区面积为20 m2(5 m×4 m),小区间采用50 cm宽的浅沟拦隔。
施氮处理中,辣椒移栽前条施尿素、过磷酸钙和氯化钾(N 180 kg/hm2,N ∶P2O5∶K2O=5 ∶4 ∶4),无氮处理则施入相应的磷钾肥;生物炭处理施用量为3 000 kg/hm2,根际促生菌处理施用量为100 mL/穴。采用旋转耕茬机以30 cm深度耕作并起垄。辣椒苗移栽为2株/穴,种植密度为52 500株/hm2。NPB处理中,促生菌与生物炭提前拌匀施入。试验过程中辣椒灌溉、除草及病虫害防治按照常规方法进行,试验培育104 d。
1.3样品采集及测定分析
1.3.1土壤、植物样品采集培养结束后,去除 0~1 cm表层土壤。用铁铲将辣椒根系完整挖出,去除距离根系较远的外围土壤,小心抖动根系表面土壤,无法抖落的土壤采用干净刷子轻轻刷落,保存辣椒植株于-20 ℃环境,且将各处理的土壤混合后分为2个部分:一部分保存于-80 ℃,用于土壤微生物丰度分析;一部分保存于-20 ℃,用于土壤酶活性和土壤氮组分分析。
1.3.2辣椒氮素含量、产量因子测定将辣椒果实、根系、茎秆及叶片分离,分别置于105 ℃烘箱中杀青0.5 h,随后于65 ℃烘干至恒质量,采用研磨机研磨过 0.25 mm网筛以测定全氮含量;全氮含量使用H2SO4-H2O2法消化后,采用半微量开氏法测定。氮素利用率(NUE)=(施氮处理辣椒氮总吸收量-不施氮处理辣椒氮总吸收量)/施氮量×100%[13]。辣椒成熟后人工采摘计算挂果数和称量单椒质量,水分比例为辣椒鲜重与干重间的差值再与鲜重之比,每公顷干椒产量由取样面积产量换算得来。
1.3.3土壤硝态氮、铵态氮含量及土壤氮相关酶活性测定土壤铵态氮(NH+4-N)、硝态氮(NO-3-N)均采用KCl浸提,随后分别采用苯酚钠-乙二胺四乙酸二钠、盐酸-乙二胺四乙酸二钠高速溶解,接着采用连续流动分析仪(SmartChem201,AMS/Alliance,Italy)测定。
土壤酶活指标包括硝酸还原酶(NR)、脲酶(UE)、過氧化氢酶(CAT)、中性蛋白酶(NTP)活性,分别采用T007-1-1、A121-1-1、T005-1-1、T016-1-1试剂盒(南京建成生物工程研究所)测定。
1.3.4氮功能菌绝对丰度测定微生物丰度采用微生物群落GeoChip 4.0高通量平台-微阵列系统进行测定分析。称取250 mg样品,采用Soil Genome Extraction Kit试剂盒(SoMio N055,宝生物工程(大连)有限公司 )进行DNA提取。细菌扩增引物采用16S rRNA V3~V4区间:338F(ACTCCTACGGGAGGCAGCAG),806R(GGACTACHVGGGTWTCTAAT)。DNA纯度、数量分别使用紫外分光光度计(Thermo Fisher Scientific,Wilmington,DE)、立体读取系统(Stereo star Optimai BMG Labtech,Jena,Germany)检测。将检测合格的DNA样品进行荧光标记、芯片杂交、扫描,具体步骤参考刘鑫军等的方法[14]。GeoChip 4.0高通量平台-微阵列系统数据的标准化处理采用片间法进行归一化。舍弃信噪比低于2.0的低质量片段,将测定值标准化为数字信息[15]。上述氮功能菌丰度分析委托南京诺禾致源生物科技有限公司完成。
1.4数据处理与统计分析
采用Excel 2016进行数据整理,采用DPS 14.0软件进行单因素方差分析(ANOVA)和相关性分析,采用邓肯式多重比较进行统计分析(α=0.05),采用R语言、Origin 9.1进行图形绘制。
2结果与分析
2.1生物炭与根际促生菌配施对植株氮素分布及利用率的影响
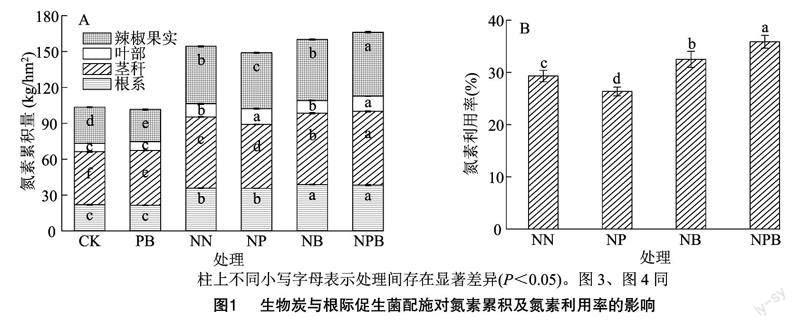
由图1-A可知,辣椒植株各器官氮含量表现为叶部<根系<辣椒果实<茎秆,其中根系、茎秆、叶部、辣椒果实中氮素含量分别占总氮素含量的21.09%~24.19%、35.92%~45.13%、6.53%~8.75%、26.53%~32.19%。从试验数据来看,在根系、茎秆、叶部、辣椒果实的氮含量均以NPB处理最高,各处理氮含量呈CK、PB <NP、NN<NB<NPB,且在任一器官中,NPB处理均显著大于CK、PB、NN处理。而就总氮素含量而言,各处理呈 PB<CK<NP 2.2生物炭与根际促生菌配施对辣椒产量及其构成因子的影响 由表1可知,挂果数中,各处理表现为CK<PB<NP 2.3生物炭与根际促生菌配施对土壤硝态氮和铵态氮含量的影响 由图2可知,无论土壤硝态氮(NO-3-N)还是铵态氮(NH+4-N)含量中,随着生育期推进,各处理整体均呈降低趋势,其中NO-3-N、NH+4-N含量分别在幼苗期至扬花期、扬花期至坐果期阶段降幅最为明显;且无论NO-3-N还是NH+4-N含量中,任一生育期中未施氮处理(CK、PB)的含量均较低。与NB处理相比,生物炭与根际促生菌配施(NPB)处理均提高了辣椒扬花期和成熟期土壤NO-3-N含量以及辣椒扬花期土壤NH+4-N含量。与NN处理相比,NP处理对土壤NH+4-N、NO-3-N含量无显著影响。辣椒成熟期NB、NPB处理的土壤 NO-3-N 含量分别比NN处理显著提高42.79%、87.25%;在辣椒整个生育期,NPB处理的土壤 NO-3-N 含量平均比NB处理高17.33%,这意味着NPB处理可以满足辣椒生长后期养分需求。而对于NH+4-N含量而言,扬花期NB、NPB处理的土壤NH+4-N含量分别比NN处理高81.93%、136.83%。 2.4生物炭与根际促生菌配施对土壤氮代谢酶活性的影响 由图3-A可知,土壤脲酶(UE)活性指标中,各处理表现为CK<PB<NP 2.5生物炭与根际促生菌配施对土壤氮功能菌绝对丰度的影响 由图4-A可知,硝化螺旋菌属(Nitrospira)绝对丰度中,各处理高低表现为CK<NN<NB<NP 2.6土壤氮指标与辣椒植株氮素指标间的相关性分析 由表2可知,土壤硝态氮(NO-3-N)、土壤铵态氮(NH+4-N)含量与植株根系氮、茎秆氮、叶部氮、辣椒果实氮含量及氮总量、产量、氮素利用率均存在极显著正相关关系(P<0.01)。土壤脲酶(UE)、硝酸还原酶(NR)活性与植株根系氮、茎秆氮、辣椒果实氮含量及氮总量、产量、氮素利用率均存在极显著或显著正相关关系。土壤过氧化氢酶(CAT)活性与植株根系氮、茎秆氮、叶部氮、辣椒果实氮含量及氮总量、产量、氮素利用率存在极显著或显著负相关关系。土壤中性蛋白酶(NTP)活性与植株根系氮、茎秆氮、辣椒果实氮含量及氮总量、产量、氮素利用率存在极显著或显著负相关关系。 3讨论与结论 根际促生菌(PGPR)是植物根际重要的微生物组成部分,可通过活化养分、分泌抗生素及诱导植物激素合成等方式促进植物生长发育,现已成为农林业可持续化发展的重要研究领域[7,16]。氮素是叶绿素和有机大分子的重要组成部分,其含量与叶片光合作用和产量密切相关[17]。本研究中,辣椒植株根系、茎秆、叶部、辣椒果实中氮含量均以NB、NPB处理较高;在总氮素含量中,PB处理低于CK处理,且NP处理小于NN处理。许多研究表明,PGPR可促进室内植物生长并增强植物对各种疾病和非生物胁迫的抵抗力,而在田间条件下PGPR效果较差,这通常是由于微生物在根际土壤或植物内胚层中的定殖不足所致[18]。本研究中,植物各器官及总氮素累积量均以NPB处理最高,均显著高于CK、PB、NN处理。大量研究表明,生物炭可通过改善土壤结构而进一步改善土壤孔隙度和通气性,为PGPR在土壤中定殖提供生态位[10], 而高pH值的生物炭以调节酸性土壤的酸碱度[19],这可能是生物炭和PGPR联合应用可以促进植株氮素累积的重要原因之一。 本研究中,氮素配施生物炭处理(NB)时,辣椒产量比常规施氮(NN)显著提高2.99%,表明生物炭对辣椒产量的形成有积极作用。这一结果与前人的研究结果基本一致,即应用生物炭可以改善植物的生长发育及产量收获[20]。然而,氮素配施促生菌处理(NP)使得产量显著降低4.35%。申佳丽等的研究表明,常规施肥下,不同PGPR菌株均对黄瓜幼苗生长发育及土壤根际环境具有积极影响,其中枯草芽孢杆菌(B. subtilis)可显著提高黄瓜产量[21]。本研究结论与之存在差异,两者差异可能与植物种类不同、土著微生物的竞争以及不利的土壤环境因素有关[18],从而影响PGPR的繁殖和活性,使其效果不稳定,甚至导致土壤微生物的功能因竞争受损[4]。生物炭与PGPR结合处理,显著提高了干椒产量,NPB处理分别比NN、NP、NB处理高9.13%、14.10%、5.97%,表明生物炭和PGPR的联合应用具有叠加效应。这可能是由于生物炭具有多孔结构,其丰富的孔隙为微生物提供了可以抵御其他生物入侵的栖息地[22]。 土壤酶系统代表了土壤生物的代谢能力,可以催化土壤生态系统中的生化过程,也可表征土壤的生态功能和土壤养分转化过程的强度和方向[23-24]。土壤微生物群落的变化也会影响土壤酶活性,部分微生物可介导胞外酶活性。土壤脲酶(UE)、中性蛋白酶(NTP)活性通常与土壤微生物的数量有关[25],并且随着有机质含量的增加而增强[26]。本研究中,与常规施肥(NN)处理相比,单独施用生物炭(NB)处理使UE、NTP活性分别提高了17.20%、25.51%,而与PGPR结合(NPB)使用时分别提高了34.41%、48.77%,表明施用生物炭可以提高土壤微生物群落数量和酶活性,生物炭与PGPR联合施用可以产生更显著的协同效应。 本研究中,土壤脲酶(UE)、中性蛋白酶(NTP)活性提高,而过氧化氢酶(CAT)、硝酸还原酶(NR)活性降低,这可导致土壤中NH+4-N与NO-3-N间发生转换,从而调节辣椒各生育期土壤可利用氮的供应。NPB、NB处理显著提高了辣椒扬花期—坐果期土壤NH+4-N的含量,且PGPR与生物炭的应用增加了土壤中硝化螺旋菌属(Nitrospira)和慢生根瘤菌属(Bradyrhizobium)的丰度。高丰度的固氮菌群有利于微生物生态位分化及非共生固氮,螺旋亚硝酸盐序列簇细菌群落对高氨环境迅速反应,从而促进硝化作用,增加土壤中亚硝酸盐和NO-3-N的含量[27]。此外,成熟期NPB处理的土壤NO-3-N含量均明显大于NN、NP、NB处理。肥料利用效率主要取决于作物对养分的吸收能力以及土壤和肥料养分的供给能力[28]。本研究中,NPB处理的氮素利用率(NUE)分别比NN、NP、NB处理增加6.57、9.52、3.37百分点。综上,生物炭和PGPR的联合施用,增加了辣椒根际土壤中氮功能菌的绝对丰度,调控了与N转化相关的土壤酶活性,促进了N的转化和循环,增加了土壤N的有效性,提高了辣椒植株对N的吸收累积,从而提升了植物的氮素利用率。 参考文献: [1]付严松,李宇聪,徐志辉,等. 根际促生菌调控植物根系发育的信号与分子机制研究进展[J]. 生物技术通报,2020,36(9):42-48. [2]Kong Z Y,Liu H G. Modification of rhizosphere microbial communities:a possible mechanism of plant growth promoting rhizobacteria enhancing plant growth and fitness[J]. Frontiers in Plant Science,2022,13:920813. [3]Zhang C,Wang M Y,Khan N,et al. Potentials,utilization,and bioengineering of plant growth-promoting Methylobacterium for sustainable agriculture[J]. Sustainability,2021,13:3941. [4]Wang Y,Li W Q,Du B H,et al. Effect of biochar applied with plant growth-promoting rhizobacteria (PGPR) on soil microbial community composition and nitrogen utilization in tomato[J]. Pedosphere,2021,31(6):872-881. [5]李永兴,匡柏健,李久蒂. 不同载体对微生物菌剂质量的影响[J]. 土壤肥料,1999(6):25-27. [6]Lin Q,Tan X F,Almatrafi E,et al. Effects of biochar-based materials on the bioavailability of soil organic pollutants and their biological impacts[J]. Science of the Total Environment,2022,826:153956. [7]常青. 生物炭與氮肥配施对玉米叶片氮素利用及代谢的影响[J]. 江苏农业科学,2022,50(20):86-94. [8]李毅,冯浩,梁嘉平,等. 土壤属性和作物生长对生物炭施用的响应和反馈研究进展[J]. 水土保持学报,2022,36(5):9-16. [9]Yi S S,Chang N Y,Imhoff P T. Predicting water retention of biochar-amended soil from independent measurements of biochar and soil properties[J]. Advances in Water Resources,2020,142:103638. [10]Schmidt H P,Kammann C,Hagemann N,et al. Biochar in agriculture:a systematic review of 26 global meta-analyses[J]. GCB Bioenergy,2021,13(11):1708-1730. [11]吴玥,寇智瑞,陈新平,等. 氮肥供应对辣椒营养品质的影响及评价[J]. 西南大学学报(自然科学版),2021,43(1):87-94. [12]韩瑛祚,司鹏飞,王秀娟,等. 减量施氮对保护地辣椒生长发育的影响[J]. 北方园艺,2017(22):71-75. [13]袁嫚嫚,邬刚,王家宝,等. 不同铵硝配比对辣椒产量、养分积累和氮肥利用率的影响[J]. 中国瓜菜,2022,35(2):43-48. [14]刘鑫军,魏洪杰. 氮添加对樟子松人工林氮转化及相关功能基因丰度的影响[J]. 广西植物,2022,42(7):1077-1087. [15]Zhang Y G,Liu X,Cong J,et al. The microbially mediated soil organic carbon loss under degenerative succession in an alpine meadow[J]. Molecular Ecology,2017,26(14):3676-3686. [16]Khatoon Z,Huang S L,Rafique M,et al. Unlocking the potential of plant growth-promoting rhizobacteria on soil health and the sustainability of agricultural systems[J]. Journal of Environmental Management,2020,273:111118. [17]武悅萱,张辉,王苗苗,等. 氮磷配施对小麦生长、叶片叶绿素含量及叶绿素荧光特性的影响[J]. 江西农业学报,2020,32(2):9-15. [18]Kent A D,Triplett E W. Microbial communities and their interactions in soil and rhizosphere ecosystems[J]. Annual Review of Microbiology,2002,56(1):211-236. [19]孙宇龙,张永利,苏有健,等. 生物质炭对土壤物理结构性状和水分特征影响的研究进展[J]. 江苏农业科学,2022,50(23):25-32. [20]Rafael R B A,Fernndez-Marcos M L,Cocco S,et al. Benefits of biochars and NPK fertilizers for soil quality and growth of cowpea (Vigna unguiculata L.Walp.) in an acid arenosol[J]. Pedosphere,2019,29(3):311-333. [21]申佳丽,曹树槟,焦甜甜,等. 7株根际促生菌对设施小黄瓜生长发育及土壤根际环境的影响[J]. 甘肃农业大学学报,2021,56(4):51-60,68. [22]苏彩霞,董旭. 根际促生菌与生物炭制剂对辣椒生长发育及土壤改良效果的影响[J]. 山东农业科学,2021,53(12):109-117. [23]Lee S,Kim M,Kim J,et al. Use of soil enzymes as indicators for contaminated soil monitoring and sustainable management[J]. Sustainability,2020,12(19):8209. [24]王芳,王晓立,张颖,等. 设施蔬菜复种连作对土壤理化性质和生物学特性的影响[J]. 江苏农业科学,2022,50(7):214-220. [25]闫东良,何灵芝,李欢,等. 控释尿素和普通尿素配比对不同氮效率玉米叶片衰老特性和土壤酶活性的影响[J]. 生态学报,2021,41(23):9410-9421. [26]Roscoe R,Vasconcellos C A,Furtini-Neto A E,et al. Urease activity and its relation to soil organic matter,microbial biomass nitrogen and urea-nitrogen assimilation by maize in a Brazilian Oxisol under no-tillage and tillage systems[J]. Biology and Fertility of Soils,2000,32(1):52-59. [27]Posmanik R,Gross A,Nejidat A. Effect of high ammonia loads emitted from poultry-manure digestion on nitrification activity and nitrifier-community structure in a compost biofilter[J]. Ecological Engineering,2014,62:140-147. [28]Chien S,Prochnow L,Cantarella H. Chapter 8 recent developments of fertilizer production and use to improve nutrient efficiency and minimize environmental impacts[J]. Advances in Agronomy,2009,102:267-322.

