生物质气化耦合高温热重整制合成气的反应行为分析
王永斌,张 健,梁万才,曹国强,李春玉,赵建涛,*,房倚天
(1. 中国科学院山西煤炭化学研究所 煤转化国家重点实验室,山西 太原 030001;2. 中国科学院大学,北京 100049;3. 上海电气集团国控环球工程有限公司,山西 太原 030006)
生物质具有来源广、碳中性、储量大、循环周期短等优点[1]。随着“双碳”目标的实施,生物质将成为未来能源和材料领域的重要原料之一。但生物质气化产生大量难以分离且污染严重的焦油,限制其规模化的高效清洁利用。现有生物质气化焦油的处理工艺存在催化剂易中毒以及积炭失活[2]、工艺过程繁杂、焦油脱除设备负荷重、生产过程污染严重等问题。而生物质气化耦合高温非催化热重整技术,可将焦油组分转化为合成气,具有流程简单、不使用催化剂、洁净高效的优点,以及较大的发展潜质,但是目前关于该工艺的研究仍处于起步阶段[3],尤其对其反应动力学和机理方面的研究有待进一步深入。
生物质气化焦油组分多且含量少,一般采用C6H6、C7H8、C10H8、C6H5OH 和C4H4O 分别模拟焦油中的初级焦油组分、次级焦油组分、大分子难转化芳烃、含氧芳香族化合物和其他含氧有机物[4]。典型生物质气化粗合成气成分如表1 所示[5],粗合成气中CH4占主要成分,CH4的清洁高效转化对重整过程有重要影响。王胜等[6]对CH4部分氧化过程进行了热力学分析,发现O2/CH4应为0.42-0.74,当O2/CH4> 8.4 时,则开始发生合成气燃烧反应。Lutz 等[7]研究发现,重整反应的热效率随着O2含量的升高而降低。同时,Freitas 等[8]使用GAMS 软件对CH4部分氧化重整过程进行分析,发现O2含量中等,温度高于900 ℃有利于合成气的生成。而对于甲烷三重整过程(TRM),Wei 等[9]、唐强等[10]指出,温度高于800 ℃就能取得良好的重整效果。目前,CH4重整已经有了深入的热力学分析,但是生物质粗合成气重整还需要系统的热力学计算。

表1 生物质气化粗合成气组成[5]Table 1 Composition of raw gas of the biomass gasification[5]
动力学研究是反应器设计的关键,重整过程的动力学研究,主要集中在CH4和焦油的反应动力学方面。陈玉民等[11]和Simeone 等[12]对氧气气氛下甲烷重整过程进行研究,发现该过程可分为快速反应阶段和慢速反应阶段。Wang 等[13]研究了焦油模型化合物(萘和笓)水蒸气重整时的反应模型和反应途径。研究发现,萘和笓的反应路径比较相似,生成的轻质气态产物前体分别为苯和萘,而乙炔则是碳烟(soot)生成的前体。Savchenko等[14,15]对C1-C4有机物蒸气的CO2重整过程进行模拟研究。分析发现,作为特定状况下自由能最低的碳氢化合物,C2H2是有机化合物转化过程中不可避免的中间体,同时也是重要的碳烟前体。通过上述分析发现,对于CH4以及C1-C4的重整过程已有深入的研究,但是对于包含生物质粗合成气全组分的动力学分析还有待进一步的深入。
本研究通过热力学计算和动力学分析确定合理的反应温度、O2/粗合成气比例,在得到较高合成气产量的同时降低焦油的含量。利用Chemkin软件分析重整反应的动力学过程,阐述了粗合成气重整过程中主要组分的转化路径和反应机理,为生物质热转化利用提供可供参考理论指导。
1 实验部分
1.1 热力学计算方法
对于复杂组分的热力学平衡组分计算,通常采用最小Gibbs 自由能方法。利用化学平衡时系统中各物质的Gibbs 自由能之和最小原理,确定每一组分在热力学平衡状态时的平衡含量。通常一个物质的Gibbs 自由能可以使用该物质的定压热容(Cp)、焓(H)和熵(S)计算得出。对于给定的化学反应系统,其热力学参数计算方法如下:
式中,A、B、C、D、Hi,f和Hi,tr等数据均可在热力学数据库中查到,GT可以使用上式计算得出,通过最小化GT可以确定热力学平衡状态的组成。
1.2 动力学分析方法
本实验采用Chemkin-Pro 软件分析重整过程中的动力学过程。Chemkin 计算时首先要读取机理文件,机理文件中包含计算所需的基元反应动力学和物质物性的基本参数。目前,甲烷[16]、乙烷、乙烯等有机物反应应用最多的是NUIGMech1.1机理。NUIGMech1.1 涉及2747 种化学物质、11279个基元反应,其中,每种物质的物性参数包括热力学参数和传递参数,动力学参数包括指前因子、温度系数和活化能。这些参数都是经过不断的拟合、修正而得到,可以准确的反映过程中各种物质的反应速率和变化趋势。
1.3 数据处理
数据处理过程中,反应物的转化率定义如下:
xj:反应物j的转化率,如:CH4、C2H4等;
Fj,in(out):反应物的入口(出口)流量,单位:mol/s。根据xj的定义,如果在反应进行的初期某一反应物作为中间产物而被生成,则其转化率变为负值,显然此时使用产率对其进行描述更为恰当,但是为了后文阅读方便,均采用转化率对其进行描述。
2 结果与讨论
2.1 生物质气化粗合成气高温热重整的热力学分析
热力学计算可以确定反应进行的方向和可能性。高温热重整中要通入大量的O2将CH4等有机物转化为合成气,为此计算了不同温度和O2含量时的热力学平衡状态。计算基于表1 中的粗合成气组分,结果见图1,其中,Tar(焦油)为分子量大于C6H6的所有有机物的总和、light hydrocarbons(轻质烃类)指介于C1-C6的所有烃类。
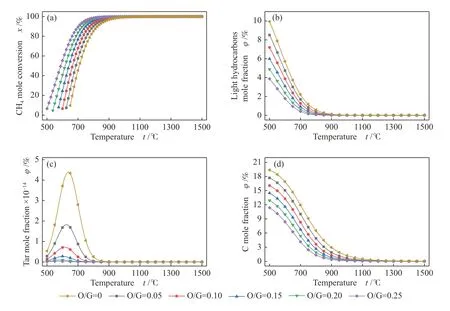
图1 温度对不同组成平衡产物的影响Figure 1 Effect of temperature on equilibrium products with different composition
重整反应温度对平衡产物的组成有较大的影响。图1 中,焦油组分的含量在600 ℃左右时达到峰值;轻质烃类的含量随着温度的升高而降低,CH4作为其最难转化的组分,在温度达到1000 ℃时才被完全转化;固体碳含量随温度的升高而降低,其被完全消除的温度为1100 ℃。由此可以推断,低温热力学平衡状态时,粗合成气中的有机组分转化为CO2、H2O、C(固体)和CH4;当热力学平衡温度升高时,C(固体)和CH4的平衡含量降低,有机组分主要转化为CO 和H2。碳被消除温度为1100 ℃,这与Savchenko 等[14]的研究结果相符合,与李建伟等[17]的差异较大,主要因为粗合成气体系中含有大量的焦油和小分子有机物导致积炭消除的温度偏高。所以,为了减少积炭、提高合成气含量,温度至少应为1100 ℃。
重整过程中通入O2可以提高有机物的转化率。如图1 所示,对于相同的反应温度,O2含量升高可以导致平衡时轻质烃类、固体碳和焦油的含量降低,CH4转化率升高。可见O2可以促进CH4等有机物的转化,从而降低焦油组分的平衡含量。以往的研究报道指[7,18,19]指出,O2增加使合成气和CH4的燃烧反应占主导地位,在其深度氧化为H2O 和CO2的同时提高重整过程的温度,继而提高C、焦油和CH4的转化率。因此,O2对于反应的影响存在双重作用,一方面,O2的加入可以降低CH4和焦油等有机物的含量;另一方面,O2含量升高会导致H2和CO 的含量降低。当O/G 低于0.1 时,产物中的轻质烃类、焦油和积炭的含量偏高;当O/G 为0.2 时,各种有机物和固体碳的含量明显下降,但过高的O2会消耗合成气中的有效组分。O/G 小于0.1 或者大于0.2 都不利于重整过程的高效运行,O/G 的合理取值应该为0.1-0.2。
由以上热力学分析可知,粗合成气重整运行的最低温度应为1100 ℃,O/G 为0.1-0.2。
2.2 生物质气化粗合成气重整过程的动力学分析
2.2.1 重整反应温度的影响
基于前文的热力学计算结果,主要研究温度为1100、1200、1300 和1400 ℃时重整过程中干基(dry basis,db)合成气含量以及焦油、CH4和C2H4的反应动力学行为特点,如图2 所示。小分子烃类中CH4和C2H4转化需要的时间最长,其他小分子烃类在反应进行的0.1 s 之内基本被完全转化,所以小分子烃类中只列出了CH4和C2H4的转化率变化状况。图2(d)中,C2H4的转化率在反应初期为负值,这说明,C2H4作为其他组分转化的中间产物,在反应进行的初期被大量生成而导致含量上升、转化率为负。
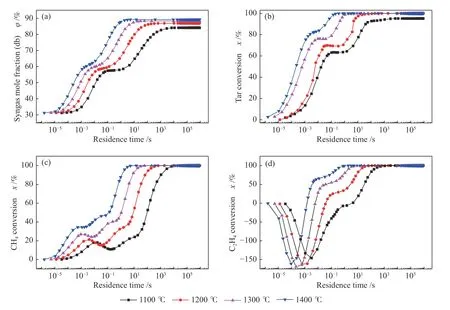
图2 温度变化对重整过程的影响Figure 2 Effect of temperature change on reforming process
由图2 可见,相同反应时间,合成气的干基含量随着温度的升高而增加,焦油、CH4和C2H4的转化率也表现出了相同规律。图2(a)中,1.5 s 时反应基本进行完全,此时1300 和1400 ℃的干基合成气含量均达到最大值90%左右,而1200 和1100 ℃尚未达到平衡状态,其干基合成气含量随反应时间的延长略有增加。同时,1.5 s、1200 ℃时,焦油、CH4和C2H4的转化率分别为82.54%、34.2%和39.8%;当温度为1400 ℃时,焦油、CH4和C2H4的转化率分别增长为99.25%、57.10%和86.00%。可见温度对干基合成气含量以及焦油、CH4和C2H4的转化率有较大的影响,提高温度可以显著的提高重整效果。
干基合成气含量以及焦油转化率随时间变化有明显的规律性,但是CH4和C2H4的转化率随时间变化规律比较复杂。以1200 ℃时的数据为例,随着反应的进行,合成气含量的增加主要集中在第一阶段:(1 × 10-4)-(1 × 10-2)s 和第二阶段:0.1-100 s 两个阶段。焦油转化率上升的时间和干基合成气含量升高的时间具有一致性。同时可以发现,第一阶段内合成气的增加幅度小而焦油转化率升高幅度大,第二阶段刚好相反,这说明,在第一阶段发生小分子焦油组分裂解生成少量的合成气,在第二阶段大分子焦油组分裂解生成大量的合成气。与焦油和合成气相比,CH4和C2H4的变化更加复杂,主要原因是,CH4和C2H4是小分子化合物,作为反应过程中多数大分子有机物裂解的中间产物,其含量很容易受到其他有机物裂解的影响。
经过上述分析,高温有利于重整反应的进行,同时由于干基合成气含量和焦油转化率是评价重整过程的重要参数,为此,图3 对比了停留时间为1.5 s 时,温度对干基合成气含量和焦油转化率的影响。比较发现,反应温度升高会导致干基合成气含量增加,焦油转化率上升;当温度达到1300 ℃时,焦油转化率几乎不再变化,同时干基合成气含量的上升也趋于平缓。可见当温度达到1300 ℃后,继续升高温度的作用并不明显,所以,与Savchenko等[14]的研究结果相似,将重整过程控制在1300 ℃比较合理。
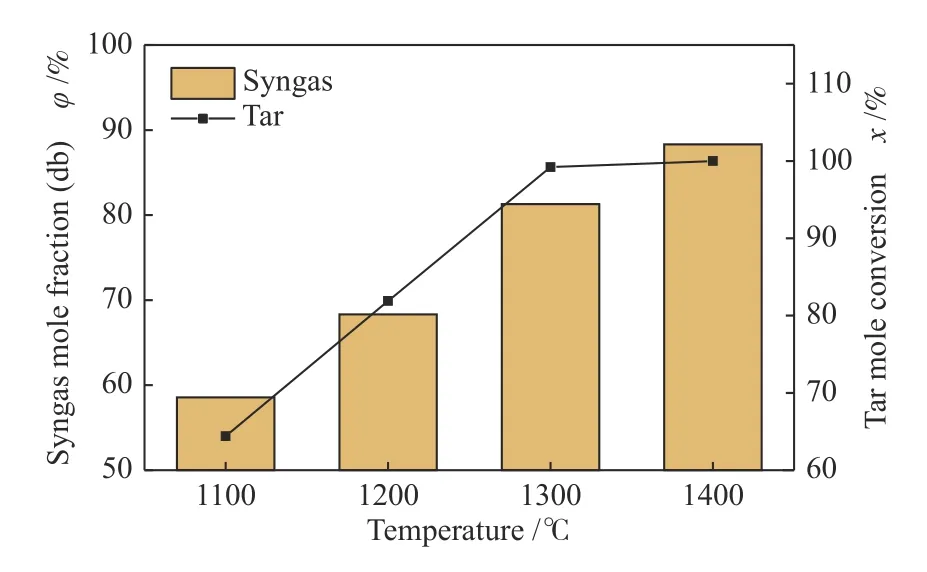
图3 温度对重整产物的影响Figure 3 Effect of temperatures on reforming products
2.2.2 O2 含量对重整过程的影响
根据之前的热力学计算结果,O/G 的变化为0.1-0.2。因此,分析了1300 ℃、O/G 分别为0.1、0.13、0.16 和0.19 时的动力学过程,具体结果见图4。由图4 发现,随着O/G 的增大,焦油和CH4的转化率逐渐增大;而O/G 对干基合成气含量和C2H4转化率的影响则比较复杂。O/G 对干基合成气含量的影响主要分为两个阶段,第一阶段:(2 × 10-4)-0.1 s,合成气的含量随着O/G 的增加而增加;第二阶段:0.1 s 之后,合成气的含量随着O/G 的增加而减少。与陈玉民等[11,12]的研究结果相似,含有O2的粗合成气重整过程也分为两个阶段;第一个阶段发生有机组分同O2的氧化反应,生成一定量的H2和CO;第二部分发生有机组分同CO2和H2O 的重整反应,生成大量的H2和CO。第一阶段时,O2含量越高,反应生成的合成气越多;第二阶段时,随着反应的进行,O2总体上消耗产物中的合成气,所以此时合成气的含量随着O2含量的增加而减少。O/G 对C2H4转化率的影响也主要分为两个阶段,第一阶段:(1 × 10-5)-(3 × 10-3)s,C2H4转化率随着O/G 的增加而减少;第二阶段:3 × 10-3s之后,C2H4转化率随着O/G 的增加而增加。可能原因为,反应过程中C2H4主要来自于C2H6的裂解反应,第一阶段O2促进C2H6的裂解反应,生成大量的中间产物C2H4;第二阶段C2H6基本被完全转化,而O2促进C2H4的转化。

图4 不同O/G 比对重整过程的影响Figure 4 Effect of O/G change on reforming process
比较而言,1.5 s 以后,CH4和C2H4的转化率受O/G 的影响并不显著,其主要受重整温度的影响。为了进一步对比O/G 对重整过程中干基合成气含量和焦油转化率的影响效果,图5 展示了停留1.5 s 时,不同O/G 所对应的重整产物中干基合成气含量和焦油转化率。分析图中数据,当O/G从0.10 上升到0.19 时,干基合成气含量从83.79%下降至78.87%,焦油转化率从98.26%上升至99.76%。当O/G 为0.16 时,焦油转化率为99.60%、干基合成气含量为81.07%,继续升高O2含量,焦油转化率升高放缓,但是干基合成气含量大幅度下降。可见当O/G 低于0.16 时,产物中焦油的含量偏高;O/G 高于0.16,产物中焦油转化率略有升高,但是干基合成气含量偏低,因此,将O/G 确定为0.16 比较合理。
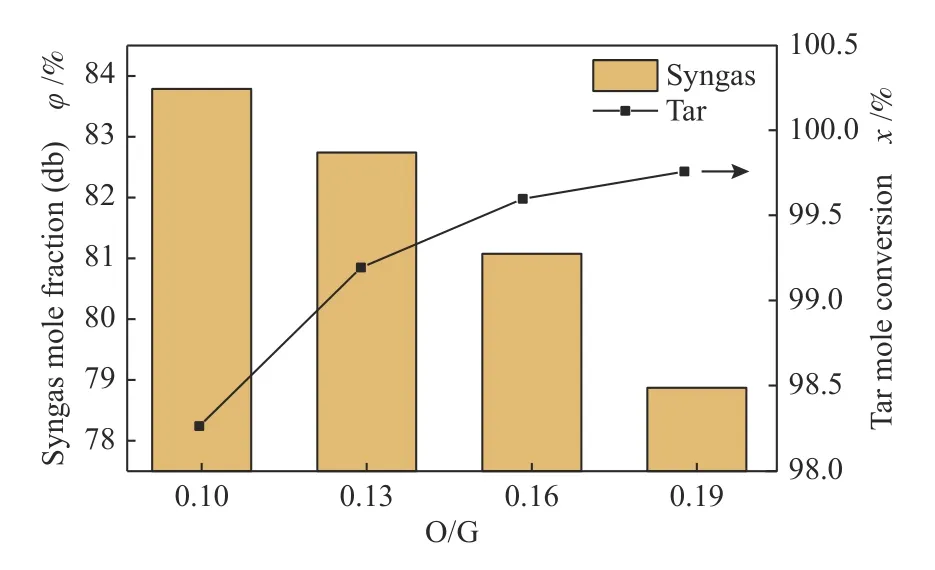
图5 O/G 比对重整产物的影响Figure 5 Effect of different O/G on reforming products
综上所述,合理的温度和O/G 分别为1300 ℃、0.16,1.5 s 时反应基本进行完全,此时产物中合成气的干基摩尔分数为81.07%,焦油转化率可达99.60%。
2.3 反应机理分析
为了探究重整过程中大分子有机物的转化路径,分析温度1300 ℃、O/G 为0.16 条件下的重整过程,考察有机组分的转化规律,结果如图6 和7 所示。
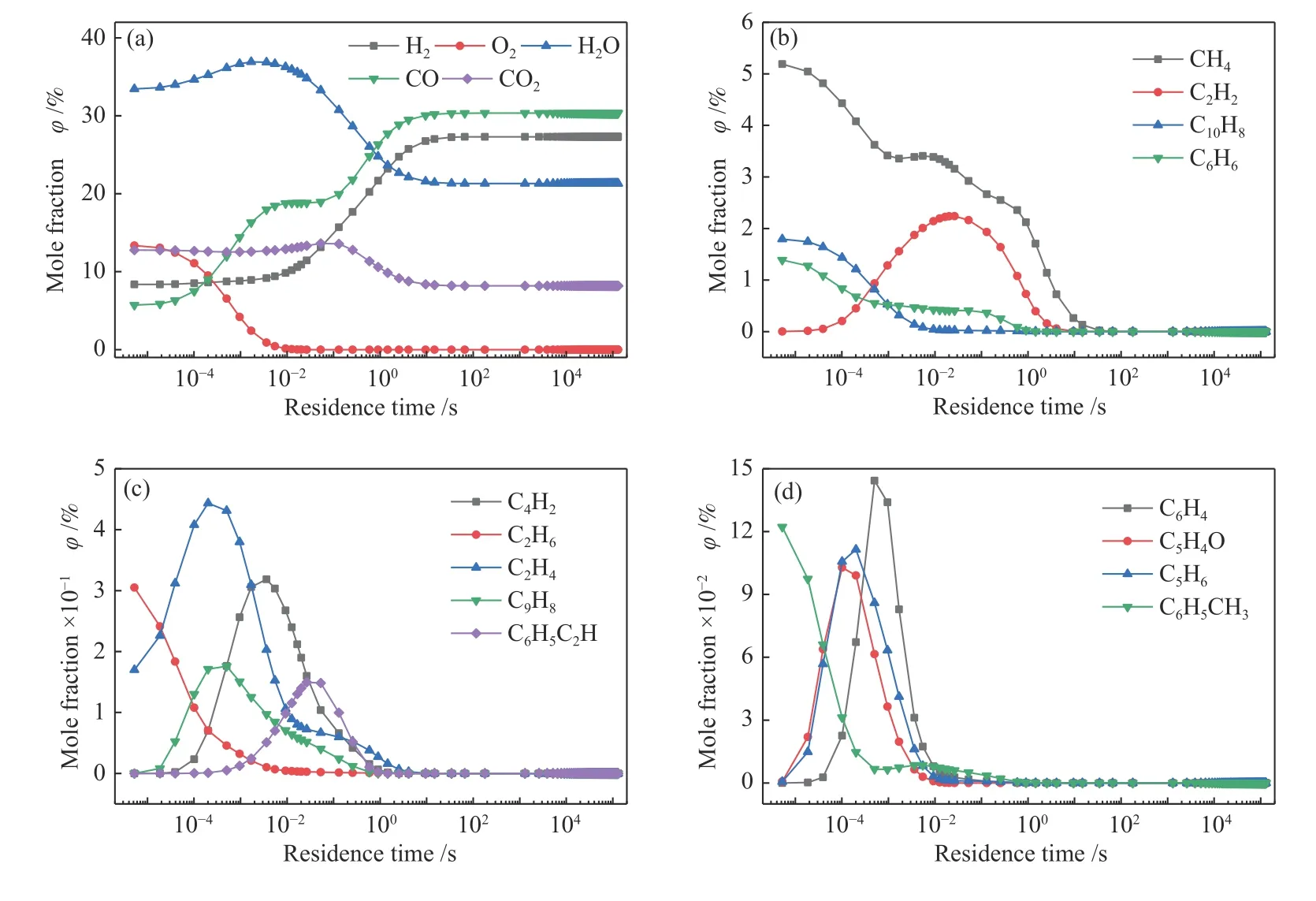
图6 组分摩尔分数随反应停留时间的变化Figure 6 Variations of component molar composition with reaction residence time
图6 为重整过程中不同物质的摩尔分数随停留时间的变化规律。其中,C2H2的摩尔分数变化最为显著,当停留时间为0-3 × 10-2s 时,其分数逐渐上升至2%;随后在3 × 10-2-8 s 时,逐渐减少至0。通过比较可以发现,在C2H2分数上升的同时,CH4、C2H6、C6H6、C4H4O、C6H5CH3和C10H8的分数急剧下降,这说明,CH4、C2H6、C6H6、C4H4O、C6H5CH3和C10H8在转化过程中生成大量的中间产物C2H2,从而导致C2H2分数在反应过程中大量累积。
图6 中,CH4的反应主要分为两个阶段:第一阶段发生在0-(1 × 10-3)s,此时伴随着O2含量的大量减少;第二阶段发生在(1 × 10-3)-10 s,此时伴随着CO2和H2O 含量的显著减少。这可以印证之前的结论,重整反应主要分为两个阶段进行,第一阶段主要发生O2同有机组分的重整反应,主要产物有H2O、CO 和H2,该阶段随着O2的完全消耗而结束;第二阶段主要发生H2O、CO2同有机组分的反应,主要产物为H2和CO,该阶段随着有机组分的完全消耗而结束。
图7 为重整过程中不同物质的摩尔转化率随反应时间的变化。图7(a)中,各组分随着反应的进行而逐渐减少,图7(b)中的C2H4和C6H5OH 在第一阶段作为中间产物被大量累积,之后随着反应的进行而逐渐消耗。同时发现,粗合成气有机组分C2H6、C4H4O、C6H6、C6H5CH3、C6H5OH 和C10H8,在反应进行1 s 时,其转化率基本达到100%。CH4最难被转化,其完全转化所需要的反应时间大概为40 s。可见随着反应时间的延长,粗合成气中的有机组分可以被完全反应,此结果与之前的热力学计算结果相吻合。
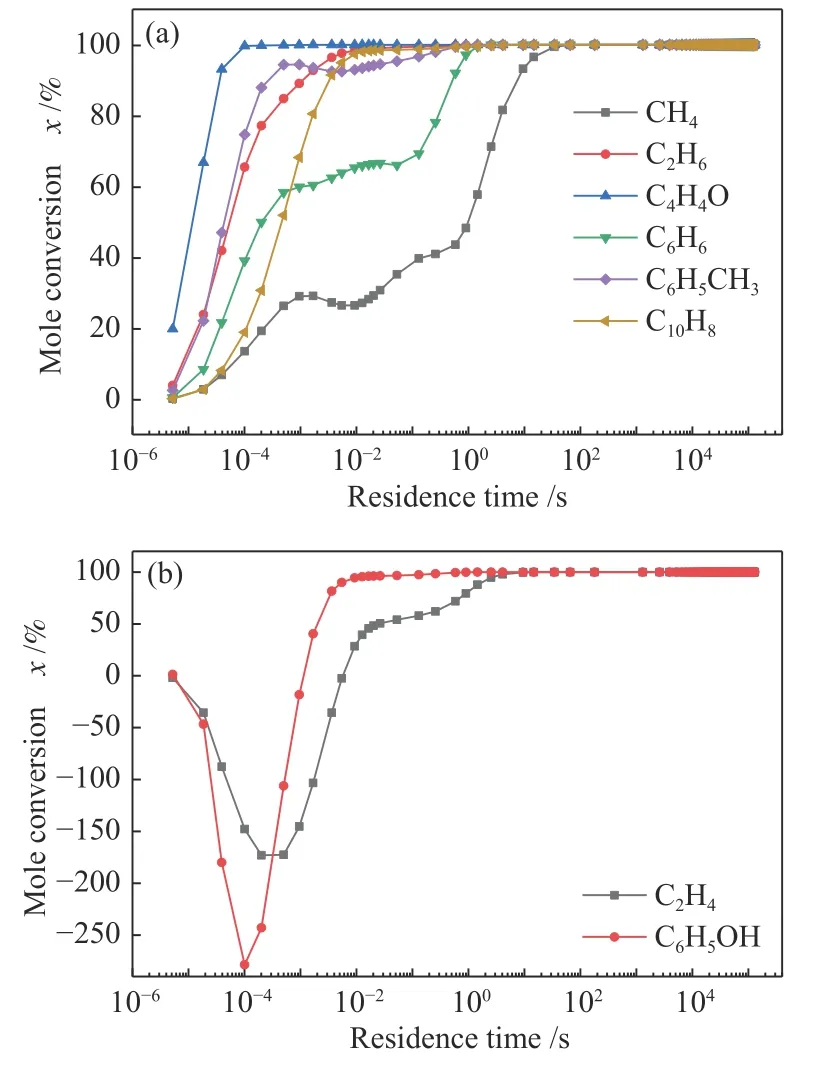
图7 组分摩尔转化率随停留时间的变化Figure 7 Variation of molar conversion of components with residence time
为了清楚地认识粗合成气重整过程中焦油的转化机理,分析每个物质的含量变化,结合Jess[20]的研究结果,提出粗合成气重整过程中焦油等有机组分的可能反应路径,如图8 所示。结合图6中的数据,以CO 的浓度变化为依据,将整个反应过程分为四个阶段。反应的初始阶段(0-(1 × 10-4)s)主要发生C6H5CH3和C2H6的热解反应,生成大量的C6H4、C5H4O、C5H6和C2H4。第二阶段在(1 ×10-4)-(3 × 10-3)s时,发生C10H8和CH4的热解反应,生成C9H8、C2H2和大量的CO,此阶段CO 的含量大量升高。第三阶段在(3 × 10-3)-(3 × 10-2)s时,此时反应的中间产物C9H8、C2H4、C4H2转化为C6H5C2H、C6H6以及一定量的CH4和H2。之后在(3 × 10-2)-4 s,中间产物C2H2、CH4和C2H4被转化为CO 和H2,此时CO 和H2的摩尔分数大幅升高。

图8 重整过程中焦油的转化路径示意图Figure 8 Possible reaction pathway for tar conversion in reforming
C2H2是焦油转化过程中比较重要的中间产物,芳烃、含氧化合物等有机物在转化过程中都会生成中间产物C2H2。其中,C2有机物在重整过程中会首先转化为C2H2;呋喃则是先转化为丁炔,之后转化为C2H2;CH4在反应中会有一部分聚合成C2H2;大分子芳香族化合物裂解过程中会产生大量的C1/C2小分子自由基,这些自由基随后就转化为C2H2。生成的C2H2经过反应(7)-(9)转化为CO和·CH2、·CH3、·C2H3。当O2过量时,生成的CO 将被继续转化为CO2。
由图8 可知,O2参与反应的方式主要有三种,第一种是与苯环发生反应生成酚和一定量的·OH自由基和·O 自由基,从而促进苯环的裂解;第二种是同CH4反应生成·CH3自由基和·OH 自由基,促进CH4以及其他有机物的裂解;第三种是同H2和CO 等小分子物质反应生成H2O 和CO2。可见O2对重整过程的影响主要有两个方面,O2作为氧化剂提供有机物裂解所需要的热量;O2裂解产生的自由基攻击难转化的有机物,促进其转化为合成气。但是,过量的O2会同产物中的合成气发生燃烧反应,减少产物中有效组分的含量。可见在重整过程中加入适量的O2是必要的。
3 结论
本实验主要对生物质气化粗合成气高温非催化重整过程进行热力学计算和动力学分析,主要研究了温度、O2用量对反应过程的影响,分析并提出粗合成气重整过程中主要组分的转化路径和反应机理,主要结论如下。
重整反应过程中,温度对平衡产物的组成有较大的影响。焦油组分的含量在600 ℃左右时达到峰值,CH4在1000 ℃时可被完全转化,固体碳在1100 ℃被完全消除。
粗合成气非催化重整过程主要分为两个阶段,第一阶段主要发生O2同CH4等有机物的快速氧化反应,生成CO 和少量的H2,同时放出大量的热量;第二阶段发生有机物同CO2和H2O 的重整反应,生成大量的CO 和H2。
焦油转化率和合成气含量随着重整温度的升高而升高,当温度高于1300 ℃,温度对重整过程的影响效果逐渐下降。O2的用量对重整过程的影响是双重的,一方面,O2含量的升高会提高重整反应的温度,促进焦油等有机物的转化;另一方面,O2同H2和CO 反应,降低产物中有效组分的含量。O/G 的合理取值应该为0.1-0.2。热力学和动力学综合分析表明,在1300 ℃、O/G 为0.16 的情况下进行重整反应比较合理,此时合成气干基含量为81.07%,焦油组分转化率可达99.60%。
C2H2具有稳定的化学结构,是CH4、C2H4、C9H8和C6H6重整过程中生成的主要中间产物,其在反应后期逐步转化为H2和CO。

