三七总皂苷基于PI3K/Akt/mTOR通路调控自噬和泛素蛋白积累对大鼠肾缺血再灌注损伤的影响
王 华,谭 超,2,3,王子焱,张 涛,李鑫成
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2. 国医大师熊继柏教授传承工作室,湖南 长沙 410007;3. 湖南中医药大学中医学国内一流建设学科,湖南 长沙 410208;4. 湖南中医药大学研究生院,湖南 长沙 410036;5. 湖南中医药大学医学院,湖南 长沙 410036)
缺血再灌注损伤(ischemia-reperfusion injury,IRI)是急性肾损伤的主要原因,在泌尿外科和肾移植手术中经常发生。IRI的发病机制复杂,细胞死亡(凋亡和程序性坏死)、氧化应激、内质网应激、能量耗竭等均参与了IRI的发生发展[1-3]。近年来发现自噬在IRI所致的急性肾损伤中被激活并发挥保护作用[4],且自噬与凋亡在急性肾损伤发病中存在密切联系,并共享诸多分子信号通路,其中磷酸肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)通路介导自噬与凋亡的交互作用,激活该信号通路能抑制凋亡,增强自噬[4-6]。除自噬外,泛素-蛋白酶体系统(UPS)是真核细胞的另一种重要的降解机制。UPS主要负责降解短寿命和可溶性错误折叠蛋白质,而自噬则主要降解长寿命、不溶性蛋白质聚集体甚至整个功能失调或多余的细胞器。尽管它们的工作模式和对底物识别的要求不同,但UPS和自噬均可通过泛素化作为降解信号来识别并消除错误折叠/未折叠的蛋白质[7]。此外,UPS和自噬代谢过程中的重要组成蛋白可互为彼此的降解底物[8],而抑制UPS时自噬会代偿性增加[9],但目前关于UPS在急性肾损伤中的研究较少。三七总皂苷是三七的主要活性成分,具有抗炎和抗氧化应激作用[10],其可通过自噬途径缺氧诱导因子1α(HIF-1α)/B细胞淋巴瘤基因-2(Bcl-2)/腺病毒E1B19kDa相互作用蛋白3(BNIP3)减轻心肌缺血再灌注损伤[11],但其对急性肾损伤的保护作用及机制尚不清楚。本研究旨在探讨三七总皂苷是否可通过激活PI3K/Akt/mTOR通路调控自噬和UPS相关蛋白保护IRI所致急性肾损伤。
1 实验材料和方法
1.1实验动物 雄性SPF级SD大鼠30只,8周龄,体重(200±25)g,购自湖南斯莱克景达实验动物有限责任公司,生产许可证号:SYXK(湘)2020-0010。所有动物饲养在无特定病原体的设施中,保持温度22 ℃,湿度55%左右,12 h昼夜节律并自由进食和饮水。
1.2实验药物、仪器与试剂 三七总皂苷(云南云科药业有限公司),Experion全自动电泳系统(Bio-rad公司,美国),苏木精-伊红染色试剂盒(上海碧云天公司),小鼠抗大鼠β-肌动蛋白单克隆抗体(Sigma,美国),小鼠抗大鼠半胱氨酸天门冬氨酸酶3(Caspase-3)单克隆抗体(Sigma,美国),小鼠抗大鼠Bcl-2关联蛋白X(Bax)单克隆抗体(Sigma,美国),小鼠抗大鼠Bcl-2单克隆抗体(Sigma,美国),小鼠抗大鼠mTOR单克隆抗体(Sigma,美国),小鼠抗大鼠p-mTOR单克隆抗体(美国),小鼠抗大鼠Akt单克隆抗体(Sigma,美国),小鼠抗大鼠p-Akt(Ser473)单克隆抗体(Sigma,美国),白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-18(IL-18) ELISA试剂盒(BD生物科学公司,美国),丙二醛(MDA)、活性氧(ROS)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)试剂盒(中国南京建城生物工程研究所),Rotor-Gene SYBR®Green PCR Kit试剂盒(Qiagen公司,美国)。
1.3实验方法 将30只大鼠随机分为模型组、三七总皂苷低剂量组、三七总皂苷高剂量组,每组10只。3组大鼠均进行IRI造模:腹腔注射氯胺酮(120 mg/kg)麻醉大鼠,游离出双侧肾脏,切除右肾,钝性分离左侧肾蒂血管,应用无创动脉夹夹闭左肾动脉和静脉诱导缺血(肾脏由红色逐渐均匀变暗呈紫黑色代表肾血流阻断成功)。缺血45 min后松开并取出无创动脉夹,以肾脏颜色从紫黑色变为鲜红色为再灌注成功。在应用无创动脉夹前1 h,模型组大鼠尾静脉注射1 mL等渗盐水,三七总皂苷低剂量组大鼠尾静脉注射三七总皂苷10mg/kg(溶于1 mL等渗盐水中),三七总皂苷高剂量组尾静脉注射三七总皂苷20 mg/kg(溶于1 mL等渗盐水中)。术后模型组每天尾静脉注射1次等渗盐水,三七总皂苷低、高剂量组每天尾静脉注射1次相应剂量三七总皂苷,均连续3 d。
1.4检测指标及方法
1.4.1肾功能指标和炎症因子水平 术后第4天,尾静脉取血,以1 000 ×g离心10 min分离血浆,采用生化分析仪检测血清肌酐(Cr)、尿素氮(BUN)水平,使用ELISA试剂盒说明检测IL-1β、IL-6、IL-18水平。
1.4.2肾组织病理形态 取各组大鼠肾脏,在低温预冷的生理盐水中小心去除肾脏包膜,取一半肾脏组织在4%多聚甲醛中固定24h,石蜡包埋,制备4 μm厚切片,苏木精-伊红染色,光学显微镜下观察组织病理学形态。
1.4.3肾组织中氧化应激指标含量 取各组大鼠的肾脏,用10×(w/v)冰冷的PBS(50 mmol/L,pH 7.8)匀浆,4 ℃下13 000 ×g离心3 min,采用相应试剂盒检测MDA、ROS、SOD和LDH含量。
1.4.4肾组织中PI3K/Akt/mTOR信号通路和凋亡相关蛋白表达情况 将大鼠肾脏组织称重后加入含有cocktail及磷酸酶抑制剂的裂解液,利用组织研磨仪在冰上充分研磨,冰上裂解30 min,以10 000 r/min在4 ℃下离心10 min,取上清进行蛋白浓度测定。吸取20~50 μg总蛋白样品,按蛋白样品:上样缓冲液体积4∶1的比例加入5×上样缓冲液并充分混匀,置于水浴锅中100 ℃煮沸10 min,使蛋白质充分变性。利用10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分析,随后200 mA恒流90 min将SDS-PAGE凝胶上的蛋白转移至聚偏氟乙烯(PVDF)膜上,取出PVDF膜,封闭液孵育1 h,加入对应的一抗[小鼠抗大鼠β-肌动蛋白单克隆抗体(1∶400)、小鼠抗大鼠Caspase-3单克隆抗体(1∶400)、小鼠抗大鼠Bax单克隆抗体(1∶400),小鼠抗大鼠Bcl-2单克隆抗体(1∶400)、小鼠抗大鼠mTOR单克隆抗体(1∶400)、小鼠抗大鼠p-mTOR单克隆抗体(1∶400)、小鼠抗大鼠Akt单克隆抗体(1∶400)、小鼠抗大鼠p-Akt(Ser473)单克隆抗体(1∶400)],4 ℃摇床孵育过夜。次日,将PVDF膜取出,1×TBST清洗3次,每次10 min。随后,将膜与适当的辣根过氧化物酶耦联的二抗(1∶5 000,上海碧云天公司)室温孵育1 h,1×TBST清洗3次,每次10 min。利用ECL显影液避光孵育PVDF膜,使用化学发光成像系统曝光显影成像,采用Image J软件计算分析各蛋白相对表达量。
1.4.5肾组织中自噬相关蛋白和泛素化蛋白mRNA表达情况 使用TRIzol®和氯仿方法从肾脏组织中提取总RNA,用NanoDrop2000分光光度计测定RNA浓度。在200 μL无酶EP管中,依次加入相应体积的5×gDNA Eraser Buffer、gDNA Eraser以及肾组织RNA,无酶水补齐体积至10 μL。涡旋混匀并离心后,放入PCR 仪中以42 ℃,2 min,4 ℃程序反应以去除全基因组DNA。将PrimeScriptRT Enzyme MixⅠ、PT Primer Mix、5×PrimeScript Buffer加入去基因组DNA样品中,配制20 μL反转录体系。涡旋混匀并离心后,放入PCR仪中37 ℃ 15 min,85 ℃ 5 s,4 ℃反应以完成反转录。使用Rotor-Gene SYBR®Green PCR Kit对Beclin-1、自噬相关蛋白8(ATG8)、微管相关蛋白轻链3(LC3)Ⅱ/Ⅰ、肿瘤坏死因子相关因子6(TRAF6)、 Beclin-1调节自噬蛋白-1(AMBRA1)、神经前体细胞表达发育下调因子4(NEDD4) 进行实时RT-PCR。配制荧光定量PCR扩增反应体系:5 μL SYBR premix Ex TaqⅡ、0.4 μL Forward primer、0.4 μL Reverse primer、0.2 μL ROX、3 μL无RNA 酶水,1 μL cDNA,配制为10 μL反应体系。分别加入到八排管中,每组设置3个复孔。引物反应条件:预变性,95℃ 30s,1个循环;95 ℃ 10 s,60 ℃ 1 min,30个循环;95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s结束,4 ℃保存。记录各个孔的CT值,采用2-ΔΔCT定量方法进行数据分析。引物序列见表1。

表1 RT-PCR引物序列
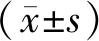
2 结 果
2.1各组大鼠肾功能指标和炎症因子水平比较三七总皂苷高剂量组和三七总皂苷低剂量组BUN、Cr、IL-1β、IL-6和IL-18水平均明显低于模型组(P均<0.05),且三七总皂苷高剂量组BUN、Cr、IL-1β、IL-6和IL-18水平均明显低于三七总皂苷低剂量组(P均<0.05)。见表2。
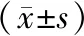
表2 各组肾缺血再灌注损伤大鼠肾功能指标和炎症因子水平比较
2.2各组大鼠肾脏组织HE染色病理形态 模型组大鼠肾脏组织血管周围扩张充血,肾小管扩张,细胞水肿,管腔内蛋白质聚集,三七总皂苷高剂量组和三七总皂苷低剂量组病理损伤明显轻于模型组。见图1。

图1 各组肾缺血再灌注损伤大鼠肾脏组织HE染色病理形态(×100)
2.3各组大鼠肾组织中氧化应激指标含量 三七总皂苷高剂量组和三七总皂苷低剂量组MDA、ROS、LDH含量均明显低于模型组(P均<0.05),且三七总皂苷高剂量组均明显低于三七总皂苷低剂量组(P均<0.05);三七总皂苷高剂量组和三七总皂苷低剂量组SOD含量均明显高于模型组(P均<0.05),且三七总皂苷高剂量组明显高于三七总皂苷低剂量组(P<0.05)。见表3。
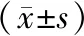
表3 各组肾缺血再灌注损伤大鼠肾组织中氧化应激指标含量比较
2.4各组大鼠肾组织中PI3K/Akt/mTOR信号通路蛋白表达情况 与模型组比较,三七总皂苷高剂量组和三七总皂苷低剂量组p-Akt、PI3K蛋白相对表达量均明显升高(P均<0.05),p-mTOR蛋白相对表达量均明显降低(P均<0.05);与三七总皂苷低剂量组比较,三七总皂苷高剂量组p-Akt、PI3K蛋白相对表达量均更高(P均<0.05),p-mTOR蛋白相对表达量更低(P<0.05)。见图2及表4。
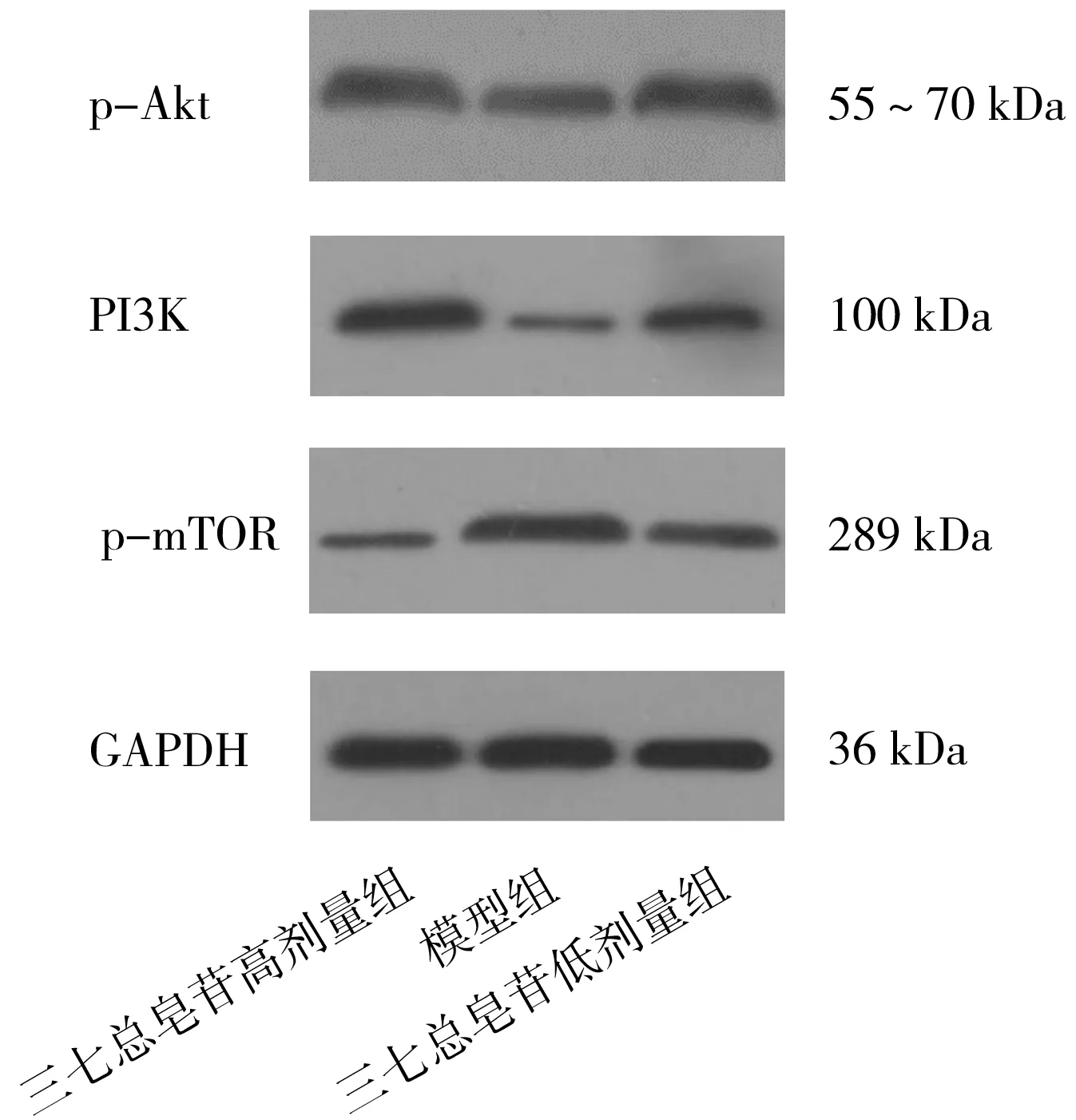
图2 各组肾缺血再灌注损伤大鼠肾组织中p-Akt、PI3K、p-mTOR蛋白表达情况
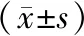
表4 各组肾缺血再灌注损伤大鼠肾组织中p-Akt、PI3K、p-mTOR蛋白相对表达量比较
2.5各组大鼠肾组织中凋亡蛋白表达情况 与模型组比较,三七总皂苷高剂量组和三七总皂苷低剂量组Caspase-3和Bax蛋白相对表达量均明显降低(P均<0.05),Bcl-2蛋白相对表达量均明显升高(P均<0.05);与三七总皂苷低剂量组比较,三七总皂苷高剂量组Caspase-3和Bax蛋白相对表达量均更低(P均<0.05),Bcl-2蛋白相对表达量更高(P<0.05)。 见图3及表5。
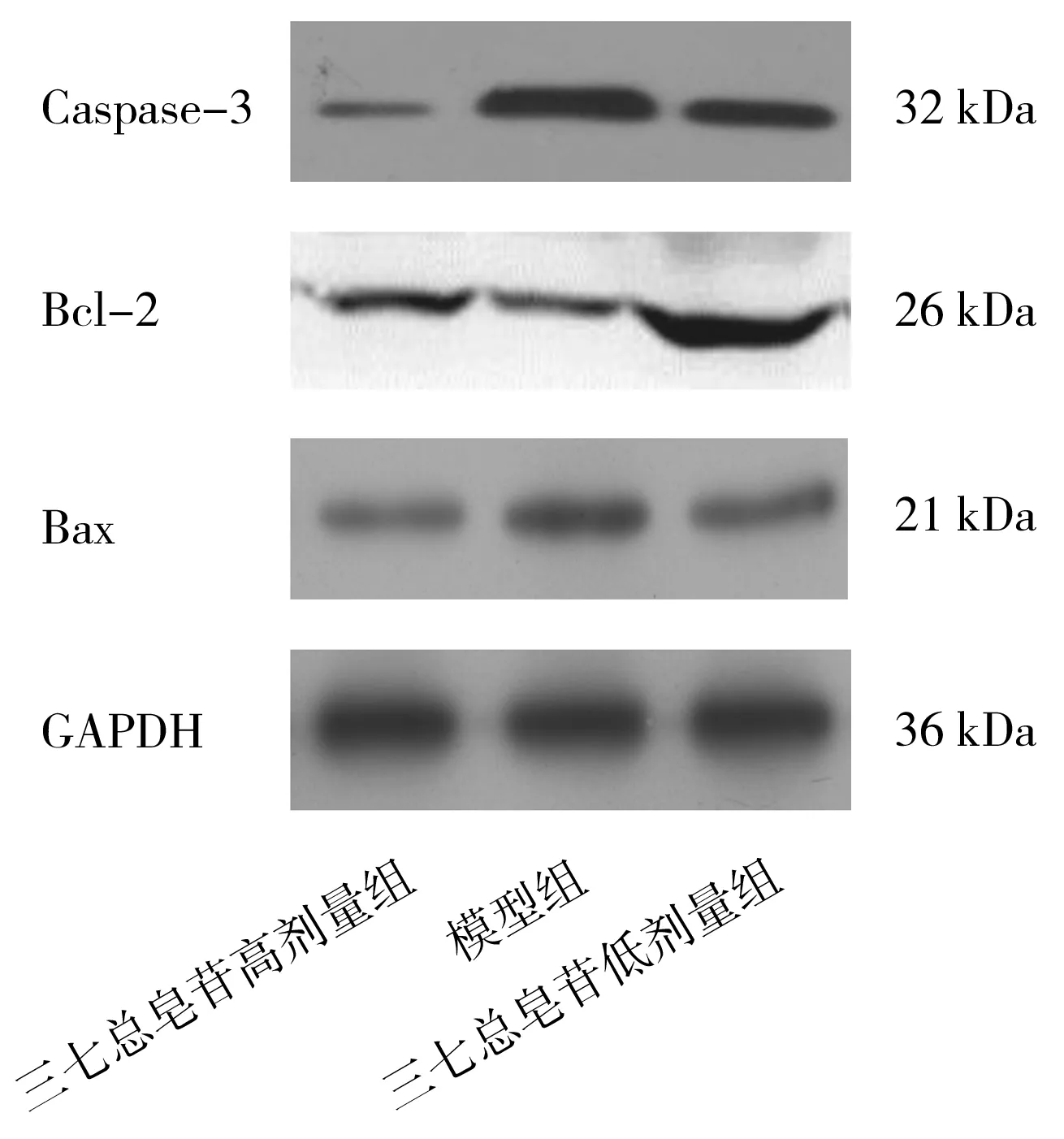
图3 各组肾缺血再灌注损伤大鼠肾组织中凋亡蛋白表达情况
表5 各组肾缺血再灌注损伤大鼠肾组织中凋亡蛋白相对表达量比较
2.6各组大鼠肾组织中自噬相关蛋白mRNA表达情况 三七总皂苷高剂量组和三七总皂苷低剂量组Beclin-1、ATG8和LC3 Ⅱ/Ⅰ mRNA相对表达量均明显高于模型组(P均<0.05),且三七总皂苷高剂量组Beclin-1、ATG8和LC3 Ⅱ/Ⅰ mRNA相对表达量均明显高于三七总皂苷低剂量组(P均<0.05)。见表6。
表6 各组肾缺血再灌注损伤大鼠肾组织中自噬相关蛋白mRNA相对表达量比较
2.7各组大鼠肾组织中泛素化蛋白mRNA表达情况 与模型组比较,三七总皂苷高剂量组和三七总皂苷低剂量组TRAF6和AMBRA1 mRNA相对表达量均明显升高(P均<0.05),NEDD4 mRNA相对表达量均明显降低(P均<0.05);与三七总皂苷低剂量组比较,三七总皂苷高剂量组TRAF6和AMBRA1 mRNA相对表达量均更高(P均<0.05),NEDD4 mRNA相对表达量更低(P<0.05)。见表7。
表7 各组肾缺血再灌注损伤大鼠肾组织中泛素化蛋白mRNA相对表达量比较
3 讨 论
PI3K/Akt通路在细胞增殖、凋亡、自噬和炎症的调节中起作用。mTOR是PI3K/Akt通路的重要下游靶标,影响蛋白质合成,被认为是自噬的基本控制器。PI3K/Akt/mTOR信号通路激活能抑制细胞凋亡,激活自噬,减弱ROS活性,减轻炎症反应[12-14]。细胞凋亡途径包括死亡受体介导的外源性凋亡途径、以线粒体为中心的内源性凋亡途径和内质网应激途径。在外源性凋亡途径中,死亡受体与配体在细胞膜上结合导致Caspase-8募集和活化,进一步激活下游Caspase-3诱导细胞凋亡[15]。而当细胞应激激活内源性细胞凋亡途径时,促凋亡的BH3蛋白抑制抗凋亡蛋白Bcl-2、Bcl-XL、Bcl-W,随后激活促凋亡蛋白Bax等,在线粒体外膜上形成多孔缺陷,从而使得凋亡因子细胞色素C等从细胞器释放到细胞质中,导致Caspase-9的募集和活化,而Caspase-9经过蛋白水解加工后激活下游Caspase-3,发生Caspase依赖性凋亡[16-17]。由此可见,无论是在外源性还是内源性凋亡途径中,Caspase-3均作为了凋亡的效应分子。氧化应激是IRI的重要因素,在细胞凋亡中起关键作用。MDA、LDH、SOD和ROS在维持细胞内氧化和还原平衡中起关键作用,是急性肾损伤发病过程中评价氧化应激的主要指标[18-19]。IL-1β通常由循环中被激活的单核细胞、组织内浸润性的巨噬细胞和中性粒细胞分泌产生,主要参与全身的免疫反应[20];IL-6是一种B细胞刺激因子,其表达水平在急性肾损伤患者血清和尿液中均升高[21];IL-18也被称为干扰素-γ诱导因子,属于IL-1超家族,其也在损伤的肾小管上皮细胞中表达升高[22-23]。因此,IL-1β、IL-6和IL-18均被视作急性肾损伤的生物标志物。本实验结果发现,三七总皂苷高剂量组和三七总皂苷低剂量组BUN、Cr、IL-1β、IL-6、IL-18水平和肾组织中MDA、ROS、LDH含量及p-mTOR、Caspase-3、Bax蛋白相对表达量均明显低于模型组,肾组织中SOD含量和p-Akt、PI3K、Bcl-2蛋白相对表达量均明显高于模型组,病理损伤明显轻于模型组。表明三七总皂苷通过激活PI3K/Akt/mTOR信号通路,抑制氧化应激、炎症反应和细胞凋亡,减轻肾损伤,保护肾功能。
研究表明,自噬在IRI所致体内外急性肾损伤模型中被激活[4]。PI3Ks分为三类,它们均参与自噬的调控,其中Ⅰ类PI3K的激活通过经典的PI3K/Akt/mTORC1途径抑制自噬,而Ⅲ类PIK3C3/Vps34与PIK3R4、自噬蛋白Beclin形成蛋白复合物,产生自噬起始和进展所必需的磷脂酰肌醇3-磷酸[24]。自噬激活常表现为LC3-Ⅰ向LC3-Ⅱ的转化,LC3Ⅱ/Ⅰ比率与自噬体形成呈正相关。ATG8蛋白及LC3是自噬发生的关键因子,而多种泛素化相关蛋白也参与了自噬的调控。其中AMBRA1能将蛋白激酶ULK1募集到泛素连接酶TRAF6,后者能促进ULK1泛素化,促进自噬。与TRAF6和AMBRA1相反,泛素连接酶NEDD4可促进Beclin-1蛋白酶体降解以抑制自噬[25-26]。本实验结果显示,三七总皂苷高剂量组和三七总皂苷低剂量组肾组织中Beclin-1、ATG8、LC3 Ⅱ/Ⅰ、TRAF6、AMBRA1 mRNA相对表达量均明显高于模型组,NEDD4 mRNA相对表达量均明显低于模型组。说明三七总皂苷可以通过PI3K/Akt/mTOR通路激活自噬,可调控UPS相关蛋白的表达促进自噬。
综上所述,三七总皂苷可通过激活PI3K/Akt/mTOR通路,促进UPS相关蛋白的表达诱导自噬,从而抑制氧化应激和炎症反应,减轻肾缺血再灌注损伤。
利益冲突:所有作者均声明不存在利益冲突。

