上皮性卵巢癌组织中FoxM1的表达及其临床意义
覃熙媛,朱 莹,李伟滔,郑晓玲,梁远秋
(南方医科大学第十附属医院/东莞市人民医院病理科,广东 东莞 523058)
上皮性卵巢癌是最常见的卵巢癌类型,因极容易发生盆腔及腹腔内广泛播散转移,上皮性卵巢癌死亡率一直处于恶性妇科肿瘤前列[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)已被证实在上皮源性恶性肿瘤细胞侵袭和转移中具有重要作用,上皮细胞EMT 过程受到多种基因转录和翻译水平的调节[2]。叉头框转录因子M1(forkhead box M1,FoxM1)是叉头框转录因子家族成员之一,在细胞周期调控和维持染色体稳定中具有重要作用,是调控细胞增殖、凋亡的重要因子。已有研究发现FoxM1 在多种恶性肿瘤发生、进展以及侵袭和转移中具有明显的促进作用[3],FoxM1 高表达能够明显促进鼻咽癌[4]、非小细胞肺癌[5]细胞增殖和EMT。但FoxM1 在上皮性卵巢癌EMT过程中的作用尚无相关报道,故本研究以上皮性卵巢癌、卵巢交界性肿瘤患者作为研究对象,探讨了卵巢肿瘤组织中FoxM1的表达与患者病理指标和EMT两个关键标志物——E-钙黏蛋白(E-cadherin)和波形蛋白(vimentin)的相关性,现报道如下。
1 材料与方法
1.1 组织标本
收集2018年1月—2020年12月东莞市人民医院收治并手术切除的上皮性卵巢癌石蜡存档标本41例,其中,高级别浆液性癌22例、低级别浆液性癌5例、透明细胞癌7 例、黏液性癌5 例、内膜样癌2 例;年龄23~78 岁,中位年龄51 岁;临床分期:采用FIGO 分期,I~II 期23 例、III~IV 期18 例;有脉管瘤栓6 例;淋巴结转移9 例。纳入标准:①经手术切除组织病理学诊断为上皮性卵巢癌;②术前未接受放疗、化疗、免疫治疗等相关治疗;③临床资料完整。排除合并其他恶性肿瘤者。并收集同期卵巢交界性肿瘤石蜡存档标本17 例,其中交界性浆液性肿瘤12 例、交界性黏液性肿瘤5 例;年龄24~58 岁,中位年龄43 岁。选择同期行子宫肌瘤手术患者的正常卵巢组织20例作为对照,年龄54~79岁,中位年龄62.5岁。
1.2 试剂与仪器
鼠抗人FoxM1 单克隆抗体购自美国Abcam 公司,兔抗人E-cadherin、鼠抗人vimentin 单克隆抗体、免疫组织化学试剂盒及DAB染色试剂盒均购自北京中杉金桥生物技术有限公司;BX41型光学显微镜购自日本Olympus公司。
1.3 方 法
1.3.1 资料收集收集患者年龄、肿瘤组织大小、病理分期、组织学分型、有无脉管瘤栓、有无淋巴结转移等资料。本研究经东莞市人民医院医学伦理委员会审查通过(KYKT2020-052)。
1.3.2 免疫组化检测组织中FoxM1、E-cadherin、vimentin 蛋白表达将手术切除组织进行石蜡包埋后切成3 μm厚度薄片,采用链霉素抗生素蛋白-过氧化酶免疫组化染色法(S-P)检测相应组织中FoxM1、Ecadherin和vimentin蛋白表达,实验操作步骤严格按照试剂盒说明书进行。分别以已知FoxM1、E-cadherin和vimentin 阳性的卵巢癌样本作为阳性对照,以磷酸盐缓冲液代替一抗作为阴性对照。
1.3.3 免疫组化结果判读将细胞特定位置呈浅黄色至棕黄色的细小颗粒视为阳性,其中FoxM1定位于细胞核中,E-cadherin 蛋白主要表达在细胞膜和细胞质中,vimentin 蛋白主要表达在细胞质中。阳性表达的分级采用兼顾阳性细胞染色强度和阳性细胞所占百分比的判断标准,选取5 个400 倍视野,当阳性细胞比例≤10%者评定为0分,>10%~25%者评定1分,>25%~50%者评定为2分,>50%~75%者评定为3分,>75%者评定为4 分;不显色或显色模糊者评定为0 分,浅黄色者评定为1 分,棕黄色者评定为2 分,棕褐色者评定为3 分。阳性细胞数结果与染色强度结果相乘即得最终的染色总分。FoxM1 与E-cadherin 的染色总分≥4分时为高表达,<4分时为低表达[6-8]。vimentin的染色总分≥2分时为高表达,<2分为低表达[9]。
1.4 统计学方法
采用SPSS 25.0 软件对本研究数据进行统计学处理和分析。计数资料表示为例数(百分比),组间比较进行卡方检验;等级资料多组间比较采用Kruskal-Wallis 检验进行比较,两组间采用Mann-Whitney 检验进行比较,采用Spearman 分析FOXM1、E-cadherin 和vimentin 蛋白表达水平的相关性,并采用四格表关联分析计算Phi 系数(φ)进行检验。P<0.05 为差异具有统计学意义。
2 结 果
2.1 上皮性卵巢癌组织、卵巢交界性肿瘤及正常卵巢组织中FoxM1蛋白表达情况
上皮性卵巢癌组织中FoxM1 蛋白阳性表达率为95.12%,其中高表达的有21例,占全部卵巢癌组织的51.22%;卵巢交界性肿瘤中FoxM1蛋白阳性表达率为58.82%,其中高表达的有1 例,占全部卵巢交界性肿瘤组织的5.88%;FoxM1 蛋白在正常卵巢组织中无阳性表达,统计结果见表1。

表1 上皮性卵巢肿瘤组织和正常卵巢组织中FoxM1蛋白表达情况[例数(百分率)]
卵巢癌组织中FoxM1蛋白阳性表达率和高表达率均显著高于卵巢交界性肿瘤组织和正常卵巢组织(P<0.05),卵巢交界性肿瘤组织中FoxM1蛋白的阳性表达率显著高于正常卵巢组织(P<0.05),分析结果见表2。

表2 上皮性卵巢肿瘤组织和正常卵巢组织中FoxM1蛋白表达情况比较
2.2 上皮性卵巢癌组织、卵巢交界性肿瘤及正常卵巢组织中E-cadherin和vimentin蛋白表达情况
上皮性卵巢癌组织中E-cadherin 和vimentin 蛋白阳性表达率分别为82.93%和70.73%,其中高表达分别有22 例和19 例,分别占全部卵巢癌组织53.66%和46.34%。卵巢交界性肿瘤组织中E-cadherin 和vimentin 蛋白阳性表达率分别为100.00%和41.18%,其中高表达分别有13例和4例,分别占全部卵巢交界性肿瘤组织的76.47%和23.53%。正常卵巢组织除少许易脱落的表面上皮外,其余大部分为间质细胞,E-cadherin 和vimentin 在间质中阳性表达率分别为25.00%和80.00%,统计结果见表3。FoxM1、Ecadherin、vimentin 蛋白在多种卵巢上皮性肿瘤及正常卵巢组织中的表达情况见图1。
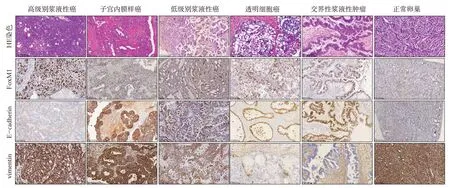
图1 FoxM1、E-cadherin、vimentin蛋白在多种卵巢上皮性肿瘤及正常卵巢组织中的表达(×200)

表3 上皮性卵巢肿瘤组织和正常卵巢组织中E-cadherin和vimentin蛋白表达情况[例数(百分率)]
2.3 FoxM1蛋白在上皮性卵巢癌组织中表达的特征
本研究发现FoxM1蛋白在卵巢透明细胞癌组织中表达具有明显的异质性。在肿瘤的部分区域呈现低表达,在肿瘤的部分区域呈现高表达。免疫组化染色结果见图2。
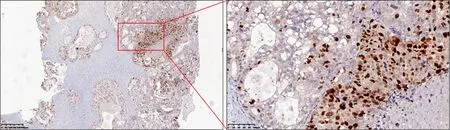
图2 FoxM1蛋白在透明细胞癌中表达存在瘤内异质性
2.4 卵巢癌组织中FoxM1、E-cadherin 和vimentin蛋白表达情况与患者临床病理指标的关系
卵巢癌组织中FoxM1、E-cadherin和vimentin蛋白表达情况与患者临床分期(χ2=4.630,P=0.031)、有无淋巴结转移(χ2=6.549,P=0.01)有关,而与年龄(χ2=1.205,P=0.272)、肿瘤大小(χ2=1.101,P=0.294)、有无 脉 管 瘤 栓(χ2=0.176,P=0.675)、组 织 学 分 型(χ2=4.847,P=0.183)、两级分级(χ2=1.093,P=0.296)无明显相关。临床分期III~IV 期、有淋巴结转移患者卵巢癌组织中FoxM1、vimentin 蛋白高表达率分别显著高于I~II 期、无淋巴结转移患者,而E-cadherin 高表达率则显著低于I~II 期、无淋巴结转移患者,差异有统计学意义(P<0.05)。分析结果见表4。

表4 上皮性卵巢癌组织中FoxM1、E-cadherin和vimentin蛋白表达情况与临床病理指标的关系
2.5 上皮性卵巢癌组织中FoxM1、E-cadherin 和vimentin表达水平的相关性
Spearman 相关性分析结果如表5 所示,上皮性卵巢癌组织中FOXM1、vimentin 蛋白表达水平间存在正相关关系(φ=0.562,P<0.05),但二者与E-cadherin蛋白表达水平间均存在负相关关系(φ值分别为-0.440和-0.366,均为P<0.05)。

表5 上皮性卵巢癌组织中FoxM1与E-cadherin 和vimentin 蛋白表达水平的相关性
3 讨 论
上皮性卵巢癌约占全部卵巢癌病例的90%,多数患者在确诊时已经发生盆腹腔广泛散播,造成多数患者预后极差,死亡率极高[10]。通过探究上皮性卵巢癌发生、转移和侵袭的分子机制对于新型药物研发以及制定新的治疗策略至关重要。
FoxM1是一种重要的细胞周期调控蛋白,在G0期细胞中几乎不表达,在G2/M 期呈高水平表达,并参与了多个细胞周期相关基因转录水平的调控。研究发现,FoxM1是一种原癌基因,在多种恶性肿瘤组织中呈高表达状态,并与患者预后密切相关[11]。但FoxM1具体的致癌机制及其在肿瘤细胞侵袭转移中的作用机制尚未阐明。本研究发现上皮性卵巢癌组织中FoxM1蛋白阳性表达率为97.56%,高表达率为68.29%,显著高于正常卵巢组织,提示FoxM1可能参与了上皮性卵巢癌的发生。
本次研究进一步分析了上皮性卵巢癌组织FoxM1与患者病理指标的相关性,发现卵巢癌组织中FoxM1蛋白表达情况与患者临床分期、有无淋巴结转移、两级分级有关,临床分期III~IV 期、有淋巴结转移、HGSC 患者卵巢癌组织中FoxM1 蛋白高表达率分别显著高于I~II 期、无淋巴结转移、LGSC 患者,提示FoxM1 与上皮性卵巢癌进展、转移有关,也再次说明FoxM1是上皮性卵巢癌的促癌因子。
本研究发现FoxM1蛋白在卵巢透明细胞癌组织中表达具有明显的异质性。在肿瘤的部分区域呈现低表达,在肿瘤的部分区域呈现高表达,此结果尚无文献报道。
EMT是上皮性卵巢癌发生淋巴结转移、盆腹腔广泛散播的生物学基础之一,EMT能够使上皮细胞失去正常的上皮表型、极性,从而获得间质表型和功能,EMT化后的癌细胞能够发生迁移,并和基质细胞相互作用进而发生邻近组织浸润,转移至淋巴系统、血液循环和定植,形成转移病灶[12]。E-cadherin 和vimentin是EMT常用的两个生物标志物,前者属于黏附分子钙依赖性黏附素家族,其表达水平下调能够造成细胞形态改变、细胞间黏附减少,细胞活动能力增强,在癌症中表现为癌细胞迁移和浸润能力增强[13];vimentin是间质细胞中的中间丝蛋白,在细胞骨架维持中具有重要作用,上皮来源肿瘤细胞中vimentin 蛋白多呈阴性表达,间质来源肿瘤细胞则呈阳性表达,因此vimentin 蛋白在评估肿瘤EMT 化中具有重要的指示价值[14]。
本研究中,E-cadherin 和vimentin 蛋白在上皮性卵巢癌组织中的高表达率分别为53.66%和46.34%,有别于文献数据,可能是由于文中样本量过少,且所选的41例上皮性卵巢癌病例中,发生淋巴结转移的仅有9 例,占全部上皮性卵巢癌病例数的21.95%,有78.05%的病例并未发生淋巴结转移,因此E-cadherin蛋白显示出较高的表达率。
多项研究证实,FoxM1 与肿瘤侵袭、转移密切相关。有研究发现,FoxM1 过表达不仅会促进肝细胞癌的EMT及转移[15],还可通过靶向细胞代谢和Snial基因促进人胰腺癌细胞的EMT,从而促进人胰腺癌的转移和进展[16]。本研究中上皮性卵巢癌组织E-cadherin 蛋白阳性率和高表达率低于正常卵巢组织,vimentin 蛋白阳性率和高表达率高于正常卵巢组织,进一步研究则发现卵巢癌组织中E-cadherin 和vimentin 蛋白表达情况与患者临床分期、有无淋巴结转移、两级分级有关,临床分期III~IV 期、有淋巴结转移、HGSC 患者卵巢癌组织中E-cadherin 蛋白高表达率分别显著低于I~II 期、无淋巴结转移、LGSC 患者。vimentin 蛋白则表现相反情况,而FoxM1 与E-cadherin 蛋白表达水平存在显著负相关,与vimentin 蛋白表达水平之间均存在显著正相关性,说明分期较高、肿瘤细胞转移患者存在EMT,且FoxM1可能通过参与上皮性卵巢癌细胞的EMT,从而促进上皮性卵巢癌的侵袭转移。Balli等[17]研究发现,FoxM1 是肺纤维化EMT 所必需的。FoxM1 能够结合并增加Snail1基因的启动子活性,Snail1基因是EMT 的关键转录调节因子。结合本文结果,FoxM1 可能通过增强Snail1基因的启动子活性,从而促进肿瘤的EMT过程。此外,Kong等[18]通过多种体外实验表明,FoxM1 的过表达或敲低可通过激活或抑制AKT/p70S6K 信号传导途径,从而改变EMT。本文的实验结果及文献提示,FoxM1 蛋白的高表达,可通过激活一系列信号通路,促进EMT过程,进而促进肿瘤淋巴结转移及临床进展,其中具体的分子机制,仍需要进一步研究。
综上,FoxM1 蛋白在上皮性卵巢癌组织表达明显上调,与临床分期、淋巴结转移和两级分级相关,FoxM1 蛋白促进上皮性卵巢癌发生、进展和转移可能与其促进了EMT过程有关。

