枣ZjWRKY22 基因克隆、亚细胞定位及表达载体构建
张雪慧 ,张鹏飞 ,刘亚令 ,梁晋军 ,温鹏飞
(1.山西农业大学 园艺学院,山西 太谷 030801;2.山西石楼红枣科技小院,山西 石楼 032500;3.山西农业大学 生命科学学院,山西 太谷 030801)
壶瓶枣(Ziziphus jujuba‘Huping Zao’)为鼠李科枣属植物,具有皮薄肉厚、味甜汁多的优点,其果实中富含糖、脂肪酸、氨基酸、矿物质、维生素、多酚和其他抗氧化剂[1]。由于壶瓶枣的成熟期常处于雨季,裂果现象普遍存在[2],严重者可达90%以上[3],严重阻碍传统枣主产区的发展[4]。枣裂果属于生理性病害,是由于果实的内部生长与外界环境不协调而导致的果实表面开裂的一种现象[5],该病害不仅影响其外观品质,且开裂果实易发生不同程度的贮藏病害[6]。
WRKY 是在各种应激下可诱导表达的转录因子,广泛参与植物对各种生物(植物病原体和昆虫防御)[7]和非生物(盐、干旱、冷害和机械损伤)[8-9]胁迫的响应过程,其表达具有快速、即时和组织特异性[10]。WRKY 保守结构域包含60 个氨基酸,N 端含WRKYGQK 保守序列,与DNA 结合活性相关;C 端具有一个典型的锌指结构,一般由C2H2或C2HC 组成,参与蛋白质互作和辅助DNA 结合[11]。目前,该基因家族中ZmWRKY114[12]、MsWRKY42[13]、AtWRKY22[14-15]、GhWRKY22[16-17]等成员已被鉴定,其中过表达ZmWRKY114的转基因植株中,ZmWRKY114在ABA 介导参与盐胁迫反应途径中起负调控作用[12]。紫花苜蓿MsWRKY42对多种逆境胁迫均有响应,且基因诱导表达的丰度较高,表明该基因参与了多种非生物逆境胁迫调控[13]。拟南芥中异源过表达苜蓿MfWRKY22增强了拟南芥的非生物胁迫耐受性[14]。在拟南芥中,AtWRKY22参与暗诱导衰老信号转导通路[15]。过表达GhWRKY22的转基因拟南芥中JA 生物合成相关基因表达上调,JA 抑制基因JAZ1和JAZ8的表达下调[16-17]。
目前,枣WRKY基因研究主要集中在枣疯病以及果实发育[18-21],而当果实遭受非生物胁迫时WRKY 的分子调控机理研究相对较少。山西农业大学园艺学院枣课题组在前期利用RNA Seq 测序技术,检测分析壶瓶枣裂果与正常果基因表达的总体差异,采用生物信息学技术对测序结果进行分析[4],结果显示,ZjWRKY22基因在参与水分胁迫调控方面差异表达。因此,本试验以壶瓶枣为材料,对ZjWRKY22进行克隆,对序列进行系列生物信息学分析和亚细胞定位观察以及构建植物超表达载体,旨在为进一步明确基因功能、揭示枣裂果发生的分子机制奠定基础。
1 材料和方法
1.1 试验材料
本试验以壶瓶枣(Ziziphus jujuba‘Huping Zao’)为材料,种植于山西农业大学园艺站。于2021年6—9 月采集壶瓶枣枣吊、茎、叶、花及不同发育时期果实,迅速放入液氮中,-80 ℃冰箱保存备用。本氏烟草(Nicotiana benthamiana)种植于温度25 ℃、光照时数16 h/8 h、光照强度15 000 lx 的人工智能培养箱。
1.2 试验方法
1.2.1ZjWRKY22基因克隆利用FastPure®Universal Plant Total RNA Isolation Kit(RC411)试剂盒提取壶瓶枣果实总RNA,测定OD260/OD280值经琼脂糖凝胶电泳检测合格。采用PrimeScript™RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒去除基因组DNA,完成反转录,合成cDNA 第1 条链。根据转录组中ZjWRKY22核苷酸序列在NCBI 中进行Blast 查找CDS 序列进行克隆。采用Primer 5.0 设计试验所需引物(表1)。

表1 试验所用引物Tab.1 The primer sequence in this study
反应体系为1 μL cDNA,0.4 μL 引物,5 μL 2×pfu mix,ddH2O 补足至10 μL;反应程序为94 ℃预变性5 min;94 ℃变性30 s,59.8 ℃退火54 s,72 ℃延伸90 s,共34 个循环;72 ℃延伸5 min,4 ℃保存。经1.2%琼脂糖凝胶电泳检测后,采用琼脂糖凝胶回收试剂盒(天根)回收目的片段与PMD-19T 连接,热激法转化至大肠杆菌感受态Trans5α。挑选菌液PCR 检测阳性克隆,送至生工生物工程(上海)股份有限公司测序。采用质粒小提试剂盒(天根)提取测序验证构建正确的质粒pMD-ZjWRKY22,便于后续试验。
1.2.2 基因生物信息学分析 利用CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.Cgi)进行ZjWRKY22 蛋白保守结构预测;利用ExPASy(https://web.expasy.org/protparam/)进行蛋白基本理化特性分析;利用SPOMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和 SWISS-MODEL(https://swiss-model.expasy.org/interactive)对其编码氨基酸序列进行二级结构和三级结构预测;利用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行信号肽和跨膜结构域预测;通过NCBI 官网进行Blastp 比对,下载高相似度的序列并结合MEGA 7.0 软件构建系统进化树;利用DNAMAN 软件进行同源比对。
1.2.3ZjWRKY22表达情况分析 提取壶瓶枣枣吊、茎、叶、花及果实总RNA,经反转录合成cDNA,参照2×M5 HiPer Realtime PCR Super mix(SYB⁃Rgreen,with anti-Taq)试剂盒进行实时荧光定量PCR(qRT-PCR)。每个样本设置3 个生物学重复。利用2-ΔΔCt[19]计算ZjWRKY22在壶瓶枣不同组织部位及不同发育时期果实的相对表达量。
1.2.4 ZjWRKY22 蛋白亚细胞定位分析 提取构建成功的pMD-ZjWRKY22质粒,将pMDZjWRKY22和 pCAMBIA1300-35S-GFP 使用KpnI 和XbaI 同时进行双酶切,基因片段与载体片段摩尔比为3∶1 进行16 ℃过夜连接,转化至Trans5α。利用Kana 筛选阳性克隆pCAM⁃BIA1300-GFP-ZjWRKY22载体,参照说明书,采用冻融法将pCAMBIA1300-GFP-ZjWRKY22转化至农杆菌GV3101 中,同时以pCAMBIA1300-35S-GFP 为对照。涂布于LB(含50 ng/mL Kan+25 ng/mL Rif)平板上,倒置于28 ℃培养箱培养2 d;挑取阳性单克隆至1.5 mL 液体LB 中,28 ℃、200 r/min 过夜培养,转移至20 mL 液体LB 培养基扩大培养至OD600为0.5~0.6;5 000 r/min 8 min,室温收集菌体;使用MES 重悬至OD600=1.0,室温黑暗静置2~3 h;注射4 周龄烟草叶片背部,25 ℃,黑暗12 h 后正常培养2 d。采用打孔器在侵染叶片上选取4~6 个叶圆片进行制片;随后在激光共聚焦显微镜下检察绿色荧光信号。
1.2.5ZjWRKY22超表达载体构建 根据pCAMBIA-35S-1300 载体信息以及ZjWRKY22基因序列设计外挂酶切位点引物对1300-F-XbaI和1300-R-KpnI,以pMD-ZjWRKY22 质粒为模板进行PCR 扩增。PCR 产物连接pMD-19T 克隆载体并转化大肠杆菌感受态细胞Trans5α测序。提取验证正确的克隆载体pMD-1300-ZjWRKY22质粒DNA。经KpnI 和XbaI 对pMD19T-ZjWRKY22和pCAMBIA-35S-1300 进行双酶切,ZjWRKY22基因片段插至pCAMBIA-35S-1300 中,过夜连接获得重组pCAMBIA-1300-ZjWRKY22质粒并转入大肠杆菌Trans5α感受态细胞中。
2 结果与分析
2.1 ZjWRKY22 基因克隆
以壶瓶枣果实cDNA 为模板,经PCR 扩增后,扩增产物用1.2% 琼脂糖凝胶电泳进行检测,克隆载体测序结果表明(图1),该序列长度与NCBI公布的序列(MG493485.1)相符,其片段大小为1 068 bp。

图1 ZjWRKY22 基因克隆Fig.1 ZjWRKY22 gene cloning
2.2 基因序列生物信息学分析
根据转录组基因序列信息,使用NCBI 在线Blast 工具,基因登录号LOC107431286,该基因CDS 序列长1 068 bp,编码355 个氨基酸。NCBI 上CDD 预测结果表明,该基因含有典型的WRKY 结构域,证明属于WRKY 家族。利用ExPASy 网站在线工具对ZjWRKY22编码蛋白的基本理化特性进行分析,结果表明,该蛋白分子质量约为38.9 ku,等电点为5.92,分子式为C1682H2582N472O568S13,脂肪指数为44.82,不稳定系数为66.41,表明该蛋白为不稳定蛋白质。该蛋白中丝氨酸最多,占18%,其次苏氨酸、脯氨酸占8.5%,最少的是色氨酸,占1.1%。通过SPOMA 网站对ZjWRKY22编码氨基酸序列进行二级结构预测,结果显示,结构类型占比为无规则卷曲66.20%,α-螺旋18.87%,β-折叠10.99%,β-转角3.94%。为了进一步研究蛋白空间结构,使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)对三级结构进行同源建模,预测该蛋白的结构域主要由4 个β-折叠组成,分别为WRKYGQK、RGYYR、RKQVER、FIVTYT(图2)。利用在线软件SignalP-5.0 进行信号肽预测,显示该蛋白无信号肽。TMHMM 进行跨膜结构域预测,结果表明,该蛋白不具有跨膜结构域。NetPhos 3.1 服务器使用预测真核蛋白中的丝氨酸、苏氨酸或酪氨酸磷酸化位点,预测该蛋白含有76 个磷酸化位点。

图2 ZjWRKY22 一级(A)、二级(B)和三级(C)结构Fig.2 The first structure(A),the second structure(B)and the tertiary structure(C)of ZjWRKY22
为了解ZjWRKY22大致的进化关系,从NCBI数据库中筛选出与ZjWRKY22基因编码蛋白同源性较高的12 种植物的WRKY 蛋白序列,包括杨梅(Morella rubra)、美国山核桃(Carya illinoinensis)、甜樱桃(Prunus avium)、桃(Prunus persica)、扁桃(Prunus dulcis)、苹果(Malus domestica)、酸枣(Ziziphus jujubeMill.var.spinosa)、胡杨(Populuseuphratica)、毛果杨(Populus trichocarpa)、拟南芥(Arabidopsis thaliana)、梅(Prunus mume)和可可(Theobroma cacao),同时利用MEGA 7.0 软件构建与枣同源度较高的物种间的系统进化树(图3),发现枣ZjWRKY22与酸枣聚为一小分支,表现为亲缘关系越近同源性越高。

图3 同源序列比对(左)与系统进化分析(右)Fig.3 Homologous sequence alignment(left)and phylogenetic analysis(right)
2.3 ZjWRKY22 基因不同组织及果实发育时期表达特性
基于实时荧光定量PCR,分析ZjWRKY22在壶瓶枣不同组织部位及果实发育时期的相对表达情况,该基因在壶瓶枣各组织部位均有表达,但表达量存在差异,果实中的表达量显著高于其他组织,在全红期果实中的表达量最高(图4)。

图4 不同组织部位及果实发育时期特异性表达分析Fig.4 Specific expression analysis of different tissues and fruit development periods
2.4 亚细胞定位
利用Predict Protein 在线分析预测ZjWRKY22蛋白可能定位于细胞核内。为验证其结果,使用含绿色荧光蛋白(GFP)的植物表达载体pCAMBIA1300-GFP-ZjWRKY22(图5),注射本氏烟草。结果显示,在瞬时表达pCAMBIA1300-GFP-ZjWRKY22融合蛋白的烟草叶片细胞中,仅在细胞核检测到荧光信号;而单独表达pCAMBIA1300-35S-GFP 的对照细胞,荧光信号在整个细胞分布(图6)。可见,ZjWRKY22 蛋白属于核定位蛋白,这与其作为转录因子发挥功能相吻合。

图5 pCAMBIA1300-35S-ZjWRKY22 载体构建Fig.5 pCAMBIA1300-35S-ZjWRKY22 vector construction
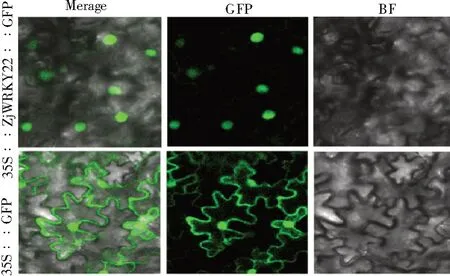
图6 ZjWRKY22 亚细胞定位Fig.6 Subcellular localization of ZjWRKY22
2.5 ZjWRKY22 超表达载体构建
重组质粒pCAMBIA-1300-ZjWRKY22连接转化后在Kana 抗性培养基上筛选培养,使用引物1300-F-XbaI 和1300-R-KpnI 对阳性单菌落进行特异性扩增,将获得目的条带的阳性菌液(图7)送至上海生工测序,并保存用于后续将载体转化至农杆菌中进行植株侵染。

图7 pCAMBIA-1300-ZjWRKY22 阳性克隆鉴定Fig.7 pCAMBIA-1300-ZjWRKY22 positive cloning identification
3 结论与讨论
在秋季多雨的年份,许多枣主产区的品种,因降雨使得水分进入果实,导致枣裂果现象普遍发生[21]。植物遭受水分胁迫逆境,其体内会发生一系列变化以适应逆境,一些相关抗逆基因也会大量表达,来感应并传导逆境胁迫信号[22]。其中,WRKY基因家族在植物响应生物和非生物胁迫的过程中发挥关键作用,它作为高等植物中最大的转录因子(TFs)家族之一,通过调控植物激素信号转导途径响应逆境[23]。WRKY基因参与植物的生长发育和对外界环境的抗性[24],然而目前针对枣WRKY基因在细胞中作用及其功能研究鲜有报道。薛宝平等[25]对枣的92 个WRKY 家族基因进行了系统鉴定分析。前期课题组研究发现,ZjWRKY22转录因子在水分胁迫逆境中出现高丰度差异表达,说明该基因可能在调控胁迫响应中发挥关键作用,但其作用机制目前尚不清楚。
本研究成功克隆了壶瓶枣ZjWRKY22基因,该基因CDS 序列长1 068 bp,共编码355 个氨基酸,属于WRKY GroupⅡe 组,这与之前的报道相符[25]。因此,为了进一步研究其功能,本研究采用荧光定量PCR 分析了ZjWRKY22基因的组织表达特性,结果表明,该基因在果实中相对表达量较高,推测其在果实生长发育中发挥着重要的作用,这与枇杷中的同源WRKY 的研究结果相一致[26]。蛋白质在细胞中的定位决定了其行使功能的部位,生物信息学预测ZjWRKY22 定位在细胞核中,本试验构建亚细胞定位载体pCAMBIA1300-GFP-ZjWRKY22并瞬时转化烟草叶片,经共聚焦显微镜观察并确定了ZjWRKY22 蛋白定位于细胞核上。该结果与已报道的WRKY 转录因子的亚细胞定位结果一致[27-29]。前人研究表明,WRKY 广泛参与植物对逆境的抗性反应[30],而且WRKY 家族中每个基因的功能各异。近年来,利用转基因技术解析WRKY基因调控植物非生物胁迫下生物学功能的研究已有较多报道[31-32]。本研究构建了植物超表达载体pCAMBIA-1300-ZjWRKY22,为进一步探究在胁迫下ZjWRKY22提高植物代谢增强抗性的作用提供重要的理论依据,也为探索ZjWRKY22的生物学功能打下了坚实的基础。

