绿木霉T5 挥发性有机物对8 种作物种子和幼苗生长的影响
黄 竹,姚艳平
(山西农业大学 植物保护学院,山西 太谷 030801)
木霉属真菌(Trichodermaspp.)分布广泛,生长快速,环境适应能力强[1]。在植物—微生物—土壤的生物环境中,木霉具有多面的联合作用效应,不仅具有防治多种植物病害的能力,还可促进植物生长,延缓土壤肥力下降和病原菌抗药性的产生[2]。木霉属真菌能够促进种子萌发、增加植株高度、减少倒伏、增大叶片面积、促进提前开花[3-4],与植物根系互作能够降低植物地上、地下部分感病的概率,与根际微生物互作会影响植株的次生产物代谢[4]。以木霉菌为主要成分的多种生物肥料和生防制剂已在农业生产中被广泛应用[5]。
木霉菌的促生作用由多种因素介导,尤其是木霉菌产生的挥发性有机化合物(VOCs)能够促进多种植物生长并赋予植株一定的抗逆性即诱导系统抗性。大量研究已证实了木霉菌对禾谷类作物如小麦[6]、水稻[7],蔬菜类作物如黄瓜[8]、番茄[9],经济类作物如烟草[10]、花生[11]的促生活性。如木霉VOCs可激活拟南芥的抗逆性并使植株增加鲜质量、根长和叶绿素含量[12]。木霉菌的VOCs 可促进禾本科作物小麦的幼苗生长[13];使番茄植株更高更大,侧根更多,增加总生物量和叶绿素含量[14];还促进莴苣的生长并增加其叶绿素和类胡萝卜素含量[15];此外,还能够增加橄榄树中芳香挥发性有机化合物的产生[16];提高葡萄树愈伤组织的积累,并增强葡萄霜霉病菌接种后防御相关基因的调节[17]。
不同种类木霉菌或同种木霉菌不同菌株产生的次生VOCs 种类繁多且彼此间差异较大,包括烃、醇、内酯、呋喃、酮、醛、烷烃、烯烃、酯、芳香化合物、杂环化合物和各种萜烯[18-19]等。如在木霉—植物互作中起着关键作用的6-戊基-2H-吡喃-2-酮(6PP),具有抑制植物病原真菌生长、促进植物生长、并诱导侧根发育和改变根系结构的功能,可通过激活拟南芥对灰葡萄孢和链格孢的防御反应来增强植株抗性[20]。木霉菌产生的1-辛烯-3-醇可激活JA/ET 介导的激素信号转导途径并增强植物对病原体的抗性[21]。trichodiene 则能够上调植株中抗性基因的表达如水杨酸通路相关基因来诱导植株获得抗性[22]。
前期试验表明,绿木霉T5 对玉米种子及幼苗的生长具有促进作用[23],为了明确绿木霉T5 菌株的促生效果,探究其促生作用的广谱性和稳定性,本研究选取谷子、藜麦、小麦等3 种农作物和白菜、番茄、辣椒、西葫芦、南瓜等5 种蔬菜作物的种子和幼苗作为试验材料,探索绿木霉T5 菌株产生的VOCs 对上述种子发芽和幼苗生长的影响,旨在为绿木霉T5 菌株的促生机制和活性代谢产物研究奠定基础,为木霉菌复合种衣剂的研制与开发提供一定的理论依据。
1 材料和方法
1.1 试验材料
供试种子:谷子(Setaria italica)(晋谷21)购自山西太谷县艺农种子有限公司;小麦(Triticum aestivumL.)(济麦22)购自山东鲁研农业良种有限公司;藜麦(Chenopodium quinoaWilld.)(绿宝藜麦)购自山东丰沛农业;辣椒(Capsicum annuum)(新一代毛粉802)购自大田种业公司;番茄(Solanum lycopersicumL.)(中研998)购自北京中研益农种苗公司;西葫芦(Cucurbita pepoL.)(新丰抗70)购自山西王牌新特种苗有限公司;南瓜(Cucurbita moschata)(日本南瓜)购自山西太谷县中裕种业;白菜(Brassica campestris)(夏优1 号)购自济南时珍种业有限公司。
供试木霉菌株:绿木霉T5(Trichoderma viride)由山西农业大学植物病理实验室提供并保存。
1.2 试验方法
1.2.1 培养基的配制 基础PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1 L。121 ℃高压灭菌20 min 后倒平板。
1.2.2 种子的预处理 南瓜、西葫芦种子采用25 ℃恒温水浴6 h,后用70%乙醇消毒30 s,无菌水冲洗[24]。白菜种子采用1%次氯酸钠消毒8 min,无菌水冲洗后浸泡30 min,28 ℃水浴锅10 min[25]。辣椒种子采用CuSO4溶液消毒60 min,无菌水冲洗[26]。番茄种子采用70%乙醇清洗1 min,20%次氯酸钠润洗10 min,无菌水冲洗[27]。小麦种子采用10% 的次氯酸钠溶液消毒15 min,用无菌水冲洗[28]。谷子、藜麦种子采用5%次氯酸钠消毒30 min,用无菌水冲洗[29-30]。
1.2.3 绿木霉菌的培养 将绿木霉T5 接种在PDA 平板上,黑暗条件下25 ℃恒温培养5 d。
1.2.4 绿木霉T5 挥发性有机化合物对作物的促生活性 采用改良的“皿中皿”方法[9],将铺滤纸的无菌培养皿浸湿,上置预处理后的种子,摊开铺匀。每个密封大烧杯依次放入上覆微孔滤纸且长满全皿的绿木霉平板3 皿、各放置20 粒预处理种子的平板3 皿。以放入3 皿PDA 平板及各放置20 粒预处理种子的平板3 皿为对照,每个处理重复3 次。使用封口膜覆盖并密封烧杯杯口,记录日期,25 ℃恒温培养。于处理后第2 天记录种子发芽情况,分别于第2、3、4 天测定并记录种子萌发的根长与芽长。第4 天测定完毕后,选取10 粒萌发4 d 的幼苗放在铺有湿润滤纸的透气有孔杯中,采用上下层的小型温室方法,将绿木霉平板置于干燥器底部,其上层放置已装有幼苗的培养杯,干燥器内用湿润棉花保湿,干燥器盖子涂抹凡士林密封,以放置PDA 平板和4 d 对照组幼苗的干燥器为对照,培养7 d 后统计幼苗的地上部和地下部长度、鲜质量、干质量(80 ℃烘干至恒质量)。
1.3 数据分析
采用SPSS 25.0 进行数据差异显著性统计分析。根长、地上部和地下部长度、干鲜质量的促生率计算均参照式(1)进行。
2 结果与分析
2.1 绿木霉T5 产生的VOCs 对作物种子萌发与幼苗生长的影响
由图1 可知,在植物—微生物挥发物共培养装置中生长2 d 后,除白菜种子外,7 种作物种子均发芽,白菜种子在3 d 后发芽。经绿木霉T5 的VOCs处理后,除小麦、南瓜外,谷子、藜麦、白菜、番茄、辣椒、西葫芦等作物的种子发芽率均明显提高,与对照组发芽率差异显著(P<0.05)。谷子种子的发芽率最高,达到96.7%,发芽促生率为13.3%,西葫芦种子发芽率促生效果最明显,处理后的西葫芦种子发芽促生率达17.9%。

图1 绿木霉T5 产生的VOCs 对8 种作物种子萌发的影响Fig.1 Effects of VOCs from T. viride T5 on seed germination of 8 crops
由图2、3 可知,绿木霉T5 产生的VOCs 对8 种作物幼苗的根生长均具有促生活性,幼苗根长与对照组具有显著差异(P<0.05)。绿木霉T5 的VOCs 处理2 d 后,番茄幼苗根长促生率达65.8%,显著高于其他作物幼苗根长促生率(P<0.05);VOCs 处理3、4 d 后,白菜幼苗根长促生率分别为56.9%、71.6%,均显著高于其他作物幼苗根长促生率(P<0.05)。南瓜和辣椒幼苗VOCs 处理4 d 后的根长促生率也较高,分别为61.2%、60.1%。总体来说,绿木霉T5 的VOCs 对白菜幼苗根长的促生效果最好,对小麦幼苗根长的促生效果较差,对蔬菜类作物幼苗根生长的促生效果优于禾谷类幼苗;VOCs 处理3 d 后禾谷类作物幼苗根长促生率普遍下降,处理4 d 后回升,对蔬菜类作物根生长的促生作用没有明显的规律性。

图2 绿木霉T5 产生的VOCs 对8 种作物幼苗根生长的影响Fig.2 Effects of VOCs from T. viride T5 on seedling root growth of 8 crops
由图3、4 可知,绿木霉T5 的VOCs 处理3 d 后,谷子、小麦的芽开始生长;处理4 d 后番茄、辣椒的芽开始生长,其余种子在4 d 内芽均未生长。绿木霉T5 的VOCs 处理后,4 种作物的芽长均显著高于对照组(P<0.05),其中辣椒幼苗的芽长促生率最高,为53.7%,小麦幼苗的芽长促生率为45.0%。

图3 绿木霉T5 产生的VOCs 对8 种作物种子萌发和生长的影响(4 d)Fig.3 Effects of VOCs from T. viride T5 on seed germination and growth of 8 crops(4 d)
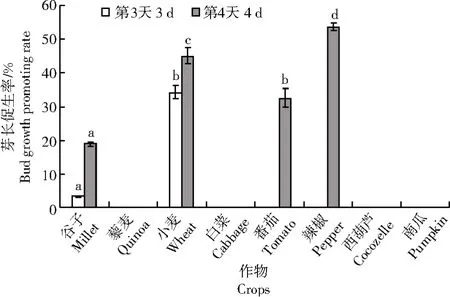
图4 绿木霉T5 产生的VOCs 对8 种作物幼苗芽生长的影响Fig.4 Effects of VOCs from T.viride T5 on seedling bud growth of 8 crops
2.2 绿木霉T5 产生的VOCs 对幼苗生长的影响
从图5 可以看出,绿木霉T5 产生的VOCs 处理12 d 后,作物地上部、地下部的生长与对照组相比均有显著差异(P<0.05)。VOCs 对藜麦和白菜幼苗地上部的促生效果优于地下部分,藜麦幼苗地上部的促生率达54.3%,与其他作物的促生率差异显著(P<0.05);白菜幼苗地上部的促生率为45.7%。VOCs 对谷子、小麦、辣椒、南瓜幼苗地下部的促生效果优于地上部,其中,南瓜幼苗根长为120.2 mm,促生率达到69.4%,与其他作物的差异显著(P<0.05);VOCs 对西葫芦幼苗地上部、地下部生长的促生效果最差,促生率分别仅为17.9%、17.5%。总体来说,绿木霉T5 的VOCs 对藜麦幼苗地上部的促生率较高,为54.3%;对南瓜幼苗地下部的促生效果最好,促生率达69.4%。

图5 绿木霉T5 的VOCs 对8 种作物幼苗生长的影响Fig.5 Effects of VOCs from T. viride T5 on seedlings growth of 8 crops
2.3 绿木霉T5 产生的VOCs 对幼苗干、鲜质量的影响
由图6 可知,绿木霉T5 产生的VOCs 处理12 d后,作物幼苗干、鲜质量均显著高于对照组(P<0.05)。VOCs 对白菜、谷子幼苗鲜质量的促生效果较好,其中白菜幼苗鲜质量的促生率最高,为42.2%,显著高于其他作物幼苗(P<0.05);南瓜幼苗鲜质量的促生率较低,仅为18.8%。VOCs 对藜麦、小麦、番茄、西葫芦、南瓜幼苗干质量的促生效果较好,其中,西葫芦幼苗干质量的促生率最高,达81.8%,南瓜次之,促生率为75.2%,显著高于其他作物幼苗(P<0.05)。总体来说,绿木霉T5 的VOCs 对8 种作物幼苗干质量的促生效果优于鲜质量的促生效果,其中,西葫芦幼苗的干质量促生效果最好。

图6 绿木霉T5 的VOCs 对8 种作物幼苗干质量、鲜质量的影响Fig.6 Effects of VOCs from T.viride T5 on dry weight and fresh weight of 8 crop seedlings
3 结论与讨论
本研究表明,绿木霉T5 产生的VOCs 对谷子、藜麦、小麦、白菜、番茄、辣椒、西葫芦、南瓜8 种作物种子的发芽率、芽长、根长、幼苗生长和干质量、鲜质量均有一定的促生作用。VOCs 处理后,谷子、藜麦、白菜、番茄、辣椒、西葫芦种子发芽率均显著提高。VOCs 对白菜的根长促生效果最好,促生率达71.6%,对辣椒种子芽长促生率达53.7%,对藜麦幼苗地上部促生率达54.2%,对南瓜幼苗地下部促生率达69.4%,白菜幼苗鲜质量增长42.2%,西葫芦幼苗干质量增长81.8%。因此,绿木霉T5是具有较强广谱促生效果的潜在生防木霉菌株。
从木霉菌中检测、鉴定出的挥发性有机化合物有480 余种,如3-羟基-2-丁酮、2,3-丁二醇、2-戊基呋喃等已发现在根或叶上具有促生能力[19]。6PP能够促进植株生长和诱导侧根发育[14]。FINCHEIRA等[31]从26 种木霉产生的挥发性化合物中发现,1-癸烯能够增加拟南芥新梢的质量(38.9%)和叶绿素含量(67.8%)。绿木霉T5 产生的VOCs 中可能包含多种具有促生活性的有机化合物,多种化合物与植株间通过相互协调作用从而促进多种作物植株的生长。
绿木霉T5 的VOCs 分别处理8 种作物种子后,在不同处理时间2、3、4、12 d(出芽期和幼苗期)处理后促生效果不稳定。一方面可能是由于在植株种子萌发初期生长变化快,不同的生长阶段(芽生长和根生长)起促生作用的VOCs 种类不同,因此,促生效果表现不一;另一方面可能是由于绿木霉T5 产生VOCs 的次生代谢调节是严密且精细的过程,不同处理时间绿木霉T5 所处的代谢调节阶段不同,其产生的VOCs 的种类与数量不同,VOCs 之间、VOCs 与作物植株间的互作也会影响促生效果的体现。如LEE 等[32]研究发现,木霉菌(T.atroviride)对拟南芥5、14 d 的促生效果不同,通过GC-MS 分析发现,其VOCs 种类、数量、含量均不完全相同。有些木霉菌株能够产生6PP,但菌株却没有促生能力,6PP 仅以特定剂量促进植物生长和调节根结构,并削弱病害症状[17];低浓度的1-己醇可促进拟南芥生长,高浓度时抑制生长[33]。这些相关研究均表明了木霉菌促生机制的复杂性。
本试验仅对绿木霉T5 实验室条件下的促生活性的广谱性和稳定性进行研究,为了使其VOCs 的促生效果达到最佳,还需开展绿木霉T5 促生活性培养条件的优化研究;同时进一步分析绿木霉T5产生的VOCs 中的促生活性成分,寻找高效促生化合物,旨在为绿木霉T5 促生机制的研究提供理论依据。

