六溴环十二烷(HBCD)和Cu2+单独与联合暴露对海水小球藻的毒性作用
赖丽华,田斐,熊倩,王学锋,叶国玲,陈海刚*
(1.中国水产科学研究院南海水产研究所,广东省渔业生态环境重点实验室,农业农村部南海渔业资源环境科学观测实验站,广东珠江口生态系统野外科学观测研究站,广州 510300;2.广东海洋大学水产学院,广东 湛江 524088)
阻燃剂是水环境中的一类新兴污染物,其中六溴环十二烷(hexabromocyclododecane,HBCD)是一种常用的溴化阻燃剂,因其成本低、阻燃效果好等优点,广泛应用于塑料聚合物、电子产品和建筑材料的生产中[1]。研究表明HBCD 具有持久性、生物积蓄性、远距离迁移性等,可引起内分泌干扰作用、神经毒性和生殖发育毒性等[2–5]。由于没有性能好且足够安全的替代品,HBCD 在我国还需延用至2024 年,因此,了解HBCD 在环境中的生态风险至关重要[6]。此外,重金属也是水环境中广泛关注的一类污染物,其中铜被认为是毒性最强的金属之一[7]。高浓度Cu2+会干扰藻类的生长和光合作用,并在食物链和食物网中传递,威胁生物体和人类的健康[8]。通常Cu2+在海水中的浓度为0.03~0.60 μg·L-1,但在受工业活动、生活污水和电子垃圾等污染的沿海水域,其浓度可能会增加数倍[9-10]。研究发现,在电子废弃物处理区周围的海水环境中,高浓度的溴化阻燃剂和重金属共存现象非常普遍。例如,在渤海海岸水体中,发现HBCD 浓度高达5 080 ng·L-1,Cu2+浓度最高可达39.99 μg·L-1,这也是目前为止在水体中可检测到的HBCD 和Cu2+的最高浓度[11-12]。
溴化阻燃剂和重金属混合暴露对生物体的毒性常表现为比单独暴露更高,如:Chen等[13]研究发现,与仅暴露于镉处理的小鼠相比,同时暴露于四溴双酚A和镉的小鼠体质量和肝脏质量明显增加;十溴联苯醚的添加不仅增强了铅对赤子爱胜蚓的毒性[14],还会加剧镉对人体肝细胞的损伤[15]。溴化阻燃剂和重金属的持续释放可能会对水生系统造成多重压力,已证实单一污染物具有一定的毒性效应,但针对它们的联合毒性效应研究仍十分匮乏,因此有必要深入探究污染物联合暴露对水生生物的影响。
海岸带独特的地理位置和频繁的人类活动使其成为污染物的最大的汇,因此研究沿海水域中污染物对水生生物的毒性效应迫在眉睫。目前针对溴化阻燃剂和重金属的生物毒性研究普遍以动物作为生物受试体,缺乏溴化阻燃剂和重金属对微藻的毒性研究。藻类作为海洋生态系统中的重要初级生产者之一,其分布广泛、适应能力强、易获得、繁殖快且对污染物敏感性高,故常被选作污染物毒性评估和水质安全评价的模式生物[16]。本研究以普通海水小球藻(Chlorella salina)作为生物受试体,探究HBCD 和Cu2+单独和联合暴露对海水小球藻毒性作用,以期为HBCD、Cu2+及其混合物的生态风险评估和污染防控提供理论依据。
1 材料与方法
1.1 实验材料
HBCD(纯度:99%)和CuSO4·5H2O(纯度:99%)购自上海麦克林科技有限公司。丙酮作为溶剂用于制备HBCD 储备液(1 g·L-1),实验中控制其添加比例为0.05%(V/V)。本实验所用海水采集于中国水产科学研究院南海水产研究所深圳试验基地,温度为29~32 ℃,盐度为28~32,为保证每次实验培养条件一致,根据该藻种培养条件预实验结果调整盐度为30、pH为8,采用0.45 μm 醋酸纤维滤膜将其过滤,高温高压灭菌后用于实验。海水小球藻种和F/2 培养基购自上海光语科技有限公司。
1.2 藻种及其培养
将海水小球藻接种到无菌的F/2 培养基中,于培养箱内静置培养,培养条件为:温度(25±1)℃,光照强度54~74 μmol·m-2·s-1,光暗比为14 h∶10 h。每日定时手动摇匀藻液3 次,以防止藻细胞沉降,同时更换位置以保证样品受光均匀。收集培养至对数生长期的藻细胞,将其用作毒性实验的接种物。所有实验均在无菌条件下进行,以避免细菌或其他藻类的污染。
1.3 急性毒性实验步骤
HBCD、Cu2+及其混合物对海水小球藻的毒性测试实验方案参考文献[17],设置藻种初始浓度(以cell计)为5×104个·L-1。预实验结果发现,HBCD 浓度在3 500 μg·L-1以上处理组间的结果没有显著差异,Cu2+浓度达到2 000 μg·L-1海水小球藻几乎被完全抑制,而HBCD 浓度在50 μg·L-1以下和Cu2+浓度在200 μg·L-1以下处理组的结果表现为微弱的促进作用,因此,浓度设置按照等对数间距法将HBCD 暴露浓度设置为0、50、160、500、955、1 830 μg·L-1和3 500 μg·L-1,Cu2+的暴露浓度设置为0、200、315、500、795、1 260 μg·L-1和2 000 μg·L-1。为了深入研究添加HBCD 是否会影响Cu2+对海水小球藻的毒性,选择目前调查的最高环境浓度5 μg·L-1和前面单独暴露对海水小球藻毒性最大的500 μg·L-1两个HBCD 浓度与7 组不同浓度的Cu2+(0、200、315、500、795、1 260 μg·L-1和2 000 μg·L-1)进行联合毒性实验。各处理组设置3个平行,培养条件同1.2,培养96 h后取样测定藻细胞密度、Chl a 含量,并利用FluorPen 手持式叶绿素荧光仪测定叶绿素荧光参数。
1.4 数据处理
采用SPSS 25 对实验数据进行统计分析,不同浓度处理间对海水小球藻细胞密度、Chl a 含量和叶绿素荧光参数的影响采用单因素方差分析,显著性差异采用LSD 法进行多重比较,Probit 程序计算半数效应浓度(EC50)值。细胞密度抑制率计算公式如下:
细胞密度抑制率(%)=[(对照组细胞密度-处理组细胞密度)/对照组细胞密度]×100%
2 结果与分析
2.1 HBCD单独暴露对海水小球藻的影响
不同浓度HBCD 胁迫下,海水小球藻的细胞密度呈现不同程度的抑制效应,而Chl a 和PSⅡ最大光化学量子产量Fv/Fm无显著变化。如图1所示,500 μg·L-1HBCD 处理组对藻细胞密度的抑制效应最强(32.99%),其次依次为50(24.76%)、1 830 μg·L-1(21.04%)和3 500 μg·L-1(19.95%)处理组。Chl a 含量的变化趋势与细胞密度不同,500 μg·L-1HBCD 处理组,Chl a 含量比对照组仅降低了13.42%,而1 830 μg·L-1处理组中Chl a含量的抑制率最高(36.45%)。
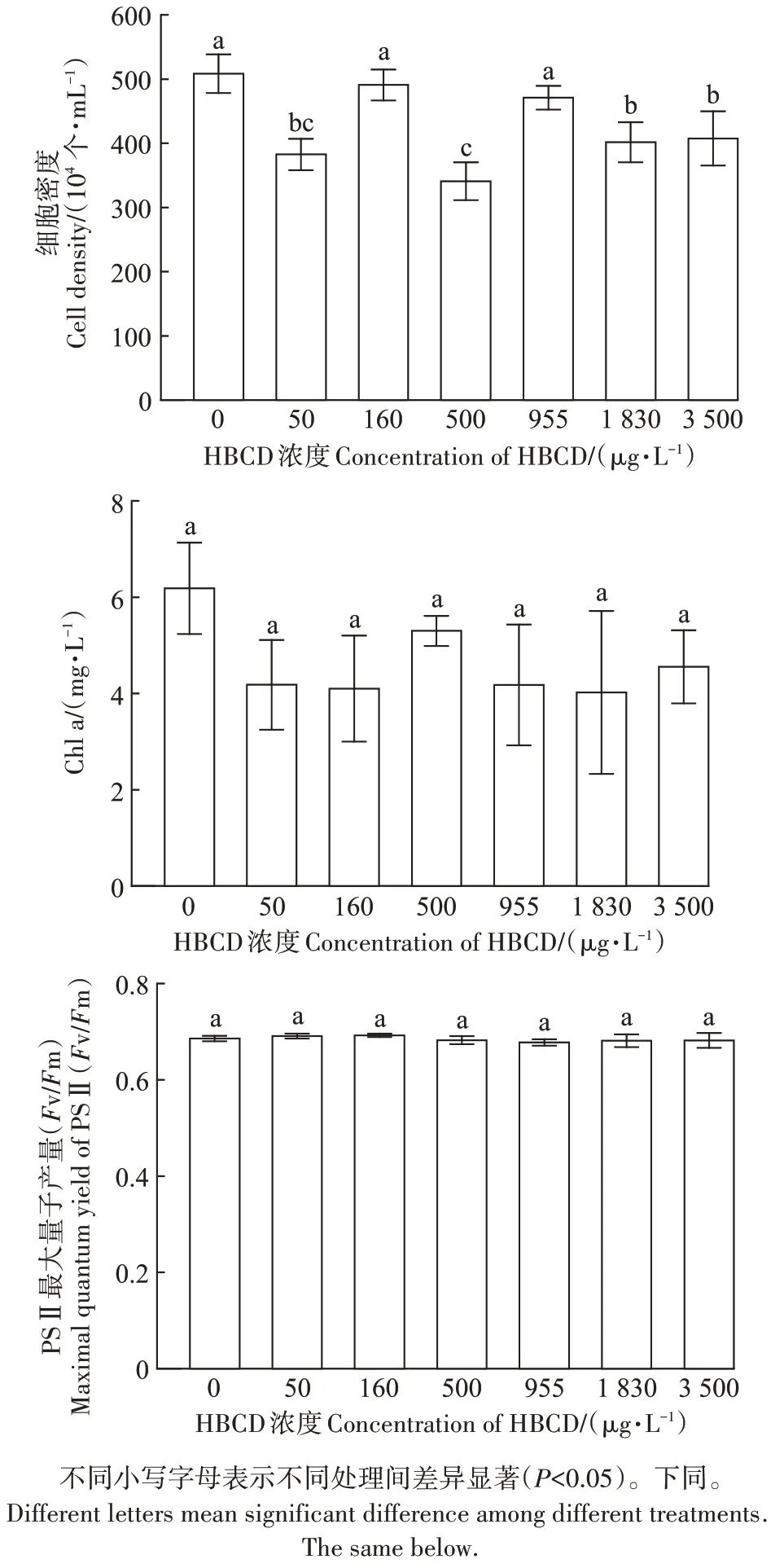
图1 HBCD胁迫对海水小球藻的影响Figure 1 Effects of HBCD stress on C.salina
2.2 Cu2+单独暴露对海水小球藻的影响
如图2 所示,不同浓度Cu2+胁迫下,海水小球藻的细胞密度、Chl a 含量和Fv/Fm 发生明显变化。当Cu2+浓度≤500 μg·L-1时,藻细胞密度受到轻微抑制,而当其浓度为795、1 260 μg·L-1和2 000 μg·L-1时,藻细胞密度显著下降,较对照组分别降低了75.71%、92.88%和96.80%,且在培养24 h 后出现明显的絮凝沉淀,Chl a 含量也较对照组分别降低了72.83%、87.53%和96.77%。此外,低浓度Cu2+处理组对Chl a含量的影响大于其对藻细胞密度的影响。Cu2+浓度≤795 μg·L-1处理组,Fv/Fm无明显变化,而Cu2+浓度为1 260 μg·L-1和2 000 μg·L-1时,Fv/Fm 与对照组相比显著降低,分别下降了24.24%和32.32%。Cu2+单独暴露时,基于细胞密度和Chl a 计算的96 h-EC50分别为637 μg·L-1和541 μg·L-1(表1)。

图2 Cu2+胁迫对海水小球藻的影响Figure 2 Effects of HBCD and Cu2+stress on C.salina
2.3 HBCD和Cu2+联合暴露对海水小球藻的影响
HBCD和Cu2+联合暴露对海水小球藻细胞密度和Chl a含量的影响如图3所示。HBCD和Cu2+联合暴露对海水小球藻的抑制率高于Cu2+单独暴露,其抑制率随HBCD 浓度增加而显著增高。当Cu2+浓度为500 μg·L-1时,5 μg·L-1和500 μg·L-1HBCD 联合处理组中细胞密度抑制率均显著高于Cu2+单独暴露,分别为Cu2+单独暴露的2.5 倍和5.4 倍(图3A)。在Cu2+浓度为315 μg·L-1处理组中,5 μg·L-1HBCD 联合胁迫下Chl a 含量抑制率低于Cu2+单独暴露处理组,而在500 μg·L-1HBCD 联合胁迫下Chl a 含量抑制率则显著升高,其抑制率是Cu2+单独暴露的2.3 倍(图3B)。当Cu2+和HBCD 浓度均为500 μg·L-1时,Chl a 含量抑制率是Cu2+单独暴露处理组的2倍(图3B)。

图3 HBCD和Cu2+联合暴露对海水小球藻的影响Figure 3 Effects of HBCD and Cu2+mixed exposure on C.salina
与Cu2+单独暴露处理组相比,HBCD 和Cu2+联合暴露处理组中PSⅡ最大光化学量子产量(Fv/Fm)和PSⅡ实际光化学量子产量(ΦPSⅡ)值均降低(图4)。当Cu2+浓度为795 μg·L-1时,500 μg·L-1HBCD 处理组中Fv/Fm值显著低于Cu2+单独暴露,下降了29.2%,仅为0.44(图4A)。在Cu2+单独暴露处理组中,ΦPSⅡ和Fv/Fm 变化趋势相同;当额外添加5 μg·L-1HBCD 时,ΦPSⅡ随Cu2+浓度增加先缓慢升高后迅速降低;当添加500 μg·L-1HBCD 时,ΦPSⅡ则随Cu2+浓度增加逐渐下降(图4B)。

图4 HBCD和Cu2+联合暴露对海水小球藻叶绿素荧光参数的影响Figure 4 Effects of HBCD and Cu2+co-exposure on chlorophyll fluorescence parameters of C.salina
表1 给出了不同HBCD 添加浓度下,海水小球藻细胞密度和Chl a 含量对Cu2+的96 h-EC50变化情况。5 μg·L-1和500 μg·L-1HBCD 添加浓度联合暴露处理组,由细胞密度得到的96 h EC10(262、199 μg·L-1)和EC50(513、403 μg·L-1)值与Cu2+单独暴露均有显著差异,且随HBCD 浓度升高而降低。通过细胞密度计算的96 h-EC50明显大于Chl a 含量计算结果,与上述细胞密度和Chl a变化情况相同。析因分析表明,HBCD和Cu2+联合暴露对海水小球藻的影响呈现交互作用(P=0.001)。
3 讨论
藻类常用于评估各类污染物毒性效应,但目前针对HBCD 对微藻的生态风险评估研究仍很有限。Bertucci 等[18]的研究表明HBCD 的细胞毒性高度动态,不遵循传统的浓度反应模式,与本研究结果一致。在本研究中,高浓度HBCD 胁迫下海水小球藻的细胞密度高于低浓度的,且所有处理中藻细胞的抑制率均低于50%,可能是由于海水小球藻具有良好的光合活性和较强的抗氧化系统,足以抵御HBCD 的氧化胁迫[19]。低毒性的化合物暴露短时间内一般不会引起个体死亡,可能首先导致生物体的生理生化水平发生异常[20]。例如,Wu等[21]的研究发现低浓度HBCD暴露斑马鱼72 h 后,斑马鱼胚胎心率和心律失常增加,而存活率和整体畸形率未受到显著影响,推测心脏可能是HBCD 的作用靶点。但在本研究中,发现HBCD 对微藻Fv/Fm 的影响不显著,说明Fv/Fm 可能不适用于HBCD对微藻的毒性检测。
Li等[22]的研究发现,Cu2+会影响微藻的生长,且当其浓度达到一定范围会抑制藻细胞生长。在本研究中,也观察到当Cu2+暴露浓度大于500 μg·L-1时藻细胞数量显著下降,在一定浓度范围内海水小球藻的细胞密度与Cu2+浓度呈剂量效应关系。在实验过程中,高浓度Cu2+处理组出现藻细胞絮凝沉淀,推测其原因有:①高浓度Cu2+使微藻细胞失去悬浮生长的能力;②细胞集聚可以在表面形成黏液层,可以一定程度延缓和防止金属的毒性作用[23]。Cu2+不仅抑制细胞生长,同时还损伤藻细胞光合色素。在光合作用中,光合色素是反映藻类光合效率的重要指标,Chl a 是藻类的主要捕光色素[24]。光合生物对重金属敏感度较高,故Cu2+处理组海水小球藻Chl a 含量比细胞密度受到抑制程度更高,这主要是由于Cu2+破坏藻细胞的光合作用系统,导致Chl a含量下降,进而影响藻类的生长[25-26]。
HBCD和Cu2+是电子垃圾回收过程中释放的主要有害物质[27],然而目前关于其联合暴露的毒性作用机制知之甚少,因此本研究展开HBCD 和Cu2+联合暴露对海水小球藻的毒性作用研究。污染物引起的氧化应激是损伤微藻的主要方式,研究表明溴化阻燃剂和重金属都会引起氧化应激,损伤叶绿体膜,并抑制抗氧化酶的活性[28-29]。在本实验中,HBCD 和Cu2+联合暴露下海水小球藻细胞密度和Chl a 含量降低,推测可能是HBCD 和Cu2+诱导微藻叶绿体产生大量活性氧引起脂质过氧化的结果。混合污染物因各组分物理化学性质不同而产生不同的影响,但各成分的混合比例起着重要的作用[30]。在本研究中,500 μg·L-1Cu2+与不同浓度HBCD组合对海水小球藻生长的影响有显著差异,而低浓度Cu2+混合物处理组则未表现出类似规律,表明污染物本身的化学性质对联合毒性的影响小于其浓度组合的影响。
在藻类光合作用研究中,叶绿素荧光动力学技术是一种简单、无损伤的检测方法[31]。叶绿素荧光与光合作用过程密切相关,对污染物响应敏感,其中Fv/Fm 和ΦPSⅡ是2 个反映光合效率的叶绿素荧光参数[32]。本研究发现,高浓度Cu2+处理下,Fv/Fm显著降低,在Chen 等[33]的研究中也发现类似变化规律,可能是由于Cu2+破坏PSⅡ系统并强烈抑制光合电子传输速率。藻细胞密度的显著下降进一步证实Cu2+诱导毒性并超过藻细胞的耐受极限,可能致使细胞结构断裂解体,进而导致相关荧光参数下降[34]。此外,Cu2+还可通过破坏电子传递链和取代Chl a 分子中的Mg 来破坏光合系统[35]。然而,HBCD 对藻细胞光合作用的毒性机制仍未可知。有限的研究发现,溴化阻燃剂三(2,3-二溴丙基)异氰尿酸酯会抑制psbC 的表达,从而减少编码蛋白质与Chl a 的结合,破坏PSⅡ反应中心[36];还有研究发现溴化阻燃剂BDE-47 会影响类囊体膜的通透性[37],并产生活性氧降解光合色素和破坏叶绿素结构[38]。本研究中,HBCD 单独暴露时,Fv/Fm和ΦPSⅡ无明显变化,而它们在HBCD 和Cu2+联合暴露中随HBCD 添加浓度的升高而降低,表明HBCD 加剧了Cu2+对微藻光合系统的损伤。
半数效应浓度(EC50)是剂量反应关系研究中广泛运用的标准统计量,被认为是化合物毒性的决定因素[39]。小球藻属隶属于绿藻门,是水环境中分布最广泛的类群之一。研究发现,同一属的不同小球藻之间Cu2+的96 h-EC50差异明显,蛋白核小球藻(Chlorella pyrenoidosa)的96 h-EC50为68 μg·L-1[40],而椭圆小球藻(Chlorella ellipsoidea)的96 h-EC50为489 μg·L-1[41],淡水普通小球藻(Chlorella vulgaris)的96 h-EC50为591 μg·L-1[42],甚至 有些藻株的96 h-EC50可高达110.3 μmol·L-1(约7 059 μg·L-1)[43]。一般认为具有较大的比表面积的藻细胞能够提供更多的金属结合位点,随着藻细胞表面吸附的Cu2+增多,其对藻细胞的毒性作用加强。本研究所用的海水小球藻对Cu2+胁迫的耐受性高于大部分的藻类,可能与其细胞较小、Cu2+的初始吸附量小有关[40]。污染物的敏感性会随受试对象的形态和生理特征或本身形态而异,通常认为生理终点比生存终点具有更高的敏感性[44]。在本研究中观察到基于Chl a 计算的96 h EC10和EC50更小,即Chl a 对污染物更为敏感。EC10、EC50、无观察效应浓度(no observed effect concentration,NOEC)和最低观察效应浓度(lowest observed effect concentration,LOEC)是评价污染物急性毒性的重要指标。在本研究中EC10和EC50随污染物浓度显著变化,而NOEC 和LOEC 则明显变化。NOEC 和LOEC 与实验设计和统计假设检验方法的选择有关,EC10和EC50是基于剂量效应曲线获得,因此认为选择EC10和EC50更适合评价污染物的毒性。交互作用可以反映一个因素不同水平变化受其他因素不同水平影响,双因素方差分析是最简单且有效评价两个污染物对实验结果是否有交互作用的工具,在本研究中HBCD 和Cu2+对海水小球藻的影响具有交互作用[45]。
4 结论
(1)六溴环十二烷(HBCD)对海水小球藻的毒性低,96 h-EC50大于3 500 μg·L-1,HBCD对Chl a含量和Fv/Fm的影响不显著。
(2)Cu2+对海水小球藻的毒性呈剂量依赖性抑制,基于细胞密度和Chl a 计算的96 h-EC50分别为637 μg·L-1和541 μg·L-1,Chl a 对Cu2+的响应高于细胞密度。
(3)HBCD 和Cu2+对海水小球藻的影响具有交互作用,同时HBCD 会加剧Cu2+对海水小球藻的毒性,表现为细胞密度、Chl a 含量、叶绿素荧光参数(Fv/Fm、ΦPSⅡ)和96 h-EC50降低,Chl a 对HBCD 和Cu2+联合暴露的响应高于细胞密度。因此,溴化阻燃剂和重金属一旦释放,会引起水生生物中毒,进而威胁整个海洋生态系统。

