不同热解温度牛骨生物炭特征及对Cd2+的吸附
黄涛,胡林潮,吴佳楠,张文艺,毛林强
(常州大学环境科学与工程学院,江苏 常州 213164)
镉是一种人体非必需的有毒重金属,其具有较高的迁移率、生物毒性和不可降解性,容易在人体中富集并对健康造成严重损害,国际癌症研究机构已将其列为致癌物[1]。每年有超过25 000 t镉通过有色金属冶炼与开发、工厂排放与农业污水灌溉等途径被释放到环境中,对生态系统造成影响,严重污染水体环境[2]。面对当前人类活动产生的大量镉污染废水,找到一种绿色高效的水体重金属污染修复方法势在必行。
目前,常见的水体重金属污染处理方法主要包括离子交换、化学沉淀、膜分离和吸附[3]。相比之下,吸附法因其成本低、效率高和环境友好等优点而被认为是一种高性价比污水修复方法,向水中添加吸附剂吸附重金属具有操作简便、成本低等特点[4]。活性炭、有机物料、微生物生物质、碳纳米管与改性黏土等都被用作吸附剂去除水体中的镉,但大多数吸附剂都存在高成本、低效率与处理条件复杂等问题[5]。与其他吸附剂相比,生物炭原料来源广泛、吸附性能好、应用成本低,且其具有较大的比表面积与较高的孔隙率以及丰富的官能团而被广泛应用于水体重金属污染治理中[6]。然而,不同热解温度下生物炭理化性质及其对水体重金属吸附特性存在较大差异[7]。Lian 等[8]发现900 ℃下热解制备牡蛎壳生物炭对Cd2+的亲和力远高于300 ℃与600 ℃下热解的生物炭,推测是由于900 ℃时生物炭中的方解石分解为CaO 所致。马洁晨等[9]发现π 电子配位作用对生物炭吸附Cd2+贡献率随热解温度的升高而增加。来张汇等[10]认为离子交换作用是低温水稻秸秆生物炭的主要吸附机制,沉淀作用为高温生物炭的主要吸附机制。前人多以废弃农林作物为原料在不同热解温度条件下制备生物炭探讨对Cd2+的吸附机制,而以动物骨源为原料的相关研究较少。
据报道,随着全球肉类行业大规模扩张,肉类加工副产物骨骼将达4 000 万t,国内肉类需求也在不断扩大,预计到2028 年我国牛肉产量将增长8%[11]。大量废弃骨骼需要妥善处理,然而动物骨价格低廉且不易储存,大多遭到堆置与废弃,造成资源浪费与环境污染问题,其资源化利用已成为我国当前肉类加工及病死动物无害化处理的首要问题[12]。采用限氧热解方式将动物骨转化为骨炭,不仅能够减少体积,而且能杀灭病菌,且能减少二噁英等有毒有害物质的产生[13]。动物骨由70%的羟基磷灰石[Ca10(PO4)6(OH)2]、10%的碳以及20%的碳酸盐与磷酸盐等无机盐组成[14]。作为一种多功能环境友好型吸附剂,骨炭在重金属污染物吸附上有广泛的应用前景。骨炭主要成分羟基磷灰石中的Ca2+不仅与重金属阳离子在离子交换过程中起重要作用,而且能与重金属离子发生共沉淀作用,骨骼中的有机物在热解后形成多孔碳化合物也具有吸附效果[15]。本研究以废弃物牛骨为原料,通过慢速热裂解方式制备骨炭,研究不同温度下热解制备牛骨生物炭理化性质差异,通过批次吸附实验探究其对Cd2+的吸附特性,以期为废弃动物骨骼资源化利用及其在水体重金属污染治理中的应用提供理论依据与实践参考。
1 材料与方法
1.1 牛骨生物炭的制备
牛骨收集于常州市某肉制品加工厂,将牛骨洗净后置于85 ℃烘箱中烘干,粉碎机粉碎后过60 目筛,将其装瓶后放置于干燥器内保存。
采用限氧控温炭化法制备牛骨生物炭:将牛骨粉原料置于100 mL碗状陶瓷坩埚中,尽可能塞满(90 g)并压实铺平。加盖称重后置于马弗炉内以10 ℃·min-1升温至目标温度(300、350、400、500、700 ℃和900 ℃)保温2 h,自然冷却至室温后取出,称质量后装入瓶中,置于干燥器内备用。不同温度制得的牛骨生物炭分别标记为CBC300、CBC350、CBC400、CBC500、CBC700和CBC900。
1.2 牛骨生物炭的表征
根据热解前后牛骨生物炭与原料质量的比值,可得牛骨生物炭产率;挥发分(VM)、灰分(ASH)的测定参照《木炭和木炭试验方法》(GB/T 17664—1999);pH值测定:按m(生物炭)∶V(去离子水)=1∶20比例测定。采用扫描电子显微镜(SUPRA-55)观测牛骨生物炭吸附重金属前后微观形态及表面结构特征;采用BET法测定牛骨原料及牛骨生物炭的比表面积、孔体积和孔径,吸附-脱附气体采用氮气(ASAP 2020 PLUS);利用傅里叶红外光谱仪(Nicolet iS20)表征吸附前后牛骨生物炭表面官能团的变化;利用X射线粉末衍射仪(D/MAX2500)对吸附前后牛骨生物炭表面结晶物质化合物类型进行分析;利用热重分析仪(Labsys Evo)对牛骨原料进行热重分析。
1.3 吸附实验
试验药剂:Cd(NO3)2·4H2O、NaOH 和浓HNO3均为分析纯;试验用水为去离子水。重金属贮备液的配制:称取2.744 2 g Cd(NO3)2·4H2O,用少量去离子水溶解后转移至容量瓶中定容至1 L,贮备液中Cd2+浓度为1 000 mg·L-1。
1.3.1 吸附动力学试验
于100 mL 聚乙烯锥形瓶中放入0.1 g 牛骨生物炭,用上述贮备液配制质量浓度为150 mg·L-1的Cd2+溶液30 mL,以去离子水为背景溶液,用0.1 mol·L-1HNO3或NaOH 调节溶液pH 为(5.0±0.05),在(25±1)℃,195 r·min-1条件下避光振荡,分别于0、5、20、40、60、90、150、240、480、720 min和1 440 min时取样,转移至50 mL 离心管中以4 500 r·min-1离心10 min,取上清液过0.22 μm 水系滤膜并用1%HNO3稀释定容,用火焰原子吸收光谱仪(novAA300)测定溶液中Cd2+、Na+、K+、Ca2+、Mg2+浓度,采用异丁醇萃取-钼蓝比色法测定PO3-4浓度,酸碱指示剂滴定法测定溶液中CO2-3浓度,每个处理均设置3 个重复,并将底层沉淀送入冷冻干燥机真空干燥24 h后放入密封袋备用。
1.3.2 等温吸附试验
利用Cd2+贮备液分别配制初始ρ(Cd2+)为20、40、60、80、100、130、150、200 mg·L-1和250 mg·L-1的溶液30 mL 于100 mL 锥形瓶中,分别放入0.1 g 牛骨生物炭,振荡24 h,每个处理均设置3 个重复,其余实验条件和步骤同吸附动力学实验。
1.3.3 pH值对Cd2+吸附影响试验
设置初始pH 范围为2.0~7.0 的吸附体系,振荡24 h,离心,取上清液测定Cd2+浓度,在同等条件下进行不含Cd2+溶液体系试验,每个处理均设置3 个重复,其余试验条件和步骤同吸附动力学实验。
1.3.4 吸附模型
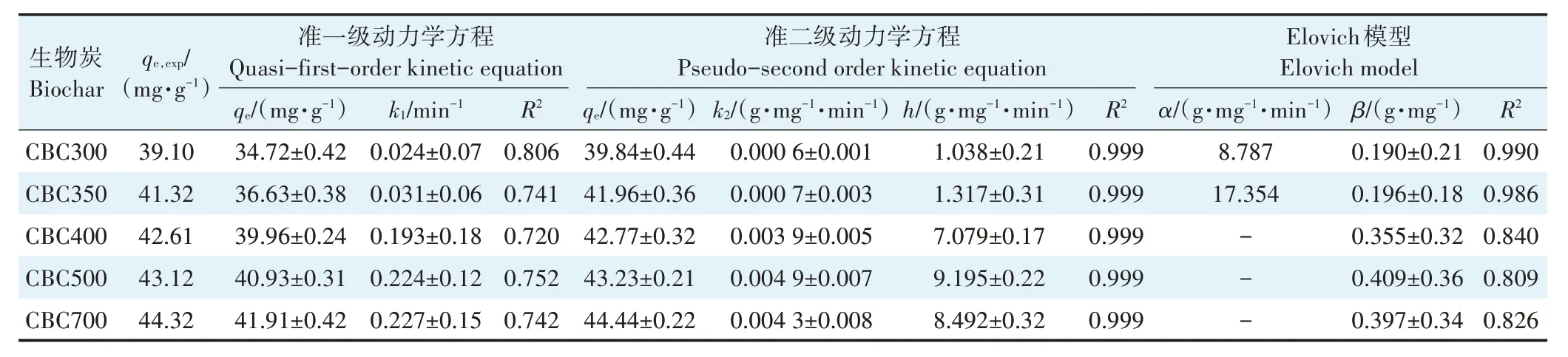
采用准一级(式1)和准二级(式2)吸附模型对动力学数据进行拟合,分析溶液中Cd2+的动力学吸附行为。初始吸附速率h=k2qe2,采用颗粒内扩散模型(式3)与Elovich 模型(式4)对牛骨生物炭吸附Cd2+的过程作进一步分析。
式中:qe和qt分别为Cd2+的平衡吸附量和t 时刻的吸附量,mg·g-1;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g·mg-1·min-1,kpi为扩散速率常数,mg·g-1·min-0.5;Ci为常数,表示牛骨生物炭边界层;a 为吸附速率常数,g·mg-1·min-1;b 为解吸速率常数,g·mg-1。
利用Langmuir(式5)和Freundlich(式6)等温吸附模型拟合等温吸附过程。
式中:Ce为吸附平衡浓度,mg·L-1;qe为平衡吸附量,mg·g-1;qm为最大吸附量,mg·g-1;kl为牛骨生物炭对重金属离子的亲和力,L·mg-1;kf为吸附容量,mg·g-1;n为吸附强度。
1.4 数据分析
数据处理采用Excel 2016 软件,绘图和方程拟合采用Origin 2019b软件。
2 结果与讨论
2.1 牛骨生物炭的热解行为
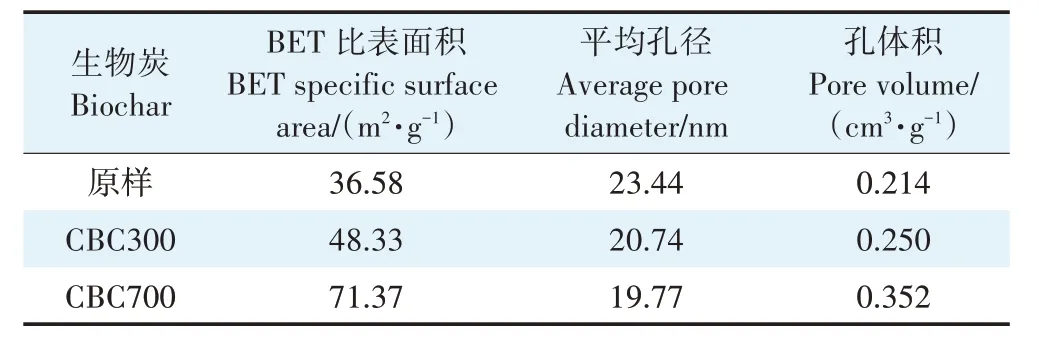
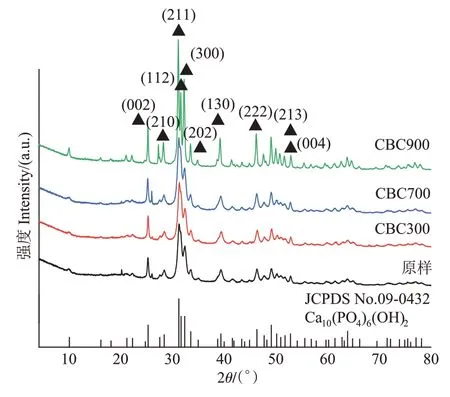
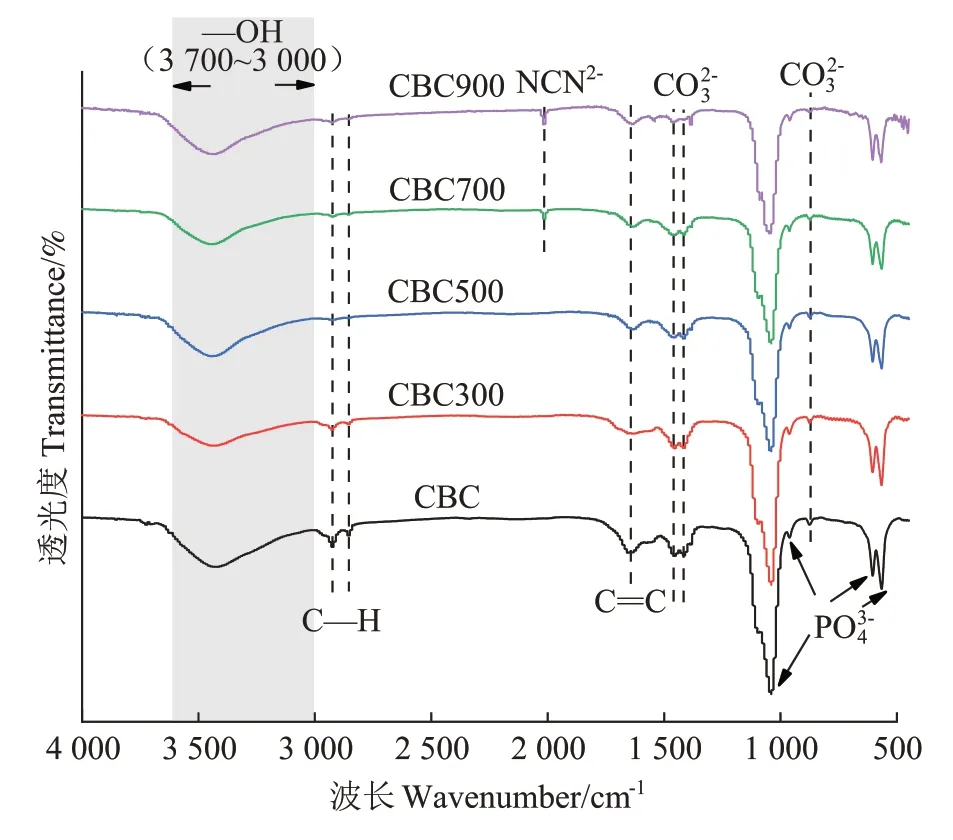
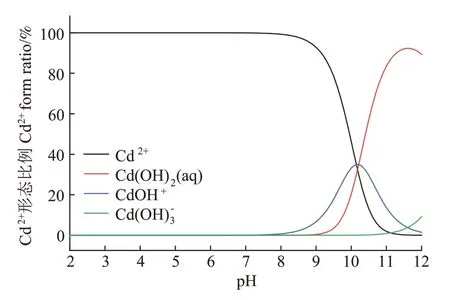
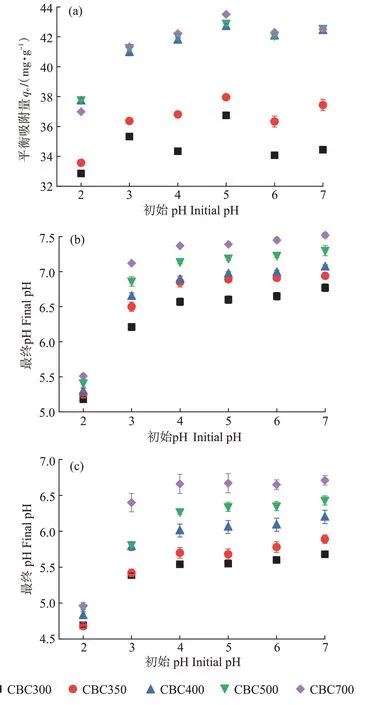
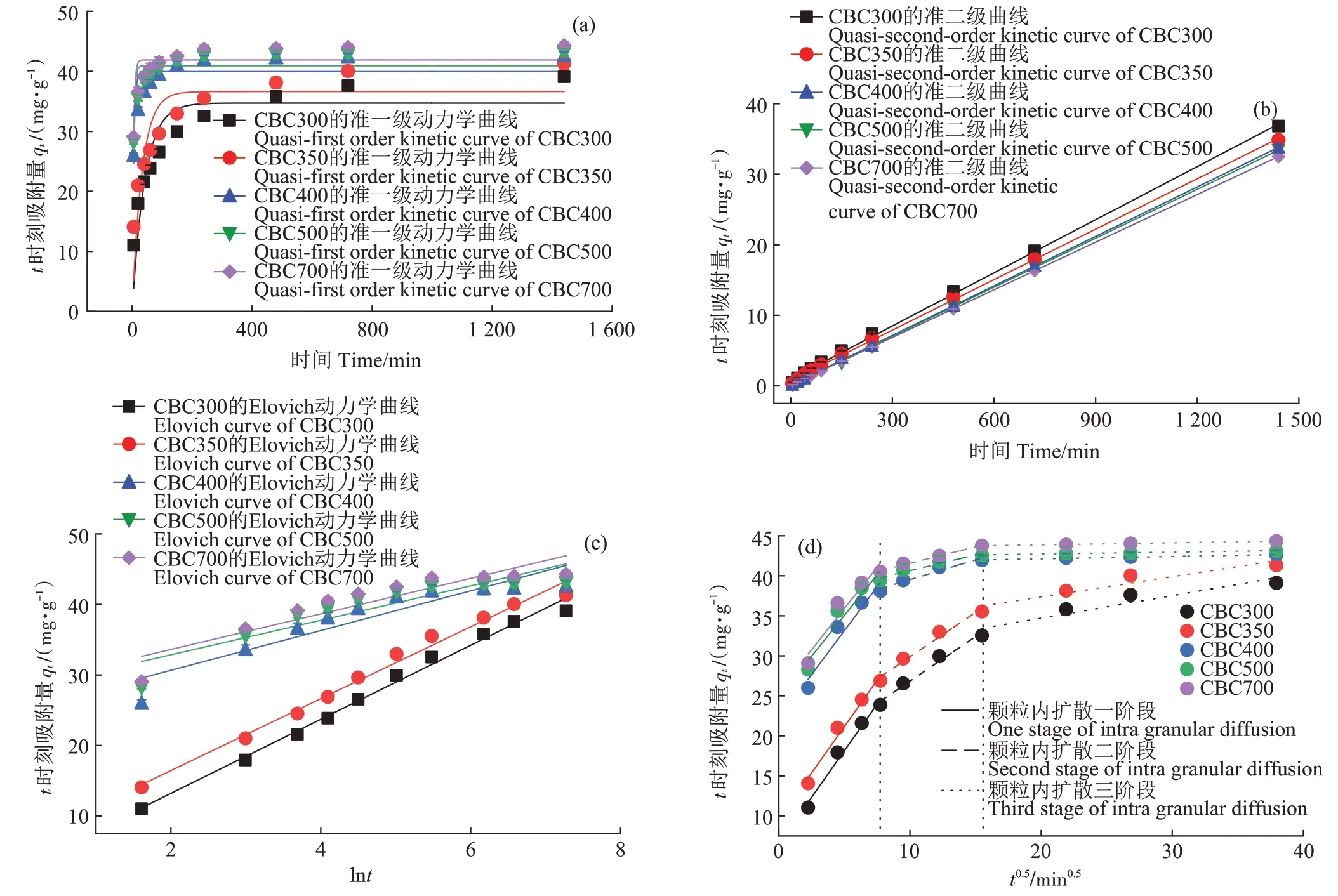
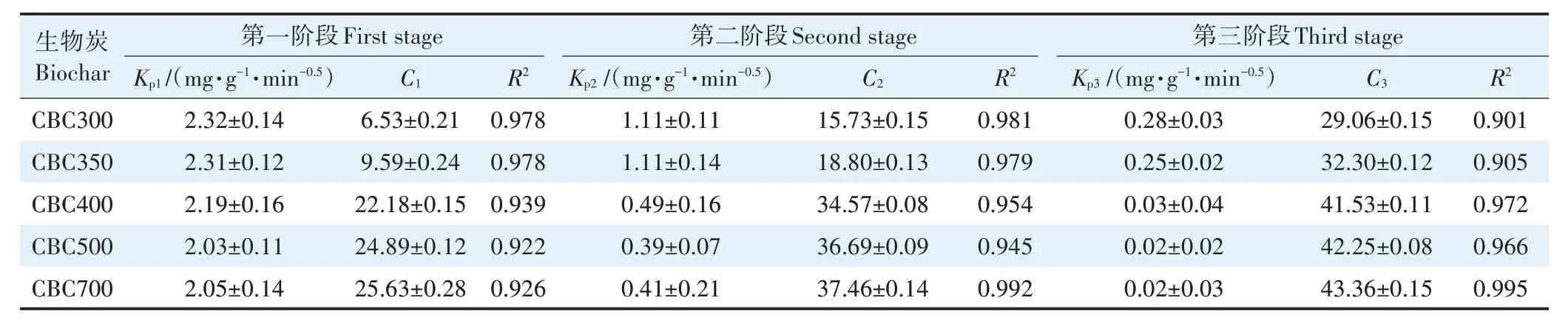
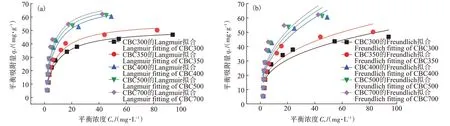
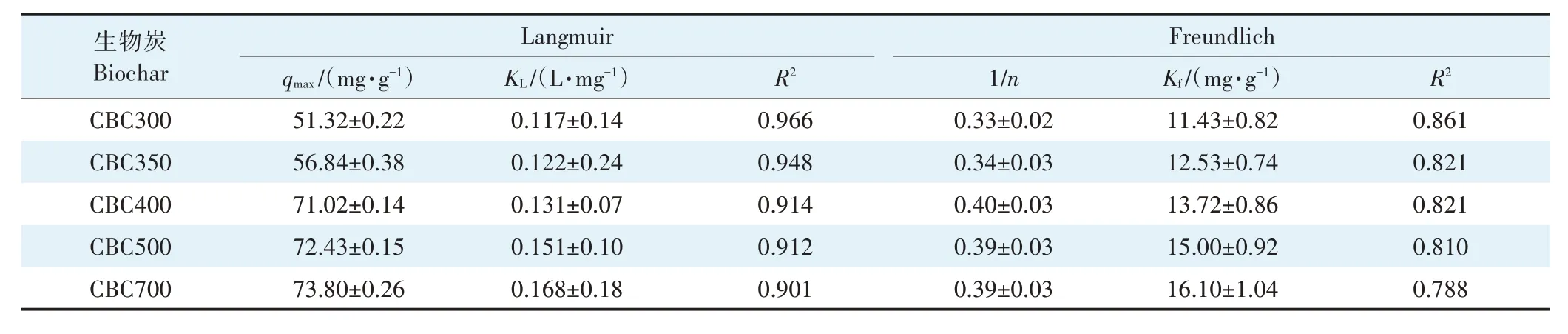
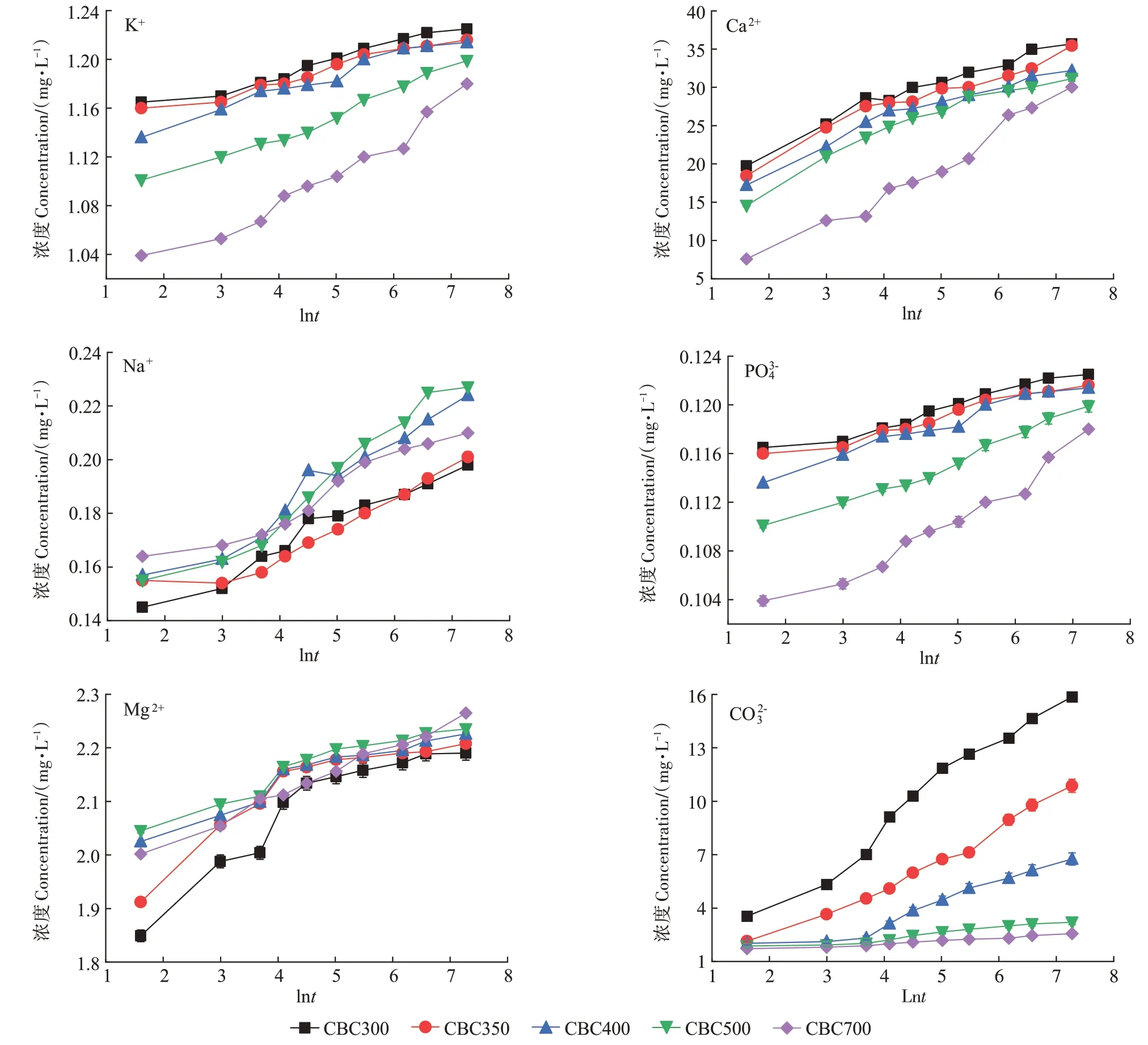
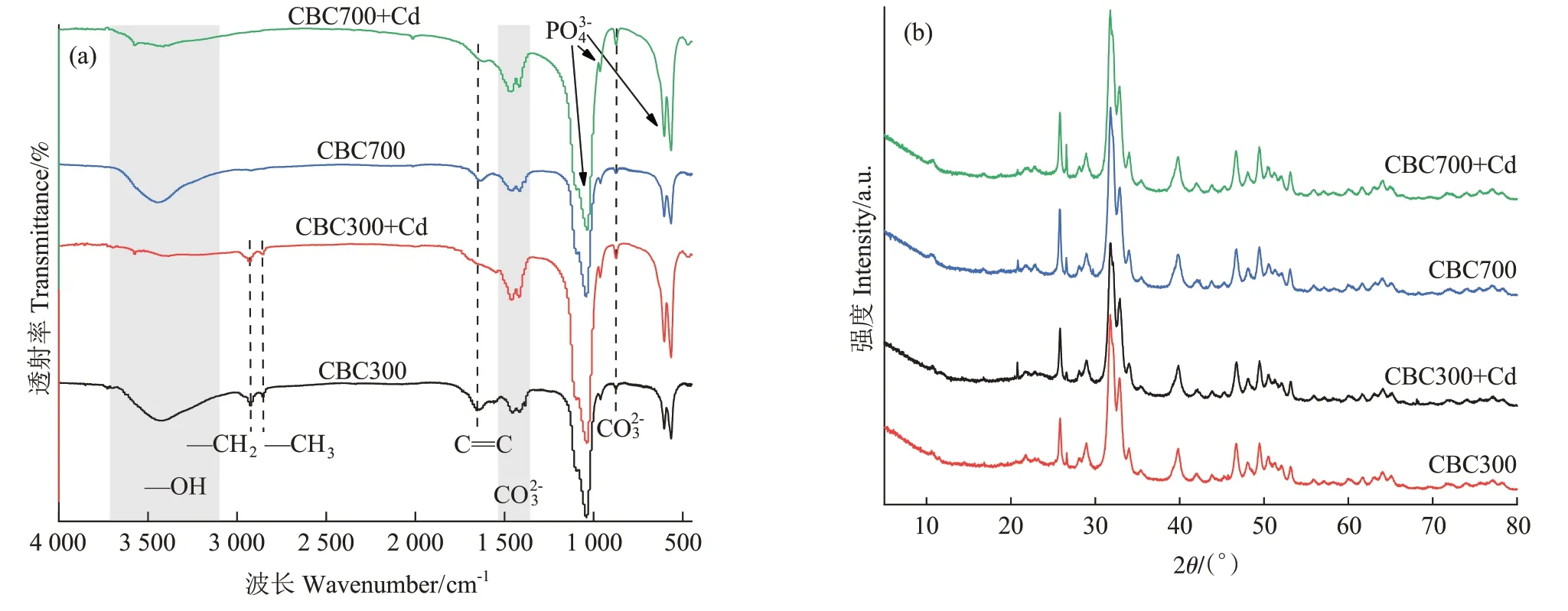
在升温速率为10 ℃·min-1,热解气氛为氮气条件下从室温升至950 ℃对牛骨原料进行热重分析,结果见图1。牛骨生物炭热解过程可划分为四个阶段,第一阶段(t≤130 ℃):此阶段DTG 曲线出现一个较不明显的吸热峰,并在71 ℃达到最大,主要为牛骨中所含水分以及部分小分子量挥发性物质的损失,此阶段质量损失约3.12%。第二阶段(130 ℃ 图1 牛骨原料热重分析Figure 1 Thermogravimetric analysis of beef bone materials 由表1 可知,随着制炭温度升高,产率逐渐降低,热解温度在300~500 ℃时产率下降了7.88 个百分点,500~700 ℃产率仅下降了2.15 个百分点,低温段产率较高温段下降幅度较大,这可能是因为较低温度下一些大分子有机成分向难降解小分子组分分解转变,并在此过程中释放各种挥发性物质所导致的,而低温下分解后的残余物(高沸点与难挥发物质)则需要更高的温度才能缓慢分解,并最终向更加稳定的无机物转变。因此,高温段产率减少幅度较低温段小,此趋势亦可从牛骨热解行为中得到印证。牛骨生物炭总体产率较前人研究相比较高,这可能是由于制炭条件与生物质种类不同所致[18]。多数植物炭中主要成分为木质素、纤维素与半纤维素,随着裂解温度升高,这些有机成分在很大程度上以挥发性物质和气体的形式转化和释放,而动物骨裂解后挥发性较低的矿质元素如Ca 与Mg 等相较于植物炭在相同温度下更难分解,最终以无机物的形式保留下来。 表1 不同热解温度下牛骨生物炭理化性质Table 1 Physicochemical properties of bovine bone biochar at different pyrolysis temperatures 生物炭灰分主要以K、Ca、Mg、Fe、Na、Si 的氧化物或盐类形式存在,大部分无机组分随热解过程浓缩并富集于其中[19]。不同热解温度牛骨生物炭灰分及挥发分含量如表1 所示。牛骨生物炭的灰分含量随热解温度的升高呈现递增趋势,挥发分含量逐渐减少。当热解温度从300 ℃升高至700 ℃时,挥发分含量由14.36%减少至7.91%,灰分含量由82.16%增加到91.00%,且灰分总体含量较高。高温段(500~700 ℃)灰分含量增加幅度相较于低温段(300~500 ℃)减少了3.28 个百分点,这可能是由于无机组分在低温热解时就已充分富集所致,这与前人研究基本一致(65.8%~86.8%)[20]。 牛骨原料pH 为5.62,呈酸性,这可能是由于牛骨原料中含有的有机酸溶于水所致,有机酸中最常见的是羧酸,其酸性来源于羧基,随热解过程的进行逐渐分解。牛骨生物炭的pH 随着温度升高而提高,为6.52~8.88,由弱酸性逐渐向碱性转变,这与以污水处理厂的污泥为原料热解制备生物炭结果一致(6.66~8.40)[20]。随着热解温度的升高,生物炭表面碱性官能团数量增加,酸性官能团数量减少,使得H+以H2O 的形式脱离使得牛骨生物炭呈碱性。高温下牛骨生物炭中碱金属(K、Na 等)与碱土金属(Ca、Mg)富集浓缩以氧化物、碳酸盐或磷酸盐形式残留于灰分中。 重金属离子的吸附性能受生物炭的比表面积、孔体积及孔径结构所影响[21]。由表2 可知,牛骨生物炭BET 比表面积随热解温度升高而增大,原样、CBC300和CBC700 分别为36.58、48.33 m2·g-1和71.37 m2·g-1。牛骨生物炭在高温下有机物的分解以及大孔向介孔的转变可能是表面积增加的原因。随热解温度的升高,多孔结构逐渐成熟,有助于更高内表面积的产生[22]。原 样、CBC300 和CBC700 平 均 孔 径 分 别 为23.44、20.74 nm 和19.77 nm,表明牛骨生物炭孔径分布较大且以介孔为主。孔隙宽度随热解温度升高而减少,且高温段相较于低温段孔径缩减幅度较小,牛骨原料与CBC300之间相差2.7 nm,而高温段CBC300至CBC700 之间相差0.97 nm,由此推断,牛骨原料中相对较大的孔隙(20~70 nm)随温度升高逐渐分解崩塌,孔径逐渐减小。由表2 可知低温段孔体积增加幅度(0.036 cm3·g-1)相较于高温段(0.102 cm3·g-1)小得多,这可能是由于低温下有机物分解不完全,或挥发性化合物没有得到充分挥发,随热解结束而冷凝并重新滞留于孔隙中,而高温使得其充分挥发逸散,原有大孔受到冲击崩散为介孔,使得孔体积快速增加。 表2 牛骨生物炭BET比表面积、平均孔径与孔体积参数Table 2 Specific surface area,average pore size and pore volume parameters of bovine bone biochar 不同热解温度牛骨生物炭XRD 图谱见图2。XRD 衍射图谱显示了牛骨及不同温度下制备的样品为典型的羟基磷灰石结构。在牛骨中,胶原纤维形成有组织的基质,其中羟基磷灰石的纳米晶体就位于基质中[23]。可以看出原料骨粉由结晶度较差的羟基磷灰石相组成,非晶相占主导地位,其背景噪声强度较大,且衍射峰较宽,峰型较为平滑,衍射强度小,这可能是由于原料中有机物和骨胶原蛋白的存在导致的。随着热解温度升高至900 ℃,峰宽明显缩小,衍射强度增大,峰型更加尖锐,特征峰出现明显劈裂,碳酸盐的分解与去羟基化在此阶段同时进行,羟基磷灰石晶体快速生长,直至900 ℃时才能明显观察到(112)处的特征衍射峰,晶面间距较其他温度段小幅增大,此时牛骨生物炭中羟基磷灰石结晶度较高,有研究认为(002)、(210)和(300)面是羟基磷灰石中最重要的生长面[24]。 图2 牛骨生物炭在不同热解温度下的XRD图谱Figure 2 XRD patterns of bovine bone biochar at different pyrolysis temperatures 牛骨生物炭红外光谱如图3 所示。牛骨原料于3 700~3 000 cm-1处有一个幅度较宽的—OH 吸收振动频带,这主要是由于分子间氢键缔合的酚羟基或醇羟基的伸缩振动所引起的。随着热解程度加剧,牛骨生物炭在该处的振动峰有一定幅度的减弱,损失了部分羟基。2 920、2 850 cm-1处的吸收峰为C H 伸缩振动,分别为脂肪烃(—CH2)对称伸缩振动与环烷烃(—CH3)的非对称伸缩振动[25]。其在原料中可以被明显观察到,温度升高至300 ℃时伸缩振动峰显著减小,有机质逐渐分解,随后在高温段基本消失,较高的热解温度使得脱氢反应加剧,牛骨生物炭芳香化程度随温度升高而增强。1 410、1 450 cm-1以及876 cm-1处为进入羟基磷灰石晶格取代出现的特征吸收峰[26]。当温度继续升高至900 ℃时,可以观察到1 410、1 450 cm-1处的吸收峰有明显减弱的迹象,且876 cm-1处峰强较之前有所减小,说明此时碳酸盐在一定程度上分解,这与Figueiredo 等[17]研究结果相一致。1 650 cm-1处特征峰为C—C 伸缩振动峰,随着热解温度升高,芳香性增强,此特征峰逐渐增强。然而,与之相反的是当热解温度处于700 ℃时,谱图在2 020 cm-1附近开始出现尖峰,且温度达到900 ℃时峰强亦随之增大,低温段则并无此峰,这可能是由于热解过程中原料牛骨中的碳与骨胶原蛋白中的氮反应所生成的NCN2-离子引起的[27]。谱带于566 cm-1及604 cm-1处出现两个明显的吸收峰,这属于反对称弯曲振动峰;1 040 cm-1处吸收峰是由反对称弯曲振动造成的;960 cm-1处则属于对称弯曲振动峰[28]。 图3 牛骨生物炭在不同热解温度下的红外图谱Figure 3 FTIR patterns of bovine bone biochar at different pyrolysis temperatures 2.7.1 pH值对牛骨生物炭吸附Cd2+的影响 图4 是利用Visual MINTEQ 3.1 模拟计算不同pH(2~12)条件下Cd2+在溶液中的形态变化,可知pH 在2~7区间内溶液中Cd2+占主导地位,形态基本不随pH改变,因此选取pH区间为2~7。 图4 不同pH环境下Cd2+形态分布图Figure 4 Morphological distribution of Cd2+in different pH environment 图5 (a)显示了初始pH 值对牛骨生物炭吸附Cd2+能力的影响,pH=2 时不同温度下制备的牛骨生物炭对Cd2+吸附量较低,溶液环境中大量游离的H+与Cd2+对其表面含氧官能团点位和π 共轭点位上的吸附位点均有很强的竞争作用,表面基团(主要为羟基与羧基)发生质子化而带正电荷,进而导致其表面与Cd2+产生静电排斥,同时牛骨生物炭灰分中大量难溶性矿物组分此时在酸性环境中溶解度提高,释放出游离的Ca2+、Mg2+与K+,也与Cd2+竞争吸附位点,更加不利于对Cd2+的吸附。而随着初始pH 的增加,溶液中游离的H+减少,其表面基团发生逆质子化带负电荷,同时矿物组分不易溶解,Ca2+、Mg2+与K+释放量逐渐减少,其与Cd2+的竞争吸附逐渐减弱,牛骨生物炭对Cd2+的吸附量也随之上升,当初始pH值超过4时,Cd2+吸附量趋于稳定,且pH=5时的吸附量略高于其他初始pH条件下对Cd2+的吸附量,这与Kołodyn´ska等[29]的研究一致。 图5 (a)pH值对牛骨生物炭吸附Cd2+的影响;(b)平衡后牛骨生物炭在无Cd2+溶液中pH值的变化;(c)平衡后牛骨生物炭与Cd2+混合溶液的pH值变化Figure 5(a)Effects of pH on Cd2+sorption to bovine bone biochar,(b)pH values change the mixed solution of bovine bone biochar without Cd2+after equilibration,(c)pH values change of the mixed solution of bovine bone biochar with Cd2+after equilibration 由图5(b)、图5(c)可知,初始pH 范围在2~3 时,平衡后溶液pH呈快速上升趋势,随后保持稳定(初始pH 范围4~7)。由图5(b)与图5(c)对比可知,加入Cd2+后,平衡溶液整体pH 值较未加Cd2+显著降低,这可能是由于Cd2+被吸附过程中协同释放牛骨生物炭的质子(H+),且与牛骨生物炭的阴离子(CO32-、PO43-等)形成沉淀所致[30-31]。 2.7.2 牛骨生物炭对Cd2+的吸附动力学 由图6(a)可知,在初始浓度为150 mg·L-1条件下,不同温度制备的牛骨生物炭对Cd2+的吸附量在120 min 内呈迅速上升趋势,之后逐渐减缓并于720 min内基本达到吸附平衡。相较于CBC300、CBC350,CBC400、CBC500 和CBC700 平衡时间更短,后者于120 min内吸附效率分别达到93.2%、94.6%和97.3%,而前者仅为72.3%和79.0%,且单位时间内吸附量随热解温度升高而增加,这可能是由于350~400 ℃左右牛骨质量损失速率达到最大,有机质大量分解,孔体积快速增大致使吸附点位增加导致的。 图6 牛骨生物炭对Cd2+的吸附动力学曲线Figure 6 Adsorption kinetics of bovine bone biochar for Cd2+ 牛骨生物炭吸附重金属Cd2+的准一级动力学方程拟合结果见图6(a)与表3。从图中可看出准一级动力学方程均可较好拟合吸附初始阶段(t<40 min),而后逐渐偏离吸附过程,且由表3 可知该模型拟合可决R2较低(0.72 表3 不同热解条件下牛骨生物炭吸附动力学方程参数Table 3 Parameters of adsorption kinetics equation of bovine bone biochar under different pyrolysis conditions 与准一级动力学模型相比,准二级动力学方程拟合可决系数R2均为0.999,线性相关性显著,其能够准确拟合吸附全过程,主要原因可能是牛骨生物炭中主相HAP 吸附溶液中Cd2+是以离子交换作用为主的广义吸附作用,符合该模型建立时设立的边界条件[32]。且由表3可知准二级动力学模型理论平衡吸附量qe,cal与动力学试验实际平衡吸附量qe,exp较为吻合。根据拟合参数k2可进一步得出初始吸附速率h,CBC300~CBC700 初始吸附速率分别为1.038、1.317、7.079、9.195 g·mg-1·min-1和8.492 g·mg-1·min-1,可知CBC500的初始吸附速率更快,略高于CBC700。 由图6(c)结合表3 可知,CBC300 和CBC350 可决R2分别为0.990与0.986,且qt与lnt之间线性关系较为显著,符合Elovich 吸附动力学模型,在整个吸附过程中表面吸附能是均匀分布的;CBC400、CBC500 与CBC700 可决R2分别为0.840、0.809 和0.826,吸附值偏离拟合曲线,该模型不适用于拟合高温(400~700 ℃)热解牛骨生物炭吸附Cd2+的过程。鉴于牛骨生物炭对Cd2+的吸附过程是由多步骤复合反应组合而成,且呈现分布吸附特征,故运用颗粒内扩散模型对吸附机制进行进一步的完善。 由拟合结果可知,牛骨生物炭吸附Cd2+过程分为3个阶段(图6d),这与经典的吸附3阶段理论相吻合。且不同温度制备骨炭于各个阶段下的可决R2均大于0.9,且qt与t0.5满足相应的线性关系,说明牛骨生物炭对Cd2+吸附具有粒子内扩散特性,颗粒内扩散是其限速步骤之一。颗粒内扩散第一阶段为Cd2+通过液膜扩散至其表面;第二阶段Cd2+由牛骨生物炭表面孔隙进入其内部进行扩散并与吸附点位结合,颗粒内扩散在此阶段起主导作用;第三阶段为Cd2+发生瞬时吸附的过程,此时吸附基本平衡。由表4 拟合参数可知,不同热解温度牛骨生物炭内扩散速率常数kp1>kp2>kp3,边界层C1 表4 不同热解条件下牛骨生物炭颗粒内扩散方程参数Table 4 Diffusion equation parameters of bovine bone biochar particles under different pyrolysis conditions 2.7.3 牛骨生物炭对Cd2+的吸附等温线 由图7 可知,随热解温度的增加,牛骨生物炭对Cd2+的吸附量在低浓度时随平衡浓度的增加而快速上升,而后逐渐平衡。这是由于在吸附初始阶段,牛骨生物炭表面为Cd2+提供了大量吸附位点,随着吸附进程的持续,吸附位点逐渐被占据直至饱和,吸附量不再增加。 图7 牛骨生物炭对Cd2+的吸附等温线Figure 7 Adsorption isotherms of Cd2+by bovine bone biochar 由表5 可知,Langnmir 模型对牛骨生物炭吸附Cd2+拟合效果较好,可决R2为0.901~0.966,这表明其对Cd2+的吸附发生在均匀表面,近似单分子层吸附。Langnmir 方程拟合的最大吸附量随骨炭制备温度升高而增大,且KL值也呈逐渐增大趋势,表明牛骨生物炭对Cd2+亲和力逐渐增强[33]。Freundlich 模型对牛骨生物炭吸附Cd2+的拟合结果较差(R2为0.788~0.861),表明该模型不适合描述牛骨生物炭对Cd2+的吸附。根据Langnmir模型拟合结果,本研究在不同温度下制备的5 种牛骨生物炭对Cd2+最大饱和吸附量qmax(Langmuir 模型中拟合的最大单位吸附量)顺序为CBC300 表5 牛骨生物炭对Cd2+的吸附等温线拟合参数Table 5 Adsorption isotherm fitting parameters of Cd2+by bovine bone biochar 根据牛骨生物炭理化性质以及对Cd2+吸附动力学与等温吸附结果筛选出差异较大的CBC300 与CBC700 进行吸附机制分析,进一步探讨牛骨生物炭热解温度与Cd2+吸附机理的关系。 2.8.1 阳离子交换 在对牛骨生物炭进行Cd2+动力学吸附试验时,在不同时间点(5~1 440 min)对溶液进行取样,检测K+、Na+、Ca2+、Mg2+、与浓度,溶液中六种可交换离子浓度随吸附时间变化如图8 所示。在吸附Cd2+过程中,Ca2+浓度变化较K+、Na+以及Mg2+大,K+与Na+浓度仅有少量增长,表明Ca2+在与Cd2+进行离子交换过程中占主导地位。牛骨生物炭在离子交换过程中释放的Ca2+离子主要来源于羟基磷灰石,其能够将Cd2+固定: 图8 溶液中可交换离子浓度随吸附时间的变化Figure 8 Changes of the concentration of ion exchangeable cations in the solution with sorption time 而其余Ca2+与Mg2+则主要来源于络合的表面官能团(如—COOH、—R—O—M等),其与Cd2+发生配位作用形成内球表面络合物,且吸附Cd2+后溶液pH的降低(图5c)也证明了水合氢离子(H3O+)的形成[35]: 而单价阳离子K+与Na+电荷密度低、离子半径大,通常不能与表面官能团形成配位化合物,更多通过静电引力与Cd2+发生置换反应[36]。且由图8可以观察到高温热解牛骨生物炭释放的阳离子总量小于低温热解牛骨生物炭,这是由于高温下牛骨生物炭中羟基磷灰石与其他无机灰分结晶度提高,使得其转变为更稳定难溶的矿物晶体所致。比较CBC300 与CBC700 吸附开始与结束后Ca2+浓度变化量可知,CBC700 浓 度 差 为22.44 mg·L-1,CBC300 浓 度 差 为15.90 mg·L-1,表明高温热解牛骨生物炭阳离子交换作用对吸附的贡献较低温热解牛骨生物炭大,且Ca2+在阳离子交换机制中占主导地位。 2.8.2 矿物沉淀作用 有研究指出Cd2+能够与生物炭释放的阴离子如和OH-反应生成沉淀[5]。图9 分别为CBC300 和CBC700 吸附Cd2+前后红外光谱与XRD 图谱。由图9(a)可知1 520~1 350 cm-1与877 cm-1处伸缩振动峰在吸附后强度减小,峰宽变窄,峰面积减小,表明其与Cd2+生成沉淀;且原本在1 040、960、605cm-1与565 cm-1处的P—O伸缩振动峰发生偏移,峰宽变窄,但相较于碳酸盐伸缩振动峰并不明显,表明仅有少量的与Cd2+生成沉淀,反应方程式如下: 图9 CBC300和CBC700吸附Cd2+前后红外光谱与XRD图谱Figure 9 FTIR spectra and XRD of CBC300 and CBC700 before and after adsorption of Cd2+ 除此以外牛骨生物炭释放出的CO32-随时间推移水解为也能够与OH-和Cd2+结合生成沉淀。反应方程式如下: 观察图9(b)XRD 图谱可知牛骨生物炭吸附Cd2+前后峰值强度仅发生了轻微变化,尽管生成的CdCO3与Cd(3PO4)2等沉淀由于含量低而没有被检测到,但由图9 吸附前后CBC700 相较于CBC300 释放的与浓度差异量减小可知,高温牛骨生物炭中的无机矿物与Cd2+生成的沉淀较多,表明沉淀作用对高温热解牛骨生物炭吸附Cd2+贡献更大,这与前人利用美人蕉生物炭对Cd2+的吸附研究结果相似[5]。除此以外,牛骨生物炭中的羟基磷灰石在溶液中溶解产生Ca2+、(弱酸性)和(中性和碱性)也会与Cd2+发生溶解-共沉淀作用,反应方程式如下[32]: 图10(a~d)则将吸附前后牛骨生物炭表面变化更加直观地呈现出来。可以观察到300 ℃条件下热解的牛骨生物炭孔径成狭长管状,孔隙结构尚不明显,且表面散布一定程度不规则颗粒,可能是蛋白质以及其他有机物未得到充分分解而残留在骨炭表面所致。而700 ℃条件下热解的牛骨生物炭表面呈现出密集蜂窝状圆孔结构,孔结构得到充分发育,这对应于BET比表面积与孔容的增加以及孔径的减小,从而为Cd2+提供更多的吸附位点。对比吸附前后扫描电镜图可知,吸附Cd2+后骨炭表面被生成的致密细小颗粒状晶体沉淀物碳酸镉与磷酸镉等沉淀所附着,使得原本骨炭孔隙被覆盖。 图10 CBC300和CBC700吸附Cd2+前后扫描电镜(×10 000倍)Figure 10 Scanning electron microscope(SEM)of CBC300 and CBC700(×10 000 times)before and after adsorption of Cd2+ 2.8.3 表面官能团络合与π电子的配位作用 金属离子能够与电离的含氧官能团发生络合作用从而被固定,这是生物炭吸附重金属的重要机制之一[37]。由图9(a)可知,CBC300 与CBC700 在3 700~3 130 cm-1处的羟基伸缩振动峰在吸附后有一定程度的降低,且CBC300 的羟基伸缩振动峰在吸附后几乎消失,表明低温牛骨生物炭含氧官能团羟基对吸附贡献较高温牛骨生物炭大;低温牛骨生物炭中的脂肪烃(—CH2)对称伸缩振动峰由吸附前的2 930 cm-1的偏移至吸附后的2 920 cm-1,环烷烃(—CH3)非对称伸缩振动峰则由2 860 cm-1偏移至2 850 cm-1,且两者在吸附后峰强均减弱,表明这两种官能团一定程度上参与了低温牛骨生物炭对Cd2+的吸附。总的来说,参与吸附的官能团种类随着热解温度的变化而不同,低温牛骨生物炭中大量的表面官能团羟基对Cd2+参与络合的程度较高温骨炭大,且低温牛骨生物炭中脂肪烃(—CH2)与环烷烃(—CH3)也参与对Cd2+的络合作用。除上述官能团参与对Cd2+的络合以外,1 650 cm-1附近的C—C 振动吸收峰对Cd2+的吸附同样重要,其对Cd2+-π 的相互作用影响较大。由图9(a)可知,吸附Cd2+后CBC300 与CBC700 的C—C 伸缩振动峰明显变宽,这是由于Cd2+与C—C 双键中的π 键发生了配位作用。热解温度越高,牛骨生物炭形成的芳香结构越稳定,且高温下牛骨生物炭高度石墨化使得π 供体得到增强,其在吸附Cd2+过程中作为π 供体的作用就越大,因此高温牛骨生物炭π电子配位作用相较于低温牛骨生物炭对Cd2+的吸附贡献更大[38]。 禽畜骨作为肉类加工副产品,制备生物炭的成本对于其作为吸附剂去除水体中重金属污染物商业化应用至关重要。本研究牛骨生物炭的生产成本主要包括:原料收集、牛骨生物炭制备以及间接成本。以1 kg牛骨原材料为例,分析牛骨生物炭制备成本。牛骨收集于当地肉类加工厂,不计入成本费用;骨料粉碎成本:小时×单位×单位成本=0.25×1×1.1=0.28 元;骨料清洁成本:加热成本+水洗成本=小时×单位×单位成本=0.5×1×1.1=0.55 元;干燥成本:小时×单位×单位成本=6×1×0.5=3 元;热解成本=小时×单位×单位成本=2×1×4.5=9元;制备1 kg牛骨生物炭合计成本费用为12.83 元。另外,从肉制品加工厂等来源直接获取副产物动物骨骼不仅能够节省成本,而且避免了与其他废弃物混合不易分离收集等问题。在动物骨碳化过程中,其能源研究开发中的热裂解技术必然经过生物质气化与热能转化步骤,其相对独立的工艺使得其产物能量高、密度大,能耗较高,且在制备过程中如果不对裂解气加以回收处理,其排放的温室气体增温效应将大于生物质炭中所含碳之和。本研究采用的限氧控温热裂解法灭菌彻底,且热解过程中产生的CH4与H2等气体污染物也经过尾气回收系统得到有效处理,表明本研究以牛骨为原料制备的生物炭是一种绿色环保的水体重金属吸附剂。 (1)热解温度对牛骨生物炭理化性质影响显著。随着热解温度升高,牛骨生物炭产率和挥发分含量下降,灰分含量和pH值升高;比表面积与孔体积增大,孔径减小,表面形成致密蜂窝状孔洞结构,以介孔为主;官能团种类与数量减少,芳香性增强;牛骨生物质炭结晶度增加,可溶性无机组分向难溶性矿物晶体转变。 (2)准二级动力学方程能够准确描述牛骨生物质炭对Cd2+的吸附动力学过程,720 min 后基本达到吸附平衡,化学吸附控制其吸附速率;等温吸附过程更符合Langmuir吸附模型,表明吸附是发生在均质表面的单分子层吸附,热解温度越高牛骨生物质炭对Cd2+的亲和力越大,吸附量越大。 (3)牛骨生物质炭对Cd2+的吸附机制受温度影响较大。低温牛骨生物质炭吸附Cd2+的主要机制包括阳离子交换与官能团络合作用,高温牛骨生物质炭主要吸附机制包括阳离子交换、π 电子配位、矿物沉淀以及羟基磷灰石的溶解-共沉淀作用。随着热解温度升高,吸附点位增加,表面吸附作用增强,阳离子交换和π电子配位作用对吸附的贡献增加,表面官能团的络合作用减弱。Ca2+不仅在离子交换中占主导地位,而且在溶解-共沉淀作用中也起重要作用。综合考虑,700 ℃下热解制备的牛骨生物炭对Cd2+吸附性能最好,在修复含镉废水中具有较大潜力。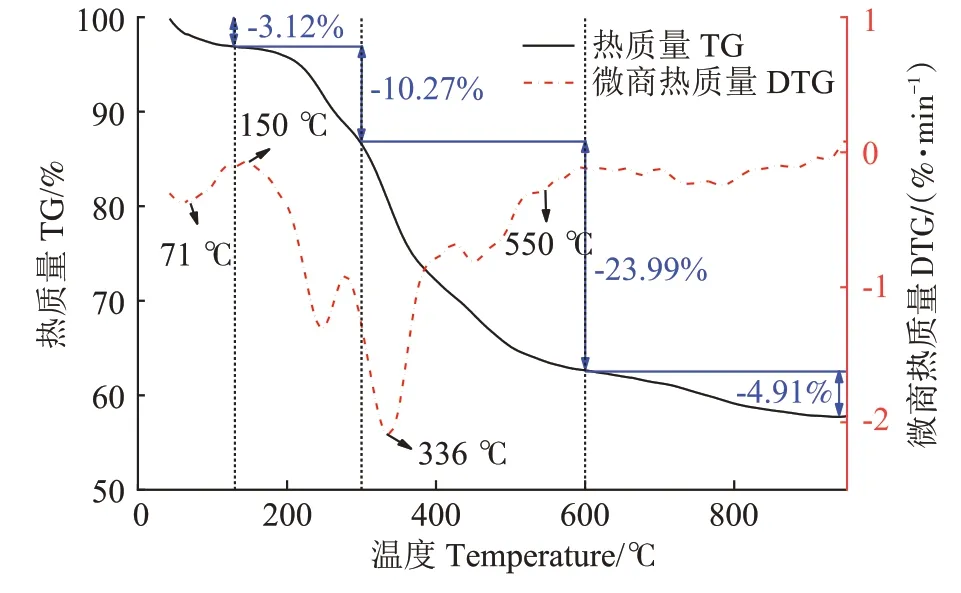
2.2 牛骨生物炭的产率
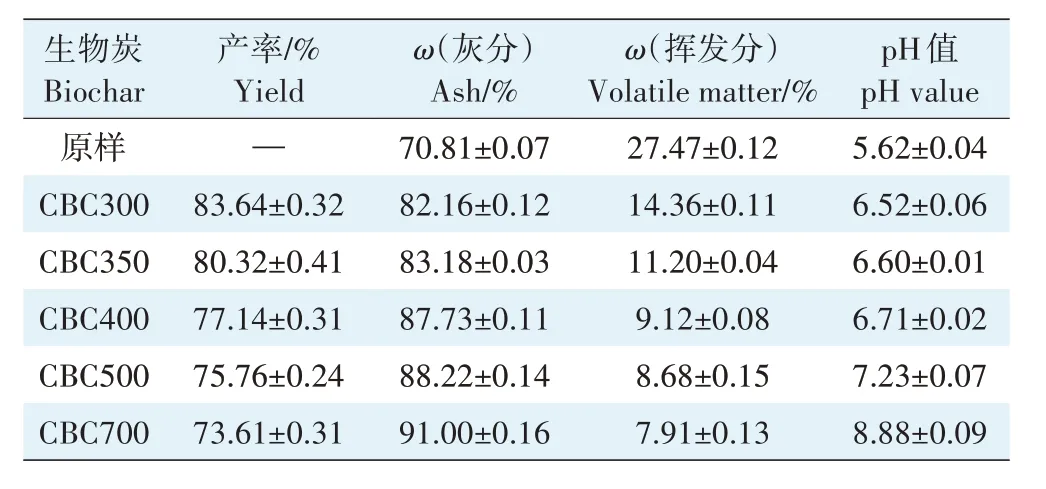
2.3 牛骨生物炭的pH、灰分及挥发分含量
2.4 牛骨生物炭比表面积与孔隙特征分析
2.5 牛骨生物炭X射线衍射分析
2.6 牛骨生物炭傅里叶变换红外光谱分析
2.7 牛骨生物炭对Cd2+的吸附特性
2.8 牛骨生物炭对Cd2+的吸附机制

2.9 动物骨源生物炭应用展望
3 结论

