小肽激素调控植物生长发育及逆境生理研究进展
胡海琳 徐黎 李晓旭 王晨璨 梅曼 丁文静 赵媛媛
(1.北京林业大学生物科学与技术学院 林木遗传育种全国重点实验室,北京 100083;2.北京林业大学生物科学与技术学院,北京 100083;3.北京林业大学树木与基因编辑研究院,北京 100083;4.北京林业大学林木育种与生态修复国家工程研究中心,北京 100083)
小肽激素是一种植物生长调节物质,即使在飞摩尔(fmol)级浓度下与特定的蛋白受体相互作用,调节细胞分裂与伸长、组织与器官分化、开花与结实、成熟与衰老等生理过程,协调植物的生长发育及响应胁迫环境[1]。随着肽组学、基因组学、转录组学、遗传学的发展,植物小肽激素的结构、分类、功能已有大量的研究。到目前为止,人们已鉴定出几十个家族的小肽激素,大多数成熟小肽激素结构简单,不具有成熟蛋白质的复杂空间结构[2]。已有的生化实验和遗传研究表明,小肽激素在植物体内以配体的形式与质膜表面相关受体激酶相互作用,进行细胞间信号转导,调控植物根、茎、叶、花、果实的发育,以及响应病虫害、干旱、盐胁迫等逆境生理[3-7]。本文就小肽激素的结构、分类、生物功能及逆境生理等方面的研究进展进行了论述,并对研究前景进行了展望。
1 小肽激素的分类及鉴定
1991年,首次在植物中报道了第一个功能性小肽激素——系统素(systemin, SYS),其成熟肽链只有18个氨基酸,在调节番茄(Lycopersicon esculentumMill.)抗虫的防御反应中具有重要的作用[8]。此后,随着研究的深入,将存在于植物体内的含量很低、调控植物生长发育的5-100个氨基酸肽段,称为小肽激素,又名“小分子信号肽”。小肽激素在不同植物中的同源基因结构域高度保守,这为研究小肽激素的功能提供了便利。本文对已报道的小肽激素的类型进行回顾与总结。
1.1 小肽激素的分类
1.1.1 根据来源分类 成熟小肽激素分子量大多数在20个氨基酸左右[9]。按来源将小肽激素划分为两大类(图1)[10]:非前体衍生肽和前体衍生肽。非前体衍生肽直接从一个小的开放阅读框(sORF)翻译而来,不需要中间前体或进一步加工。根据编码非前体衍生肽的sORF基因组位置可分为3种类型:(1)mRNA 5'端上游ORF编码的肽;(2)microRNAs初级转录本(pri-miRNAs)中sORF编码的肽;(3)其他转录本中非编码的较长蛋白质(>100 bp)中编码的肽[11-12]。

图1 小肽激素合成多样性Fig.1 Diversity of small peptide hormone synthesis
前体衍生肽由前体蛋白加工而来,这类小肽一般N端有一段信号肽,指导其进一步加工至成熟小肽。前体蛋白又可分为功能性前体和非功能性前体[10]。功能性前体的前蛋白原、蛋白原或前蛋白具有明确的生物学功能,通过蛋白水解酶活性从前体中释放出来,如大豆(Glycine max)中的Subtilase Peptide(Gm-SUBPEP)等[13-14]。非功能性前体的前蛋白原、蛋白原或前蛋白没有明确的生物学功能,大多数来源于一个较长的前体[15]。
非功能性前体根据是否富含半胱氨酸(Cys)以及特定的翻译后修饰,可以分为三类:(1)翻译后修饰肽(PTM),非功能性前体经特定修饰后获得生物活性。常见的修饰有脯氨酸(Pro)羟基化、羟脯氨酸阿拉伯糖基化和酪氨酸硫酸化(sTyr),这些修饰具有化学稳定性和不可逆性,对于维持植物体内扩散过程至关重要。例如CLE(clavata 3/embryo surrounding region)家族、CIF(casprian strip integrity factor)家族等大多数小肽均为翻译后修饰肽。迄今为止,已发现的植物翻译后修饰肽中,除PSK(phytosulfokine)家族外,脯氨酸羟基化是普遍存在的一种修饰作用;(2)富含半胱氨酸(Cys)的小肽,含有2-16个Cys残基的结构域,通过形成分子内二硫键影响小肽的三维结构和活性,如RALF(rapid alkalinization factor)小肽含有4个Cys残基;(3)非富含半胱氨酸非翻译后修饰的小肽(non-Cysrich/non-PTM),初级结构可以包含具有重要功能的氨基酸(如脯氨酸、甘氨酸、赖氨酸),主要从原蛋白中释放,参与植物的防御反应,如SYS、PEPs(plant elicitor peptides)等[2,16-17]。
1.1.2 根据N端序列分类 根据N端序列的不同,植物小肽激素可分为非分泌型小肽和分泌型小肽。非分泌型小肽在胞内调控细胞的生命活动,也可从受伤的细胞中释放到质外体直接激活植物的防御反应[18]。SYS是典型的非分泌型小肽,当植物遭受虫害时,SYS从受伤细胞释放,通过质外体途径运送到未伤害部位,激活植物的抗虫防御反应。分泌型小肽在胞内合成,通过自由扩散运输至胞外,通过韧皮部或木质部运输到其他部位发挥作用,进行细胞间的信号传导,以调控胞外相邻细胞的生命活动[19-20]。富含半胱氨酸的小肽和翻译后修饰肽均为分泌型肽[18,21],翻译后修饰肽是最常见的小肽激素类型,通过改变静电荷、亲水性以及构象来改变多肽的理化性质,进而调控与受体的特异性结合。
1.2 小肽激素的鉴定
自SYS发现以来,PSK、CLE等多种小肽参与植物生长发育和环境适应被陆续报道。传统的生化方法能够鉴定到成熟小肽及其氨基酸序列,但小肽激素在植物体内含量极低,提取时技术难度大、费时费力、成本很高,如在鉴定SYS氨基酸组成时,利用传统的生化方法和多步液相色谱分析仅从27 kg番茄提取出1 μg活性肽[22]。经典遗传学方法能够验证小肽在植物中的生物学功能[23],但对于小肽的鉴定效果并不理想,只鉴定到为数不多的小肽[2]。目前,科学家利用正向遗传筛选方法仅鉴定到CLV3(CLAVATA3)[24]、IDA(INFLORESCENCE DEFICIENT IN ABSCISSION)[25]两种小肽。因此,不论传统的生化分析,还是经典的遗传学方法,都无法实现小肽的精准鉴定及功能研究。
近几年,新型的肽组学分析技术得到发展,结合色谱、高效液相色谱和液相色谱-串联质谱连用(LC-MS/MS)等技术,一次鉴定出十几甚至上百种小肽,且能够鉴定小肽的翻译后修饰类型[26-27],大大提高了鉴定的通量,使得小肽鉴定实现了从传统的“自下而上”到“自上而下”的跳跃。2014年,Chen等[28]在植物中建立了新型肽组学技术,成功从番茄叶片中鉴定到14个新的参与防御反应的信号肽。然而,由于没有标准的小肽数据库,假阳性率较高,且无法判断其生物学活性[28]。在此基础上,科学家综合利用新型肽组学等生物信息学筛选、结合生化分析以及遗传学验证等方法,不仅克服了传统生化分析技术成本高、技术难度大等问题,而且成功避免了基因丰度低和基因冗余带来的障碍[2,23,29-30],是目前研究植物小肽的精准鉴定及功能验证的最好方法。Doblas等[23]利用比对单个前体多肽在C端附近保守结构域,通过翻译后修饰和蛋白水解过程筛选出CIF基因,利用纳米液相色谱和串联质谱分析确定了CIF的保守结构域,观察cif1 cif2双突变体发现拟南芥(Arabidopsis thaliana)根凯氏带发育不完整,外施CIF肽可弥补这一缺陷,确定CIF基因为调控凯氏带完整发育的关键因子。Ohyama等[30]根据已知分泌小肽的原蛋白结构特征,结合生物信息学及质谱分析,鉴定到CEP1(C-TERMINALLY ENCODED PEPTIDE 1)参与侧根的发育。
2 小肽激素调控植物的生长发育
小肽激素作为一种重要的信号分子,影响植物生长和发育的各个阶段,它既可以进行细胞间的短距离通信,也可进行远程信号传递。拟南芥中有超过1 000个基因编码潜在的肽激素[31],但只有极少数小肽激素的分子机制和生理功能被阐明。本文就近几年人们较为关注的几种小肽家族的结构、分子机制和生理功能进行了总结(表1)。

表1 小肽激素加工过程及功能Table 1 Processing and function of small peptide hormones
2.1 CLE家族
CLE(clavata 3/embryo surrounding region)家族是植物中最大的小肽家族之一,拟南芥中CLE家族至少有32个成员,水稻(Oryza sativa)中有83个,杨树(PopulusL.)中有50个[34,54]。CLE家族属于翻译后修饰肽,前肽经水解加工成12-14个氨基酸的保守区域,再经脯氨酸羟基化和阿拉伯糖基化修饰后,形成成熟小肽发挥作用[55-56]。拟南芥中的32个CLE基因可以翻译成27种不同的CLE,成熟CLE与受体结合,激活下游信号通路调控不同的生理活动[54]。
CLE在根、茎、维管组织、气孔中均有表达,主要参与干细胞的增殖与分化。CLE家族成员CLV3负调控茎尖分生组织中心特异表达的WUS(Wuschel)基因,形成CLV3-WUS途径,通过动态负反馈调节,维持干细胞的稳态[38];在茎尖分生组织区域表达的CLE16、CLE17、CLE27也是干细胞调控的候选因子[37]。此外,CLE家族在根尖分生组织区域中也有成员特异表达,例如CLV3能够维持根尖分生组织的分生能力[36],而CLE45与LRR-RLK(leucinerich repeat receptor-like kinase)受体家族成员BAM3(BARELY ANY MERISTEM 3)结合则抑制根初生韧皮部筛分子的分化[35];CLV3和CLE25/26/45分别结合受体CLV1和BAM1/3,维持茎尖和根尖分生组织的稳态[35-36]。
由CLE41/CLE44基因编码的导管分化抑制因子(TRACHEARY ELEMENT DIFFERENTIATION INHIBITORY FACTOR, TDIF)在韧皮部细胞中表达,运输到原形成层细胞与受体TDR/PXY(TDIF receptor/phloem inter-calated with xylem)结合,促进原形成层细胞的增殖,并抑制其分化成木质部筛管[37]。此外,近期研究发现,CLE42与CLE41/44存在功能冗余,能够通过乙烯通路负调控叶片的衰老过程[57]。拟南芥中CLE12、CLE26、CLE45等CLE家族的小肽参与不同部位的维管组织形成过程,从而调控根中木质部的发育[35,58]。CLE9/10通过与BAM1-LRR-RLKs受体结合,抑制木质部前体细胞的平周分裂[59];二者还在气孔细胞中表达,通过与LRR受体激酶HSL1(HAESA-LIKE 1)、SERK1形成三元复合物,通过脱落酸(ABA)、H2O2、NO介导的方式调控气孔关闭[39]。
2.2 PSK家族
植物磺化肽激素(phytosulfokine, PSK)是在植物中普遍存在的具有生物活性的硫酸化肽,属于翻译后修饰肽。1996年,Matsubayashi从芦笋中发现了二硫化五肽PSK-α,常说的PSK泛指PSK -α[60]。PSK-α前体的一级结构是由小基因家族编码的80-120个氨基酸,C端具有氨基酸保守序列YIYTQ,其结构保守性很差[61-62]。前体的二级结构由一级序列折叠成3个α螺旋,该结构相对保守[62]。PSK-α前体在质外体硫酸化,保守序列的两个酪氨酸侧链硫酸化可使其生物活性提高约1 000倍[63]。
拟南芥PSK受体是定位在质膜上的LRR-RLK X亚家族成员AtPSKR1和AtPSKR2,二者具有一个胞外结构域和一个C端胞内激酶结构域的跨膜蛋白,识别PSK的两个sTyr位点[64-66]。拟南芥AtPSKR1受体的激酶结构域具有自磷酸化和转磷酸化活性。在激酶亚结构域IX中有一个指定的鸟苷酸环化酶(GC)催化中心,是钙调蛋白(CaM)结合位点,具有丝氨酸/苏氨酸激酶和鸟苷酸环化酶活性,确定CAM诱导的磷酸化如何影响下游生长信号通路将是一个挑战[64,67]。
拟南芥中有5个基因编码PSK,其中AtPSK1只在根中特异表达,而其他基因在根和茎中都有表达[63,68]。PSK前体基因或PSK肽过量表达的阳性植株中,细胞壁松弛或原生质体扩张,根、下胚轴和叶片的生长速率明显加快,表明PSK在诱导细胞伸长中发挥重要作用[69-71]。除此之外,PSK信号还可促进多种发育过程,包括花粉管生长、体细胞胚胎发生、体外再生能力和豆科结瘤,并以拮抗的方式调节生物营养和坏死病原体的免疫反应[44,72-73]。
2019年,PSK-γ在大豆中被鉴定,是PSK-α的类似物,诱导胚细胞扩增,促进了营养器官和种子的生长[46]。2022年,PSK-δ及其前体蛋白在豆科植物根瘤中被发现,增加了豆科植物的根瘤菌数量,也显著促进了共生结瘤[47]。
2.3 RALFs家族
2001年,Pearce等[49]在烟草中发现能快速升高培养基pH值的快速碱化因子(rapid alkalinization factor, RALF)。RALF是植物中广泛存在的富含半胱氨酸的多肽,包含4个保守的半胱氨酸残基,形成2个二硫键指导RALFs正确折叠[49,74]。成熟RALFs N端上游是一对精氨酸残基,它不仅作为肽加工酶的切割位点,还参与协调免疫反应[75];下游YISY基序是RALFs与受体结合所必需的序列[50]。RALFs C端GASYY和C端RCRR(S)基序可能在稳定肽结构或肽之间的相互结合中发挥作用[76]。
长春花类受体激酶家族(Catharanthus roseusreceptor-like kinase 1-like, CrRLK1L)能够特异识别RALFs[77-78]。RALF1与CrRLK1L家族FER(FERRONIA)结合抑制植物侧根的发育[10],与BAK1结合抑制根生长和细胞伸长[10,79]。在中柱鞘细胞特异表达的RALF34直接与CrRLK1L家族THE1结合,从而调控侧根发育的过程[51,80]。此外,RALFs家族也参与调控植物的生殖发育过程。在花粉中特异表达的RALF4、RALF19与ANX1/2(ANXUR1/2)-BUPS1/2(Buddha's paper seal l/2)复合体相互作用,共同调控花粉管的生长和完整性;当花粉管生长至胚囊时,RALF34还与RALF4、RALF19竞争与ANX1/2-BUPS1/2复合体结合,使花粉管破裂释放精子完成双受精过程[53,81]。
2.4 CIF家族
2017年,Geldner团队与Matsubayashi团队均鉴定出参与调控凯氏带完整性的小肽激素——凯氏带完整性因子(Casprian strip integrity factor,CIF)[5,23]。迄今为止,在拟南芥基因组中共发现5个CIF基因——CIF1、CIF2、CIF3、CIF4、TWS1,都为翻译后修饰肽,且受体为LRR-RLK亚家族XI成员SGN3/GSO1(GASSHO1/SCHENGEN3)[40,82]。
成熟CIF1、CIF2的蛋白序列相似性很高,具有21个氨基酸残基,且都位于前体高度保守的C端,有一个sTyr位点和两个脯氨酸羟基化位点[5]。CIF1、CIF2的酪氨酸硫酸化位点与受体SGN3/GSO1的结合具有高度亲和力,但非硫酸化的CIF与SGN3/GSO1的结合亲和力较低[5]。SGN3/GSO1-CIF2复合物晶体结构显示完全伸展的CIF主链与SGN3/GSO1受体的LRR重复序列相互作用,使SGN3/GSO1和CIF2之间的结合更牢固,在植物体内构成受体/肽信号通路,即SGN通路[40,82]。在维管束中形成的CIF1、CIF2经TPSTs(tyrosylprotein sulfotransferase)硫酸化后转运至内皮层细胞,与SGN3/GSO1和SERK(somatic embryogenesis receptor kinase)家族蛋白受体复合物结合,然后质膜锚定激酶蛋白SGN1将受体-肽复合物的信号传递给RBOHF(respiratory burst oxidase homolog F),使细胞在质外体产生H2O2,过氧化物酶分解H2O2驱动凯氏带木质素的合成[23,82]。当凯氏带屏障完全形成后,CIF的运输受到阻滞,SGN通路被切断,木质素停止合成[23,83]。此外,SGN通路还参与调控CASP结构域建立、木栓质合成等过程[83]。
CIF3、CIF4与CIF1、CIF2的核心区域有较弱的同源性,表明CIF3、CIF4的前体两端被加工过。虽然受体SGN3/GSO1与CIF1-4具有高结合亲和力,但研究发现CIF3能被SGN3/GSO1的同源受体GSO2(GASSHO 2)特异性地识别[82]。近期,Truskina等[41]观察gso1 gso2、cif3 cif4、tpst-1突变体不同时期的花药发现,其花药黏连,进一步研究发现定位在中间层的GSO1、GSO2受体与在绒毡层表达的CIF3、CIF4是绒毡层发育及花粉壁形成过程中的关键因子。值得注意的是,CIF3、CIF4在硫酸化后能够被枯草杆菌素丝氨酸蛋白酶SBT5.4加工除去C端延伸,再扩散到中间层激活由GSO介导的信号转导[41]。
CIF家族的另一成员TWS1(TWISTED SEED 1)在胚中表达,与CIF1的核心区域序列相似性较弱,其前体通过角质层屏障,在胚乳中经ALE1肽酶直接加工C端,加工后的TWS1重新进入胚中与SGN3/GSO1和GSO2受体结合,建立了胚胎表皮形成过程中细胞间的联系[84]。目前为止,对植物体内CIF肽加工和修饰相关的报道仍相对较少,有待于进一步的深入研究。
此外,还有多种类型的植物小肽激素在调控植物生长发育方面发挥了重要作用。例如RGF(ROOT MERISTEM GROWTH FACTOR)/GLV(GOLVEN)/CLEL(CLE-LIKE),可调控维管形成层分化以及根的生长分化[29];CEP3(C-TERMINALLY ENCODED PEPTIDE 3)、CEP5(C-TERMINALLY ENCODED PEPTIDE 5)、IDA等小肽参与植物侧根的发育[85];EPF(EPIDERMAL PATTERNING FACTOR)及EPFL(EPF-Like)在调控气孔发育方面发挥重要的作用[10]。多类小肽也参与植物的生殖发育,例如SP11/SCR(S locus protein 11/S locus cysteine-rich)在花药中特异表达,与受体SRK(S locus receptor kinase)结合抑制花粉的水合过程,诱导花粉自交不亲和[86];LUREs、EALs、PCYs等对花粉的导向具有重要作用[10];ECA1s参与精卵融合过程[87];PCP-Bs(POLLEN COAT PROTEIN B-class peptides)参与花的授粉过程[88]。小肽作为植物多肽类激素,具有很好的研究潜能和广阔的应用前景。
3 小肽激素响应植物的逆境胁迫
小肽激素不仅在植物维持正常生长发育方面发挥了重要作用,还能够在逆境生理方面发挥重要的作用,本文重点对其如何调控植物的逆境生理进行了总结。
3.1 SYS参与植物的抗虫机制
系统素(SYS)是一种抑制食草性昆虫和哺乳动物消化的蛋白酶,在受伤番茄叶片提取物中发现,随后从茄科其他亚族中也分离出了SYS[8,32]。SYS是非富含半胱氨酸非翻译后修饰肽,由约200个氨基酸组成的系统素前体水解而来。系统素前体是一种本征无序蛋白,其结构灵活多变,水解后产生不同结构状态的SYS,与多种分子选择性作用,整合不同的信号通路,协调伤口/病原体信号的传导[89-90]。然而,到目前为止,有关系统素前体如何水解释放系统素的相关机理知之甚少,仍需进一步的研究[19]。
系统素前体诱导了多种信号通路,从而保护番茄免受植食性昆虫、植物病原真菌和盐胁迫等的影响[19,91]。2018年,Felix团队研究表明,SYS是一种胁迫传递信号,可被质膜上的LRR-RLK受体SYR1(SYS RECEPTOR 1)识别[92]。SYS信号途径与胞内信号耦联,如Ca2+内流、H+内流和K+外流,使质膜去极化,快速激活MAPK(mitogen-activated protein kinase)级联反应。MAPK级联反应促进了茉莉素(jasmonate, JA)合成和过氧化物酶体的活性,并在细胞质中转化为JA-Ile,JA-Ile和乙烯促进防御相关基因的表达[33,93]。此外,当叶片遭受病原体入侵或机械伤害后,SYS不仅会启动植物体内的系统防御反应,还会释放绿叶挥发物,通过空气扩散激活邻近的、未受伤害的植物的防御反应[94]。
3.2 CLE调控植物的干旱胁迫
研究发现拟南芥CLE家族27个成员能诱导NCED(NINECIS-EPOXYCAROTENOID DIOXYGENASE)酶表达,激活ABA的合成,从而调控植物应对干旱、冷或盐胁迫等逆境环境。在低浓度的CLE小肽激素处理过程中,只有CLE25可以诱导NCED3的表达。干旱胁迫条件下,CLE25在根中表达量显著升高并运至叶片,与BAM1(BARELY ANY MERISTEM 1)、BAM3(BARELY ANY MERISTEM 3)受体结合,促进了NCED3表达上调,使ABA含量升高并诱导气孔关闭,从而实现了植物对缺水环境的响应[95]。拟南芥CLE25能够从根到叶片运输是CLE肽的一种罕见的长距离转运,但并不是所有的CLE都可以长距离运输,CLV3就只能在几层细胞之间穿梭[95]。转录组数据分析显示,CLE1、CLE7、CLV3等许多CLE基因能够参与植物缺氮、缺磷、与细菌的相互作用等过程,然而,关于CLE信号通路与环境信号通路之间关系的研究仍处于起步阶段[37]。
3.3 RALFs响应植物的免疫反应、盐胁迫
经RALF23肽处理的野生型拟南芥或AtRALF23基因过表达的阳性植株,抑制了其体内的免疫应答反应[48]。因此,AtRALF23是免疫应答的负调控因子。此外,拟南芥fer突变体对病原体表现出超敏表型,深入研究发现,AtRALF23-FER可以作为一个与病原体相关的分子模式的蛋白支架,或者通过抑制茉莉素信号通路,协同调控植物的免疫反应[48,96]。此外,RALF8是拟南芥植株缺水和线虫胁迫时转录上调的基因之一,表明RALF-FER信号通路参与调控植物的先天免疫反应[75,97]。研究表明RALF1与FER受体结合,能够诱导气孔关闭,从而参与调控植物的免疫应答过程。AGB1是拟南芥基因组中唯一编码G蛋白β亚基的基因,能够与FER相互作用参与ABA介导的气孔运动[98]。fer和agb1突变体在高盐条件下气孔和根系表现出胁迫响应状态,双突变体表现出对盐胁迫更为敏感的超敏表型;当用高盐与RALF1肽同时处理植株时,也表现出超敏表型,表明RALF在气孔开放和盐胁迫逆境生理中发挥重要的作用,RALF-FER信号通路和AGB1蛋白都参与了ABA介导的盐胁迫响应过程[98]。
3.4 PSK参与植物的应激防御机制
PSK信号通路能够调控植物对坏死性病原菌的防御反应。当番茄感染灰霉病菌后,PSK与PSKR1受体结合,胞内Ca2+浓度升高,生长素信号通路激活,番茄的免疫能力显著提高[99]。幼苗中,PSK信号通路增强了病原体相关防御基因的表达,然而在成熟植物中,PSK信号通路反而将降低了防御基因表达,减弱了对植物病原细菌Pseudomonas syringaepv.tomatoDC3000和尖孢镰刀菌(Fusarium oxysporum)的响应[100]。当PSK促进防御基因(如茉莉酸依赖的防御基因)表达时,即使在没有病原体的情况下,也可以观察到其基础活性[101]。在百日草(Zinnia elagans)中叶肉细胞再分化的初始阶段,PSK能够抑制相关应激基因的表达,实现了叶肉细胞从伤害反应向发育分化的转化,表明PSK有助于在应激条件下(如创伤、离体培养或热应激)分生组织的形成和维持[102]。此外,干旱胁迫下,Phyt2(Phytaspase 2)在花梗和维管系统脱落区附近特异性表达,并对PSK前体进行加工,形成成熟的PSK,PSK诱导细胞壁水解酶在离层表达,加速花和果实的脱落[35]。Stührwohldt等[45]发现PSK1前体的表达升高后,经类枯草丝氨酸蛋白酶SBT3.8修饰,形成成熟的PSK,能够提高拟南芥的耐旱性。
此外,植物中还存在其他类型的小肽激素调控植物的逆境胁迫。水稻中富含半胱氨酸的肽DT11(DROUGHT TOLERANCE 11)过表达植株中水分流失显著减少、气孔密度增加,ABA表达量明显提高,表明DT11介导的ABA信号途径增强了水稻的耐旱性[103]。据报道,植物诱导肽PEP3与受体PEPR1(PEP Receptor 1)结合,能够提高植株的盐胁迫耐受性[104],与之不同的是,CAPE1(CAP-derived peptide 1)对植物响应盐胁迫有负调控作用[105]。此外,小肽通过与病原体的直接相互作用或与受体结合,经下游信号传导调控植物的免疫反应,CEP、DVL1(DEVIL 1)等可调控植物与细菌的共生关系[19]。
4 展望
小肽激素在植物体内广泛存在,一般为5-100个氨基酸残基的小分子肽段,其加工、肽链折叠方式、氨基酸修饰、功能等具有多样性。植物小肽激素数量多、来源及加工成熟机制复杂、生物学功能验证难度很高。随着新型肽组学等生物分析技术的飞速发展,结合分子生物学、遗传学、生化分析等方法,不仅可以有效鉴定小肽,还可以验证小肽的生物学功能。此外,亟需构建标准的植物小肽数据库,这样在鉴定到新的小肽时,仅仅通过比对数据库,就可得知小肽的结构、生物学功能等信息。
小肽激素作为一种信号分子,不仅调控植物细胞增殖、组织分化、器官形成、生殖发育、成熟与衰老等生理过程,而且响应植物应对病虫害、干旱、冷害、盐胁迫等逆境胁迫(图2)。但有关小肽的许多科学问题仍然没有被破解:某些小肽的生物学功能是什么?小肽之间是否存在功能冗余?配体-受体信号通路上下游之间存在怎样的信号传递?
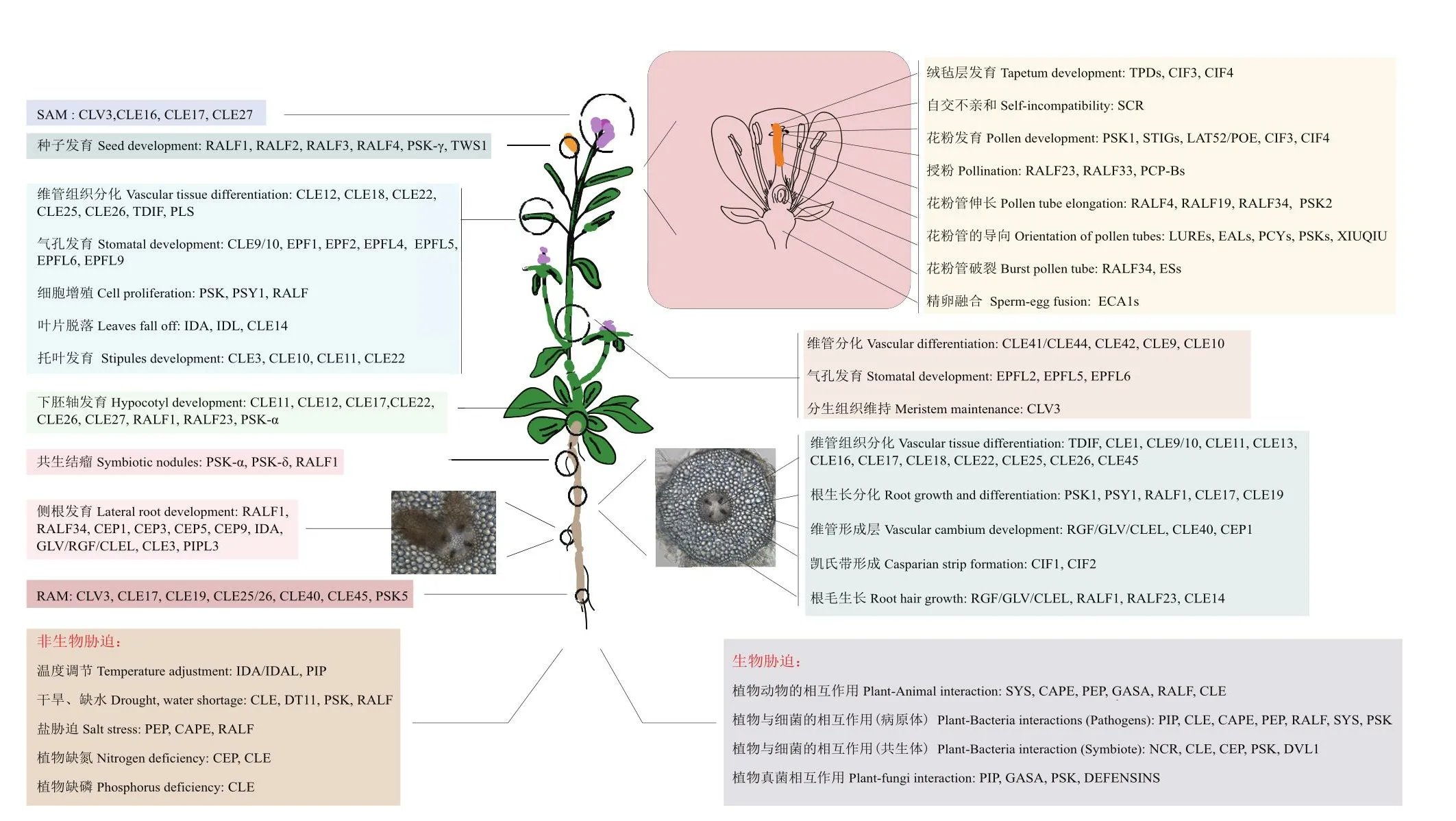
图2 植物小肽激素的生物学功能Fig.2 Biological functions of plant small peptide hormones
总之,植物小肽激素是一个新兴的、极具前景的研究领域,我们对植物肽的研究还处于初级阶段,寻求更简便、更精确、更快速的鉴定及功能验证方法是亟待解决的问题,构建标准的植物小肽数据库是一个极具挑战与发展前景的研究领域,同时也为植物小肽的研究提供了更大的契机。根据现有的研究推测,植物小肽激素在农业生产、食品工业、育种和医药领域等具有巨大的潜在应用价值[106]。相信未来植物小肽激素可实现量化生产,从而作为肥料调控植物的生长,提高植物对病虫害的免疫能力及产量,解决实际的生活生产问题,为我们提供极大的便利。