植物bHLH转录因子调控铁稳态的研究进展
李宇 李素贞 陈茹梅 卢海强
(1.河北农业大学食品科技学院,保定 071000;2.中国农业科学院生物技术研究所,北京 100081)
铁是植物生长发育所必需的微量营养元素,其作为重要的辅因子在植物体的各种重要的代谢过程中发挥作用,如光合作用、呼吸作用、荷尔蒙的合成及固氮作用等[1]。植物缺铁会带来产量和品质下降等问题,严重缺乏时甚至会导致作物绝产[2]。植物中铁过量也会对植物生长造成危害,铁在植物体内过量积累会引起铁中毒,表现为生理代谢失调、生长发育受阻。因此,植物中铁的摄取与平衡必须受到严格的控制,来满足其生长供应与需求。
铁在土壤中的含量丰富,植物可以从土壤中获得铁,但是植物从土壤中摄取铁的能力是有限的,主要原因是铁以三价铁及磷酸盐形式存在,在碱性土壤中尤为明显。植物应答缺铁条件形成了两种铁的吸收机制:机制I和机制Ⅱ[3-4]。机制I和机制Ⅱ的主要区别是机制I吸收Fe2+,而机制Ⅱ是以螯合的策略吸收Fe3+。双子叶植物及非禾本科单子叶植物利用机制I吸收铁,禾本科植物利用机制Ⅱ吸收铁[5]。机制I植物吸收铁的主要过程:植物先向根际分泌酚类物质或氢离子来酸化土壤增加铁的溶解性[6],随后铁还原酶FRO(Fe3+-chelate reductase)基因将Fe3+还原为Fe2+,最后通过Fe2+转运蛋白IRT1/IRT2(iron-regulated transporter)[7]将其转运至植物体内细胞以满足植物生长发育需要[8]。机制Ⅱ是基于螯合策略,首先在植物根细胞中经过一系列反应合成麦根酸类物质PS(phytosiderophores),麦根酸转运蛋白TOM1(transporter of mugineic acid family phytosiderophores 1)将PS转运至根际,与土壤中的Fe3+螯合形成Fe3+-PS复合物,黄色条纹蛋白YSL(yellow stripe)将Fe3+-PS螯合物转运至细胞内[9]。两种机制均由复杂的转录调控网络精准调控,这些调控网络由多种转录因子组成,其中碱性螺旋-环-螺旋bHLH(basic halix-loop-halix)家族的成员发挥着至关重要的作用[10]。
本文以依赖两种不同铁吸收策略调控体内铁稳态的拟南芥和水稻为例,对二者中的相关bHLH转录因子在调控铁稳态作用中的最新研究进展进行总结、讨论,以期能够提高我们对植物控制铁元素动态平衡这一复杂机制的理解。
1 bHLH转录因子的结构特征
bHLH家族是植物中较大的转录因子家族之一,亚族丰富[11],拟南芥、水稻中的所有bHLH家族成员可分为32个亚族,其中拟南芥中包含的bHLH家族成员有162个,水稻中包含167个[12]。
bHLH蛋白是一个真核转录因子家族,调节与细胞分化和发育有关的一系列基因的表达[13]。bHLH家族以其高度保守的碱性/螺旋-环-螺旋结构域命名,bHLH结构域由大约60个氨基酸残基组成,分为两个区域,一个是碱性区,通常由13-17个氨基酸组成,位于氨基酸序列的N端,负责二聚化和参与DNA与E-box序列的结合[14];另一个是由近40个氨基酸组成的HLH区域,位于氨基酸序列的C端,由两个含有疏水残基的α螺旋组成(图1),需要二聚化来调控参与各种信号通路的靶基因的表达[15-16]。对bHLH转录因子结构特征的了解能帮助我们更好地理解bHLH转录因子调控铁缺乏基因的表达机理。
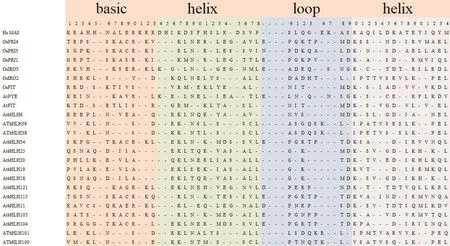
图1 铁调控网络主要蛋白bHLH结构域Fig.1 Alignment of the bHLH domain of iron-regulated network main proteins
2 植物中调节铁稳态的相关bHLH转录因子研究现状
2.1 拟南芥中调节铁稳态的bHLH家族
2.1.1 机制I的BTS感受器通路 拟南芥是典型的模式植物之一,利用机制I吸收铁,并且bHLH家族成员在拟南芥中研究得比较多,尤其是参与缺铁胁迫应答的bHLH转录因子。到目前为止,在拟南芥中已发现有属于6个亚族的17个bHLH转录因子参与铁的平衡调节[17-18],在应对缺铁胁迫时,同一亚族的转录因子往往发挥着相似的功能。
拟南芥缺铁反应调控网络的上游是E3连接酶基因BTS(brutus),BTS受缺铁强烈诱导,是一种潜在的铁传感器,对铁离子高度敏感,其能与铁结合并且具有泛素化转录因子的功能[19]。在拟南芥以及其他一些双子叶植物中,还存在着两个与BTS部分功能冗余的E3泛素连接酶,BTSL1(Brutus-like 1)和BTSL2,C末端结构域具有E3连接酶活性,在拟南芥体内能促进类缺铁所诱导转录因子AtbHLH29/FIT(fer-like Fe deficiency-induced transcription factor)的降解。BTSL1和BTSL2之间也存在相互协同调节,但不与BTS之间关联[20]。BTS缺铁响应转录调控,与参与铁信号传导的bHLH转录因子家族IVc亚族的4个转录因子bHLH34、bHLH104、bHLH105/ILR3(iaa leucine resistant 3)和bHLH115直接相互作用,靶向IVc亚族转录因子在富铁植物中降解,负向调节铁的吸收,这对于防止过量铁摄取至关重要[21]。
在对IVc亚族转录因子的功能进行研究时发现,在根中缺铁时,除了ILR3,AtbHLH115、AtbHLH104和AtbHLH34也都被证明是铁吸收的正调控因子,而ILR3和bHLH104是最关键的IVc转录因子亚族,相比较来说,bHLH115起到的作用较小,bHLH34似乎不参与地上部缺铁反应[22]。bhlh115表现出对缺铁的敏感性,而bHLH115的过表达促进了铁的积累,这表明bHLH115正向调控铁缺乏反应基因的表达[23]。bHLH104/105或bHLH34/105的同源或异源二聚体发挥着非冗余调节铁稳态的作用,直接参与bHLH47/PYE(popeye)的调控[24]。bHLH34和bHLH104功能缺失的突变体中发生铁缺乏反应的中断和植物体内铁含量减少的情况,而过表达植物则促进了铁缺乏反应相关基因的表达以及增加了植株铁的积累量[23]。Li等[12]进一步分析表明,每一个IVc亚族bHLH转录因子成员都可以直接激活下游Ib亚族基因bHLH38/39/100/101和PYE的转录,它们拥有相似的功能。亚细胞定位结果表明bHLH IVc亚族转录因子与bHLH121/URI(upstream regulator of IRT1)相互作用,并能够促进其在细胞核的积累,共同激活Ib亚族基因转录[25-26]。
研究发现bHLH121功能缺失突变会导致拟南芥严重的铁缺乏症状,减少拟南芥体内铁的积累量,并扰乱与铁稳态相关基因的表达。过表达FIT有助于提高bhlh121的存活率。而且bHLH121具有DNA结合活性,可以与FIT和bHLH Ib基因的启动子结合,但未发现它对这些基因具有直接的转录激活或抑制活性。bHLH121在bHLH IVc转录因子下游发挥作用,是bHLH IVc转录因子的直接靶点,其表达受缺铁诱导,且依赖于bHLH IVc[17]。这些结果均表明,bHLH121与bHLH IVc转录因子一起正向调节FIT的表达,在维持拟南芥中铁的动态平衡中发挥关键作用。
遗传分析表明,FIT是bHLH121的下游靶基因,属于IIIa亚族,是拟南芥缺铁调控网络的中心转录因子[27]。FIT在根表皮受缺铁诱导表达,fit表现出黄化表型,缺铁时fit幼苗无法存活,约一半的缺铁诱导基因在其根中表达下调,而铁吸收关键基因FRO2和铁调节转运蛋白IRT1(iron-regulated transporter 1)的表达量显著降低[28],这说明FIT对于拟南芥缺铁应答的调节是必需的。
在酵母细胞中表达FIT与Ib亚族的bHLH38/39/100/101中的任何一个可激活FRO2和IRT1启动子驱动的GUS表达[29],这表明FIT能与bHLH38/39/100/101中的任何一个形成异源二聚体直接调控FRO2和IRT1的表达来促进二价铁的吸收。而进一步的分析表明,FRO2和IRT1在转录水平上不受调控,因为在缺铁条件下FIT过表达植株中都检测到了IRT1蛋白的积累和较高的FRO2的活性。与野生型相比过表达FIT和AtbHLH38/AtbHLH39的植株在地上部积累了更多的铁[30]。以上这些结果表明FIT与Ib亚族的bHLH38/39/100/101互作形成异源二聚体来正调控下游的FRO2和IRT1,以促进拟南芥等机制I植物吸收铁。在拟南芥中的突变研究表明,Ib bHLH转录因子亚族的成员bHLH100和bHLH101在功能上是冗余的,但它们可能通过激活不同的下游基因来调节铁缺乏的反应[15],bHLH38和bHLH39也是这样[16],bHLH38/39与bHLH100/101之间尽管非常相似,但是它们之间仍存在着非冗余的功能。
PYE是根中柱鞘细胞中发挥重要作用的缺铁响应负调控因子。Long等[31]对PYE的功能分析表明,在缺铁条件下,PYE对植物生长发育具有正向调节作用。染色质免疫共沉淀实验发现PYE能够通过直接结合到烟酰胺合成酶NAS4(nicotianamine synthase 4)、FRO3、锌诱导的促进因子ZIF1(zincinduced facilitator 1)的启动子上,并下调其表达。PYE与bHLH104/105/115互作,下调铁稳态相关基因。通过CHIP-PCR实验验证,bHLH115直接激活bHLH38/39/100/101和PYE的转录,这表明bHLH34、AtbHLH104、bHLH105和bHLH115均参与了PYE调控网络,在拟南芥铁稳态的维持中起着关键作用。
bHLH11也是调节铁稳态的负调控因子,定位于细胞质和细胞核,随着铁缺乏的增加而表达量降低。共表达分析表明,IVc亚族bHLH转录因子促进了bHLH11的核积累。进一步分析表明,bHLH11抑制了IVc亚族bHLH转录因子对Ib亚族基因(bHLH38、bHLH39、bHLH100和bHLH101)的调控。bHLH11还作为FIT的负调控因子,抑制FIT在拟南芥中的表达[32]。这些结论表明bHLH11可以使植物避免铁摄取过量而导致的铁中毒问题。
2.1.2 机制I的植物激素信号通路 FIT作为拟南芥中响应缺铁胁迫网络中最为关键的转录因子,参与多种响应缺铁信号通路的调节,是这些信号的调节中心。在调控铁吸收过程中,大部分的FIT是以非活性的形式存在,只有小部分FIT被磷酸化,感知环境中铁的增加[33]。在缺铁条件下,植物体内的Ca2+浓度增加,作为第二信使被类钙调神经磷酸酶b亚基蛋白CBL1(calcineurin-B-like Ca2+sensor protein 11)或CBL9检测到,激活Ca2+诱导的丝氨酸蛋白激酶CIPK11(cbl-interacting protein kinase 11)将FIT-C端的Ser272处磷酸化,激活大量的FIT,并且这一位点的磷酸化会促进FIT和Ib异源二聚体的形成,激活下游缺铁响应基因。FIT还存在另一种磷酸化,就是在Tyr237和Tyr238的磷酸化,会对FIT活性产生负面影响,导致FIT向细胞核的迁移率降低,与bHLH39的相互作用减少,这也是一个调节FIT活性的方式[34]。
在拟南芥中,存在茉莉酸JA(jasmonic acid)对缺铁胁迫的多重抑制。JA信号通路已知的主要调控因子是IIIe亚族的bHLH转录因子的bHLH6/MYC2(myelocytomatosis proteins)。在JA存在的情况下,MYC2导致IVa亚族bHLH转录因子(bHLH18、bHLH19、bHLH20和bHLH25)的表达上调[35]。这4个功能相似的转录因子主要在根中表达,并且都与FIT相互作用,调节FIT蛋白的积累。目前的相关研究还未提出FIT与IVa亚族的这4个转录因子形成的异源二聚体在植物铁缺乏调控网络中的下游靶基因是哪些,仅指出了FIT与IVa亚族的bHLH转录因子相互作用会导致FIT的26s蛋白酶体降解,而FIT与Ib亚族的bHLH转录因子的相互作用则会促进FIT的稳定性,这就使得IVa亚族bHLH转录因子和Ib亚族的转录因子在与FIT的结合之间存在着一种竞争关系,前者促进FIT降解,而后者促进FIT的稳定性。
赤霉素GA(gibberellin)是另外一类植物生长激素,已被证实在铁缺乏反应中发挥作用[36]。研究发现,在缺铁条件下,使用GA4处理后的赤霉素缺失突变体,其IRT1、FRO2、bHLH038和bHLH39(后两者控制IRT1和FRO2表达)的表达量显著提高,但是FIT的表达不受GA4诱导。这表明GA在缺铁条件下对铁吸收相关基因的诱导是依赖FIT的。GA信号通过DELLA蛋白参与缺铁反应,酵母双杂交、荧光共振能量转移成像(FRET-FLIM)和免疫共沉淀(Co-IP)分析表明,GA信号的DELLA阻遏蛋白可以与FIT、bHLH38和bHLH39蛋白形成异二聚体。FRET-FLIM和EMSA结果显示,DELLA-FIT异源二聚体并不阻止FIT和Ib亚族 bHLH转录因子形成异源二聚体,而是通过阻止FIT和Ib亚族 bHLH转录因子的异源二聚体与其靶基因启动子的结合来抑制FIT的转录活性。对绿色荧光蛋白幼苗的芯片分析表明,在缺铁条件下,在DELLA蛋白存在的情况下,FIT与其目标基因启动子的相互作用减少[37]。在缺铁条件下,DELLA蛋白在根分生组织中积累,最终使FIT与Ib亚族bHLH转录因子异源二聚体的形成以及激活铁摄取基因。
EIN3(ethylene insensitive 3)和EIL1(EIN3-like 1)是两个通过乙烯信号通路激活的转录因子[38]。二者均可以和FIT相互作用,促进FIT的稳定性,从而增加铁摄取基因的表达。乙烯信号通路的EIN3或是EIL1并不影响FIT和Ib亚族bHLH转录因子形成二聚体对下游基因进行调控,二者均可以抑制FIT被蛋白酶体降解,通过促进FIT的稳定性来增强铁的获取[39]。MED16(mediator subunit 16)是中介体复合物的一个亚单位,连接异源二聚体的RNA聚合酶II(Pol II)复合体, 提高FIT/ Ib bHLH二聚体与FRO2和IRT1启动子结合的稳定性,向RNA聚合酶2传输信号,激活FRO2和 IRT1表达[40]。MED16与另一个亚基MED25(mediator subunit 25)相互作用,MED25通过与EIN3和EIL1的相互作用,在铁稳态调控中发挥重要作用[41]。
关于机制I植物中的bHLH转录因子网络研究得相对比较清楚,不论是缺铁情况下还是生长在富铁的肥沃土壤中,植物中都有相应功能的转录因子来发挥作用,这些bHLH转录因子形成一张复杂的网络(图2),精准地调控铁的吸收和运输,使植物体内的铁积累量始终维持在一个较为稳定的状态,为植物的正常生长发育保驾护航。

图2 拟南芥中铁稳态调控Fig.2 Fe homeostasis regulation in Arabidopsis

图3 拟南芥和水稻中调控铁稳态的bHLH转录因子进化树Fig.3 Phylogenetic tree of bHLH TFs regulating Fe homeostasis in Arabidopsis and rice(Oryza sativa)
2.2 水稻中调节铁稳态的bHLH家族转录因子
水稻由于其生长条件可以是淹水,也可以土培,所以是铁吸收完整的机制Ⅱ与部分机制I同时存在[42],bHLH转录因子网络调控水稻机制Ⅱ铁的吸收及机制I与机制Ⅱ铁的运输。与拟南芥相比,水稻中现已被研究的铁运输调控相关bHLH家族的转录因子较少,但水稻中的bHLH家族转录因子大多与拟南芥中的为同源基因,处在同样的亚族位置(图3),在水稻中发挥着与拟南芥中相似的功能。
OsHRZ1(hemerythrin motif-containing really interesting new gene and zinc-finger protein 1)与拟南芥中的BTS同源,类似地,OsHRZ1通过26S蛋白酶途径靶向OsPRI1(positive regulator of iron homeostasis 1)[43]。hrz1相比野生型对照对铁缺乏的耐受性更强,Western Blot免疫印迹结果显示,随着OsHRZ1-GFP含量的增加,OsPRI1蛋白丰度降低,这些结果表明了OsHRZ1在铁充足的条件下通过泛素化OsPRI1负向调节铁的稳态[44]。比较分析表明,OsPRI1的氨基酸序列与IVc亚族的AtbHLH34/104/105/115相似,与AtbHLH34/104/105/115正调控AtbHLH38/39/100/101一样,OsPRI1直接上调OsIRO2的表达进而激活铁吸收相关基因的表达[45]。OsPRI2和OsPRI3是OsPRI1的两个同源基因,已被鉴定与OsPRI1功能类似,这两个转录因子也与OsHRZ1直接相互作用,且OsHRZ1促进了OsPRI2和OsPRI3的降解[20]。CHIP-qPCR实验与EMSA实验结果分析表明OsPRI2和OsPRI3也可以与OsIRO2(iron-related transcription factor 2)和OsIRO3的启动子结合。因此,OsPRI1/2/3相似且具有相同的功能。
OsIRO3是属于bHLH IVb亚族的转录因子,与AtPYE同源,受OsPRI1/2/3正调控。OsIRO3在根、叶和基节中表达,营养生长期叶片中表达水平较高。OsIRO3基因敲除导致植株对缺铁敏感,幼叶严重坏死,根发育不良,这些证据表明OsIRO3在响应水稻缺铁上是必不可少的[46]。在缺铁条件下,iro3在地上部积累了较高水平的铁,这与上调OsNAS3的表达有关,从而导致尼克酰胺NA(nicotianamine)在根中的积累增加。双荧光素酶实验表明,OsIRO3可以直接与OsNAS3启动子中的E-box结合。此外,在铁充足的条件下,铁相关运输基因的表达显著上调。因此,OsIRO3在响应缺铁的过程中起着关键作用,并且直接负向调节OsNAS3的表达[46]。同属于IVb亚族的bHLH转录因子OsbHLH061,与两个已知的铁调节因子有很高的序列相似性:与水稻中的OsIRO3有43%的相似性和拟南芥中的AtPYE有49%的相似性。在缺铁条件下,OsbHLH061基因敲除导致地上部铁的过度积累和对铁毒害的敏感,而酵母双杂交实验证明OsPRI1和OsbHLH061互作[47],表明OsbHLH061是在铁充足时与OsPRI1互作共同下调OsIRO3的表达,负向控制铁向地上部的运转和在水稻中的积累,维持铁稳态。
OsIRO2是属于bHLH家族Ib亚族的转录因子,负责调节水稻中铁稳态相关基因,是OsPRI1的另一个靶基因。OsIRO2在根和叶中表达,在缺铁条件下,OsIRO2在营养组织中的表达仅限于根和叶。OsIRO2过表达植株地上部的铁积累量是普通水稻的2-4倍,这表明OsIRO2是调节铁稳态的相关基因[48]。基因芯片分析表明,OsIRO2在根中调控59个缺铁诱导基因,如OsNAS1、OsNAS2,烟酰胺氨基转移酶OsNAAT1(nicotianamine aminotransferase 1),脱氧麦根酸OsDMAS1(rice synthesizes the Fe chelator 2'-deoxymugineic acid 1),OsYSL15和TOM1都受到OsIRO2的正调控[49]。而OsIRO3直接调控OsIRO2的表达。酵母双杂交试验表明,OsIRO3与OsPRI1和OsPRI2相互作用,已经证实OsPRI1/2/3通过直接与OsIRO2启动子结合并激活其启动子来正向调节OsIRO2的表达[35],而OsIRO3与OsPRI1和OsPRI2相互作用抑制了OsPRI1/2对OsIRO2的转录激活。因此,OsIRO3通过抑制OsIRO2的表达负调节铁的动态平衡[50]。
通过RNA-seq分析鉴定出的OsbHLH156与拟南芥中的FIT同源,是bHLH家族IIIa亚族的转录因子,主要在根部表达且受缺铁诱导。转录激活实验证明OsbHLH156具有转录激活能力。GUS染色结果显示OsbHLH156的表达模式与OsIRO2相似,主要在根成熟区的上皮、外皮层、皮层、内皮层及中柱表达。OsIRO2定位在细胞质,OsbHLH156定位在细胞核,当OsIRO2与OsbHLH156共表达时,两蛋白均定位于细胞核。BIFC和免疫共沉淀实验结果显示OsbHLH156与OsIRO2相互作用。在提供三价铁条件下,OsbHLH156基因敲除突变体在缺铁条件下生长时叶绿素含量比野生型植株降低了55%,降低了地上部的铁积累量[51],这一结果证明在缺铁条件下OsbHLH156和OsIRO2对于激活机制Ⅱ中铁的吸收及运输是必不可少的,二者共同正向调控水稻中三价铁的吸收与运输。
虽然水稻和拟南芥采用不同的铁吸收策略,但是关键的转录因子,无论是水稻中的OsbHLH156还是拟南芥中的FIT,都通过与bHLH 家族Ib亚族转录因子形成异源二聚体来调节缺铁反应。OsbHLH156是促进OsIRO2核定位所必需的,这一现象最近也被证明在拟南芥中发生,其中AtbHLH39的核定位需要FIT[52]。这说明,这两种铁的吸收策略本质上并没有太大的不同(图4)。

图4 水稻中铁稳态机制Fig.4 Fe homeostasis mechanism in rice
2.3 其他植物铁稳态bHLH家族
番茄是机制I植物,铁吸收及运输模式与拟南芥相似。FER就是最先从番茄中分离得到的参与高等植物铁稳态的转录因子,和拟南芥的FIT同源,在根表皮和外层皮层细胞层中都有表达[53]。FER激活铁转运蛋白LeIRT1的表达,调控铁稳态[54]。SlbHLH068是策略I机制中另一个bHLH家族的成员,表达模式与FER的表达模式具有一定的相似性,在缺铁条件下表达量显著上调,但不受其他营养水平的影响。这表明,SlbHLH068在番茄体内的铁稳态中起特异性作用。通过系统发育分析,SlbHLH066/067/068与拟南芥中AtbHLH38/AtbHLH39/AtbHLH100高度同源,功能也相近。酵母双杂交和转录激活实验结果显示,SlbHLH068与FER形成异源二聚体激活了酵母细胞中由LeFRO1启动子驱动的GUS表达[55]。这些结果表明FER/SlbHLH068异二聚体可以直接结合并激活LeFRO1的表达以促进铁的吸收。
木本植物苹果也是采取策略I吸收铁,MdbHLH104被鉴定为苹果中应对缺铁反应的关键转录因子,序列与OsPRI1相似。MdbHLH104基因的过表达显著提高了转基因苹果植株和愈伤组织在缺铁条件下的H+-ATPase活性和对铁缺乏的耐受性[56]。Wang等[47]的研究表明,MdHLH104蛋白直接与MdAHA8基因的启动子结合正向激活其表达,以及质膜H+ATPase活性和铁的吸收。类似地,MdbHLH104直接调控了3个铁敏感的bHLH基因的表达,即MdbHLH38、MdbHLH39和MdPYE。此外,酵母双杂交实验和pull-down实验结果表明MdBHLH104还与MdbHLH105、MdbHLH115、MdPYE、MdbHLH11和MdbHLH121相互作用,共同调节MdAHA8基因的表达、质膜H+-ATPase活性和苹果愈伤组织中铁的含量。因此,MdbHLH104是苹果中铁动态平衡的正调控因子,与其他苹果bHLH家族一起通过调控MdAHA8基因的表达和质膜H+-ATPase的活性来调节苹果对铁的吸收。
从木本植物小金海棠中分离到3个bHLH基因:MxbHLH01、MxIRO2和MxFIT,并对其进行了鉴定,MxbHLH01的表达仅限于根,在缺铁条件下表达上调,MxbHLH01可能与其他蛋白质相互作用来调节基因对缺铁的响应[57]。在缺铁条件下,MxIRO2在小金海棠的根和叶中均被诱导[58]。它可能与其他转录因子形成异二聚体或多聚体,以控制与铁吸收相关的基因的表达。目前有关果树应对缺铁胁迫的研究较少,还需要进一步挖掘果树铁吸收及运输调控机制。
3 总结与展望
目前bHLH转录因子是已知的在高等生物的代谢、生理和生长发育过程中发挥着重要作用的最大的转录因子家族[59]。从在番茄中分离出并鉴定FER[60]开始,人们就从未停止过对bHLH转录因子家族的探索与研究,尤其是bHLH转录因子家族应对缺铁胁迫的调控机制方面。随着各种生物技术手段越来越完善、相关研究越来越多,我们对bHLH家族成员是如何调控铁吸收及运输的机理也越发清晰明了。通过对bHLH在植物各组织基因表达的检测、目的基因在细胞中的定位情况以及其他一些体外蛋白质实验的研究,在缺铁条件下利用两种机制调控铁平衡的相关过程已经相对清晰地展现在了我们的眼前,然而我们现在仍然不知道这个网络最上游的转录因子的表达是如何调节的,以及同亚族相似但非冗余的bHLH转录因子各自具体的功能也还未被研究,这表明我们仍然没有把这个铁调控网络完全地探索清楚。我们离完全了解bHLH转录因子调控铁稳态机理还有很长一段距离,还需要在探究真相的道路上继续前行。