响应面法优化地参多糖大孔树酯脱色工艺及其抗氧化活性研究
李自霖 黄丽金 陈贵元 李雪英

摘要 目的:考察大孔樹酯用量、脱色温度和脱色时间对地参多糖的脱色率和保留率的影响。方法:在单因素试验的基础上,以多糖脱色率和保留率2个指标的综合评分作为响应值,响应面法优化大孔树酯脱除地参多糖色素的工艺,并探究地参多糖的抗氧化活性。结果:地参多糖大孔树酯最佳脱色工艺为质量浓度6 mg/mL的地参多糖溶液100 mL,添加充分溶胀的大孔树酯3 g,脱色温度45 ℃、脱色3 h、脱色1次。在此条件下,多糖脱色率为82.64%,多糖保留率为72.06%,综合评分82.15,与理论综合评分(83.34)的相对误差为1.43%。当地参多糖质量浓度为0.5 mg/mL时,对ABTS自由基的清除率达到44.28%。结论:响应面试验优化得到的地参多糖大孔树酯脱色工艺稳定可行,地参多糖具有较好的抗氧化活性,可作为天然抗氧化剂开发利用。
关键词 地参多糖;响应面法;脱色工艺; 抗氧化活性
中图分类号 TS201.1文献标识码 A
文章编号 1007-7731(2023)14-0049-07
Optimization of macroporous tree esters decolorization process of Lycopus lucidus
Turcz polysaccharides by response surface method and its antioxidant activity
LI Ziling1 HUANG Lijin1 CHEN Guiyuan1 LI Xueying1, 2*
(1School of Basic Medicine, Dali University, Dali 671000, China;
2College of Agronomy and Biological Sciences, Dali University, Dali 671003, China)
Abstract Objective: Investigate the effects of macroporous resin dosage, decolorization temperature, and decolorization time on the decolorization rate and polysaccharide retention rate of Lycopus lucidus Turcz polysaccharides. Mothod: On the basis of a single factor experiment, the comprehensive scores of decolorization rate and polysaccharide retention rate were used as response values. The response surface methodology was used to optimize the process of removing Lycopus lucidus Turcz polysaccharide pigments with macroporous resin and explore the antioxidant activity of Lycopus lucidus Turcz polysaccharides. Results: The optimal decolorization process for macroporous tree ester of Lycopus lucidus Turcz polysaccharides was as follows: 100 mL of Lycopus lucidus Turcz polysaccharide solution with a mass concentration of 6 mg/mL, 3 g of fully swollen macroporous tree ester added, decolorization temperature 45 ℃, decolorization for 3 hours, and decolorization once. Under these conditions, the decolorization rate of polysaccharides is 82.64%, the retention rate of polysaccharides is 72.06%, and the comprehensive score is 82.15. The relative error with the theoretical comprehensive score (83.34) is 1.43%. When the mass concentration of local Lycopus lucidus Turcz polysaccharides is 0.5 mg/mL, the clearance rate of ABTS free radicals reaches 44.28%. Conclusion: The decolorization process of macroporous tree esters of Lycopus lucidus Turcz polysaccharides optimized by response surface methodology is stable and feasible, and Lycopus lucidus Turcz polysaccharides have good antioxidant activity and can be developed and utilized as natural antioxidants.
Keywords Lycopus lucidus Turcz polysaccharides; response surface method; decolorization technology; antioxidant activity
地参(Lycopus lucidus Turcz)为唇形科地笋属草本植物,主产于云南西北部的丽江和大理地区,其地下部分的根茎即为地参,又名地蚕子。地参富含黄酮、多糖、多酚等多种活性成分,是民间药食同源中草药[1]。《中国药典》记载,地参具有益气生津、活血通经之功效,常用于治疗瘀血肿痛、心烦热渴等症[1]。已有研究报道,作为地参的主要活性成分之一的地参多糖具有抗肿瘤、抗氧化、抗炎症、免疫调节、降血糖等多种活性[2-5]。
目前,地参多糖的提取已有相关报道[6],在提取多糖的同时,常会将色素也提取出来混在多糖中[7],色素物质的存在会对多糖的纯化、生物活性以及多糖结构分析等方面的研究造成影响[8],因此对多糖进行脱色处理尤为重要。目前,多糖脱色的主要方法有过氧化氢法[9]、活性炭法[8]和大孔树酯脱色法[10]。过氧化氢法是通过H2O2的强氧性氧化多糖中的色素,从而起到脱色作用。由于多糖分子中含有醛基、羟基易被H2O2氧化,从而导致多糖结构被破坏,进而影响多糖的活性[9]。活性炭法和大孔树酯法都是通过吸附作用去除多糖中的色素。活性炭孔径较小,对分子量较大的色素物质吸附困难,且脱色耗时长。大孔树酯吸附作用强,且不会造成多糖结构破坏,再生后可反复使用,是目前多糖脱色最常用的方法之一[9, 10]。为此,本研究采用大孔树酯脱除地参多糖色素,响应面法优化脱色工艺,并探究地参多糖对ABTS自由基的清除作用,旨在为地参多糖的结构分析以及开发利用提供参考。
1 材料与方法
1.1 材料与试剂
地参干料,购于大理剑川县药材批发市场。FL-1大孔树酯,购自天津市欧瑞生物科技有限公司;2,2'-联氮二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购于日本东京化成工业株式会社;抗坏血酸(VC),购自上海皓鸿生物医药科技有限公司;其余试剂均为国产分析纯(AR)。
1.2 仪器与设备
UV-8000型紫外分光光度仪(上海元析仪器有限公司);FD-1型冷冻干燥机(北京博医康技术公司);RE-3000型旋转蒸发器(上海亚荣生化仪器厂);SHA-C型恒温水浴锅(金坛市杰瑞尔电器有限公司);BT-224S型电子天平(赛多利斯(北京)仪器有限公司);B600型低速离心机(上海医用分析仪器厂)。
1.3 试验方法
1.3.1 多糖提取 参照文献[6]的方法提取地参多糖,多糖提取液置旋转蒸发器中减压浓缩至适当体积,Sevage法脱蛋白,终浓度80%(体积分数)的乙醇沉淀8 h,多糖沉淀物依次用无水乙醇、丙酮、乙醚各洗涤1次,收集沉淀,真空冷冻干燥至恒重,得地参多糖。
1.3.2 FL-1大孔树酯的预处理 参照文献[11]的方法处理大孔树酯,用超纯水冲洗大孔树酯3次,去弃漂浮的杂质,4 000 r/min离心10 min,收集树酯,95%乙醇浸泡树酯24 h,使其充分溶胀。4 000 r/min离心10 min收集树酯,依次用0.1 mol/L的NaOH溶液、0.1 mol/L的HCL溶液各洗涤树酯1次,超纯水洗涤树酯至pH呈中性后备用。
1.3.3 葡萄糖标准曲线的制作 参考文献[12]的方法制作葡萄糖标准曲线,以葡萄糖的质量浓度(mg/mL)为X轴,葡萄糖溶液的吸光度(A)为Y轴,绘制标准曲线,得到回归方程为:Y=0.005 1X+0.024 3,R2=0.998 3,表明在0~0.06 mg/mL的葡萄糖质量浓度范围内与吸光度呈良好的线性关系。
1.3.4 地参多糖脱色率测定 精密称取0.6 g地参多糖,超纯水定溶至100 mL。多糖溶液经紫外分光光度计全波长扫描,发现在330 nm波长处,地参多糖溶液具有最大吸收峰,故以330 nm作为检测波长[6],测定地参多糖溶液脱色前后的吸光度,将检测到的地参多糖脱色前后的吸光度代入公式(1)计算多糖的脱色率:
式中:D表示多溏脱色率;A1为地参多糖脱色前在330 nm波长处的吸光度;A2為地参多糖脱色后在330 nm波长处的吸光度。
1.3.5 地参多糖保留率的测定 参照文献[13]的方法,测定地参多糖溶液脱色前后的吸光度,将脱色前后的吸光度代入葡萄糖标准曲线计算地参多糖质量浓度。将地参多糖质量浓度代入公式(2)计算多糖保留率:
式中:R表示多糖保留率,%;C1为脱色前地参多糖的质量浓度,mg/mL;C2为脱色后地参多糖的质量浓度,mg/mL。
1.3.6 地参多糖脱色效果的评价 参照文献[14]的方法,以地参多糖脱色率和多糖保留率2个指标的加权综合评分为评价指标,评价地参多糖的脱色效果,设置脱色率(D)和多糖保留率(R)2个指标的权重值均为50,将多糖脱色率和多糖保留率代入公式(3)计算综合评分:
式中:M表示脱色率和多糖保留率2个指标的综合评分,分;D表示地参多糖脱色率,%;Dmax表示地参多糖最大脱色率,%;R表示地参多糖多糖保留率,%;Rmax表示地参多糖最大保留率,%。
1.3.7 地参多糖脱色单因素试验 准确称取0.6 g地参多糖多份,超纯水定溶至100 mL,得地参多糖质量浓度为6 mg/mL的供试液。在保持其他因素不变的情况下,分别考察充分溶胀的大孔树酯用量(1.0、2.0、3.0、4.0、5.0 g)、地参多糖脱色时间(2、3、4、5、6 h)以及脱色温度(40、45、50、55、60 ℃)3个因素对地参多糖脱色率和多糖保留率的影响。
1.3.8 响应面试验 在单因素试验结果的基础上,以地参多糖脱色率和多糖保留率2个指标的综合评分(Y)为响应值,对大孔树酯用量(A)、脱色温度(B)和脱色时间(C)3个因素,选取3因素3水平,采用响应面法优化地参多糖脱色工艺,因素与水平见表1所示。
1.3.9 地参多糖对ABTS自由基的清除作用 将脱色后的地参多糖配制成5个不同质量浓度(0.1、0.2、0.3、0.4和0.5 mg/mL)的地参多糖溶液备用,以抗坏血酸(Vc)为阳性对照,探究地参多糖的体外抗氧化活性。参照张倩[15]的方法检测地参多糖对ABTS自由基的清除能力,按照公式(4)计算地参多糖对ABTS自由基的清除率:
式中:R为ABTS自由基的清除率,%;A1为地参多糖试验组或抗坏血酸(Vc)阳性对照组的吸光度,A2为超纯水代替ABTS加入地参多糖溶液或抗坏血酸(Vc)溶液中的本底吸光度;A0为空白组的吸光度。
1.4 数据处理
每个试验重复3次,取平均值,采用SPSS 21.0和Origin 9.0软件统计分析试验数据,Design-Expert 13.0软件进行响应面模拟和方差分析。
2 结果与分析
2.1 单因素试验
2.1.1 树酯用量对脱色率和多糖保留率的影响 由图1可知,随着大孔树酯用量的增加,多糖脱色率逐渐升高,多糖保留率则逐渐下降。大孔树酯用量低于3 g,多糖脱色率增加较快;当树酯用量超过3 g,多糖脱色率上升趋缓,可能是大孔树酯吸附色素逐渐达到饱和状态。与此同时,随着大孔树酯用量增加,多糖保留率不断下降,可能是树酯用量过大,部分地参多糖被吸附,造成多糖损失,导致多糖保留率下降。在大孔树酯用量为3 g时,多糖脱色率为66.32%,多糖保留率为58.81%,为避免多糖过多的损失以及保证脱色效率,选取树酯用量3 g开展后续单因素试验。综合考虑,选择大孔树酯用量为2、3、4 g开展响应面试验。
2.1.2 温度对脱色率和多糖保留率的影响 由图2可知:在40~60 ℃范围内,随着温度升高,多糖脱色率缓慢上升,多糖保留率缓慢下降。可能是温度的升高,有利于树酯对色素的吸附,但当脱色温度超过45 ℃,大孔树酯对多糖的吸附作用可能增强,导致多糖保留率急剧下降。为避免多糖损失过多,选取脱色温度45 ℃开展后续单因素试验。综合考虑,选择脱色温度40、45、50 ℃开展响应面试验。
2.1.3 脱色时间对脱色率和多糖保留率的影响 由图3可知:随着脱色时间的增加,多糖脱色率呈先快后慢的趋势,而多糖保留率则呈快速下降趋势。原因可能为在脱色时间小于3 h,色素和多糖分子竞争性吸附于大孔树酯上。脱色时间超过3 h,脱色率上升较慢,可能是大孔树酯对色素的吸附趋于饱和;随着时间的延长,大孔树酯对多糖的吸附性增加,导致多糖保留率降低,造成多糖损失。为避免多糖的损失并兼顾脱色效果,选取脱色时间2、3、4 h开展响应面试验。
2.2 响应面试验
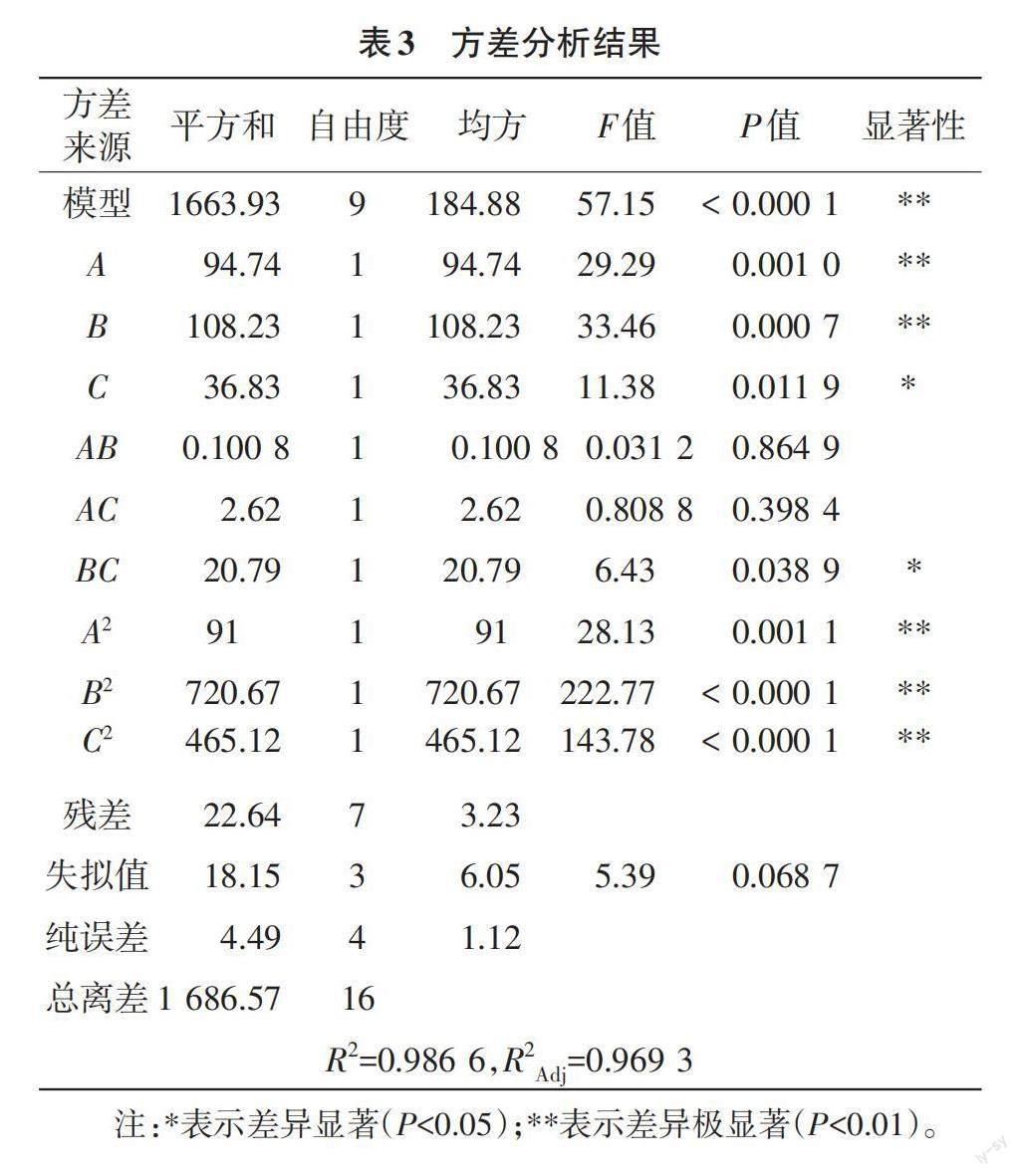
2.2.1 响应面试验结果与分析 根据Design-Expert 13.0软件设计的试验方案开展试验,结果见表2,方差分析见表3。以多糖脱色率和多糖保留率2个指标的综合评分(Y)为响应值,树酯用量(A)、脱色温度(B)和脱色时间(C)进行回归拟合,得到回归方程如下:Y=82.38+3.44A+3.68B+2.15C+0.1587AB-0.8088AC-2.28BC-4.65A2-13.08B2-10.51C2
由表3可知:模型的P值<0.01,表明综合评分(Y)与3个因素的拟合回归方程极显著,提示响应面试验设计可靠。失拟项的P值为0.068 7>0.050 0,提示响应面回归方程拟合度较好。表3中,因素A、B、A2、B2、C2均对综合评分(Y)具有极显著的影响(P<0.01);因素C、BC对综合评分(Y)具有显著影响(P<0.05),提示改变这些因素的水平,会导致响应值(综合评分)产生显著变化。回归方程的交互项AB、AC的P>0.05,表明AB、AC交互项对综合评分的影响不显著,提示大孔树酯用量(A)与脱色温度(B)、大孔树酯用量(A)与脱色时间(C)2个因素间无交互项作用。交互项BC的P<0.05,提示脱色温度(B)与脱色时间(C)2个因素间有交互作用。
表3中因素A、B、C的F值分别为29.29、33.46、11.38,提示3个因素对响应值(综合评分)的影响强弱顺序为:脱色温度(B)>大孔树酯用量(A)>脱色时间(C)。模型R2=0.986 6,R2Adj=0.969 3,均大于0.9,提示该模型实测值与预测值较为接近,表明该模型能够较好地模拟真实的试验过程[16]。
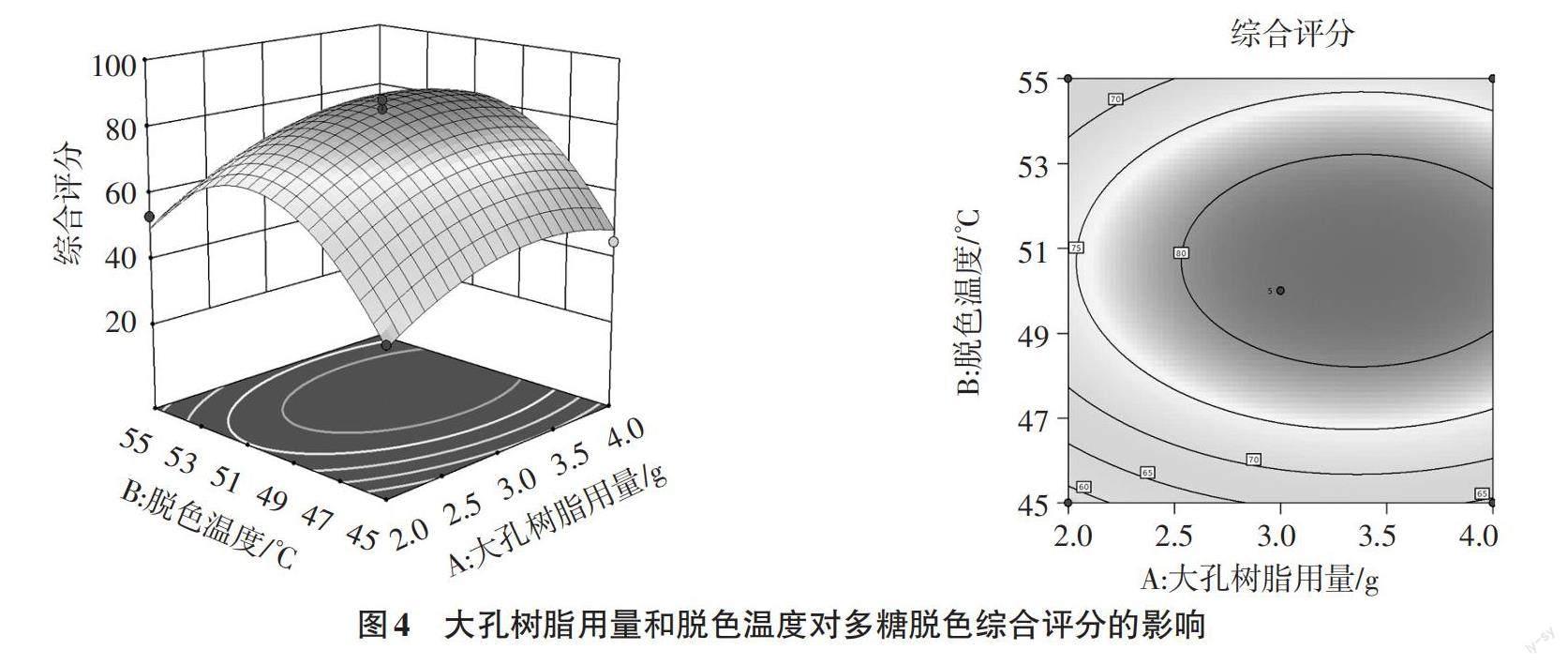
2.2.2 各因素交互作用响应面图分析 响应曲面的陡峭程度能够反映2个因素对响应值的影响程度。响应曲面越陡峭,表示2个因素对响应值的影响越大。反之,则表示2个因素对响应值的影响越小。此外,等高线的形状能够反映2个因素之间的交互作用,当等高线形状趋近椭圆,表示2个因素间的交互作用越顯著。当等高线趋近圆形时,提示2个因素间的交互作用不显著[17]。
由图4~5可知,大孔树酯用量(A)与脱色温度(B)、大孔树酯用量(A)与脱色时间(C)2个因素间的响应曲面坡度相对平缓,且等高线也没有呈现明显的椭圆形,提示AB、AC间的交互作用不显著(图4a、b)。由图6可知,脱色温度(B)与脱色时间(C)2个因素间的响应面坡度较陡峭,等高线也趋近于椭圆形,提示脱色温度(B)与脱色时间(C)间的交互作用显著。上述响应面交互作用的结果与方差分析结果一致。
2.2.3 工艺验证试验 利用Design-Expert 13.0软件预测,得到地参多糖最佳脱色工艺参数为:100 mL质量浓度为6 mg/mL的地参多糖溶液,大孔树酯用量为3.37 g、脱色温度44.90 ℃、脱色时间3.07 h,脱色1次,此时多糖脱色率的预测值为83.71%,多糖保留率预测值为71.32 %,综合评分预测值为83.34。考虑实际情况,调整最佳脱色工艺参数为:100 mL质量浓度为6 mg/mL的地参多糖溶液,大孔树酯用量3 g、脱色温度45 ℃、脱色时间3 h,脱色1次。按此工艺条件进行脱色试验,得到地参多糖脱色率达到82.64%,多糖保留率为72.06%,综合评分为82.15,与模型综合评分预测值(83.34)相比,相对误差为1.43%,表明响应面法优化的脱色工艺可靠,可用于地参多糖脱色的实际生产。
2.3 地参多糖对ABTS自由基的清除作用
由图7可知,地参多糖对ABTS自由基的清除作用与地参多糖的质量浓度呈正相关。当地参多糖的质量浓度为0.5 mg/mL时,地参多糖对ABTS自由基的清除率达到试验浓度的最大值为44.28%,但低于相同浓度的Vc对ABTS的清除率(94.8%)。
自由基可自由穿过细胞膜与细胞内的生物分子发生反应。其机理是自由基会破坏细胞膜,使蛋白质变性而丧失功能,最终导致细胞损伤[18]。因此,清除自由基可有效防止细胞损伤,保护细胞膜和延缓衰老[19]。地参多糖对ABTS自由基的清除作用虽然弱于相同浓度的Vc,但仍表现出一定的抗氧化活性。临床用药实践表明,Vc的过度使用会引起胃酸分泌增多、泌尿系统结石等副作用。由于地参多糖属于天然产物,具有安全、副作用小的优点,因此地参多糖可作为天然抗氧化剂开发及应用。
3 结论与讨论
大孔树酯吸附脱色具有操作简单、脱色效率高、性质温和以及不会破坏多糖的结构等优点,是当前多糖脱色较为常用的方法[10]。本研究采用FL-1型大孔树酯作为脱色剂,脱出地参多糖中的色素,考察大孔树酯用量、脱色时间及脱色温度对地参多糖脱色率和保留率的影响。基于单因素试验结果,响应面法优化地参多糖大孔树酯脱色工艺,并探究地参多糖体外抗氧化活性。得到大孔树酯脱除地参多糖色素的最佳工艺参数:质量浓度6 mg/mL的地参多糖溶液100 mL,添加大孔树酯3 g,脱色温度45 ℃,脱色时间3h,脱色1次。在此条件下,地参多糖脱色率达到82.64%,多糖保留率为72.06%,综合评分为82.15,与综合评分预测值(83.34)相比,相对误差为1.43%,表明脱色工艺稳定可靠。体外抗氧化活性试验结果显示,地参多糖对ABTS自由基表现出较好的清除作用,表明地参多糖具有一定的抗氧化性,可作为天然易得的抗氧化剂开发利用。
综上,采用大孔树酯吸附脱色具有脱色温度低、脱色时间短、脱色率以及多糖保留率高等优点,适合对滇产地参多糖脱色。本研究可为地参多糖分离纯化、结构解析以及地参多糖功能性食品的开发研究提供基础。
参考文献
[1] 国家药典委员会. 中华人民共和国药典.一部:2020年版[M]. 北京:中国医药科技出版社,2020.
[2] 熊伟,谭德勇,陈贵元,等. 地参多糖对正常及实验性糖尿病小鼠血糖的影响实验研究[J]. 生命科学仪器,2010,8(5):64-66.
[3] 李月,徐兵,范媛媛,等. 滇产苦胆草多糖提取及抗氧化活性研究[J]. 中国食品添加剂,2018(5):62-68.
[4] 程婷婷,李岩,陈贵元. 地参多糖对非小细胞肺癌A549细胞抗肿瘤作用及机制[J]. 中国实驗方剂学杂志,2022,28(3):83-90.
[5] 熊伟,谭德勇,陈贵元,等. 地参多糖对小鼠免疫功能影响的实验研究[J]. 时珍国医国药,2011,22(1):11-13.
[6] 刘涵,李倩倩,程婷婷,等. 响应面法优化滇产地参多糖的提取工艺及其抗氧化活性研究[J]. 饲料研究,2022,45(24):62-67.
[7] NABARLATZ D,TORRAS C,GARCIAVALLS R,et al. Purification of xylo-oligosaccharides from almond shells by ultrafiltration[J]. Separation and Purification Technology,2007,53(3):235-243.
[8] 杨申明,熊正军,王振吉,等. 响应面法优化地参多糖脱色工艺及其抗氧化活性研究[J]. 粮食与油脂,2022,35(1):111-115.
[9] 付建鑫,邵家威,方奕珊,等. 响应面优化提取灰绿碱蓬多糖及脱色工艺研究[J]. 中国调味品,2020,45(6):37-42.
[10] 杨申明,杜云,王振吉,等. 响应面法优化大孔树脂对地参多糖脱色工艺及抗氧化活性分析[J]. 离子交换与吸附,2021,37(2):143-153.
[11] 沈锦,刘钰梅,李洁,等. 白菊米多糖大孔树脂脱色工艺研究[J]. 山东化工,2019,48(23):142-144.
[12] 杨勤,谷文超,周浓,等. 苯酚-硫酸法与蒽酮-硫酸法测定地参多糖的比较研究[J]. 食品科技,2020,45(1):343-350.
[13] 李倩倩,程婷婷,刘涵,等. 刺梨果多糖提取工艺优化及抗氧化活性研究[J]. 粮食与油脂,2022,35(11):104-108,113.
[14] 杨颖,谢佳雨,周冰倩,等. 白术粗多糖的大孔树脂脱色工艺优化研究[J]. 食品科技,2020,45(8):169-173.
[15] 张倩. 黄茶多糖的分离纯化及其抗氧化活性研究[J]. 食品研究与开发,2021,42(14):49-55.
[16] 彭雅玲,陈新,王俊博,等. 响应面法优化紫果西番莲果胶多糖脱色工艺[J]. 食品工业科技,2018,39(4):166-170,196.
[17] 惠靖茹,程洋洋,黄占旺. 响应面优化茶树菇发酵调味料的制曲工艺[J]. 中国调味品,2022,47(4):97-101,116.
[18] 杨善岚,吴磊,涂嘉欣,等. 自由基致衰老的研究进展[J]. 中华疾病控制杂志,2022,26(5):589-594.
[19] 赵小霞,周杨,周玥,等. 螺旋藻多糖提取工艺的改进及其抗衰老作用[J]. 中国老年学杂志,2021,41(16):3529-3532.
(责编:张宏民)

