JAG1 影响单核-巨噬细胞重塑三阴性乳腺癌转移前微环境:基于外泌体中的LncRNA MALAT1
徐梦歧,石宇彤,刘俊平,吴敏敏,张凤梅,何志强,唐 敏
重庆医科大学检验医学院//临床检验诊断学教育部重点实验室,重庆400016
三阴性乳腺癌(TNBC)是乳腺癌中最具侵袭性的分子亚型,具有复发率高、存活率低和转移潜能大[1],缺乏治疗靶点和预后差的特点[2,3]。尽管目前临床治疗取得一定的进展[4-7],但在转移性环境中,TNBC仍然是致命的[8-10]。因此,明确TNBC转移过程中关键分子和细胞成分对早期发现和控制TNBC转移至关重要。
研究表明,肿瘤转移前微环境(PMN)形成是乳腺癌等肿瘤远处转移的关键步骤[11,12]。肿瘤来源的外泌体作为重要的媒介介导肿瘤细胞与受体细胞之间的串扰[13,14]并影响受体细胞的表型促进转移前微环境的形成[15,16]。而单核-巨噬细胞是肿瘤微环境中的重要组成部分。Notch信号在肿瘤微环境中广泛分布[17],在包括TNBC在内的多种肿瘤中被激活,在肿瘤细胞生存、进展、转移和侵袭中发挥重要作用[18-20],但不同肿瘤间及同一肿瘤不同亚型内的异质性较大[21,22],这可能与微环境有关。研究显示Notch信号通路经典的膜配体之一JAG1是TNBC的侵袭分子[23,24],能对单核-巨噬细胞有直接的招募作用[25],与TNBC的复发转移有关。但既往研究揭示的仅仅是膜配体JAG1对单核-巨噬细胞的直接作用,肿瘤上JAG1能否通过外泌体的方式对远处单核-巨噬细胞发挥作用,从而促进PMN形成,促进TNBC转移,相关研究尚未见报道。因此,本研究拟通过以TNBC细胞株MDA-MB-231为研究对象,初步研究JAG1对TNBC转移前微环境中单核-巨噬细胞的影响及其可能机制,以期为TNBC诊疗提供新的思路和靶点。
1 材料和方法
1.1 细胞和动物
三阴性乳腺癌细胞株MDA-MB-231(231)、侵袭株MDA-MB-231B(231B),人脐静脉内皮细胞HUVEC,人源单核细胞THP-1由重庆医科大学临床检验诊断学教育部重点实验室保藏。SPF级雌性裸鼠,6~7周龄,体质量15 g左右,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008。本实验通过重庆医科大学动物伦理专业委员会批准(审批号2021023)。MDA-MB-231、MDA-MB-231B,HUVEC均用含10%胎牛血清(FBS)、1%青霉素/链霉素(P/S)的DMEM完全培养基进行培养;人源单核细胞THP-1用含10%胎牛血清、1%青霉素/链霉素(P/S)的RPMI 1640完全培养基培养,以上细胞均放置于37 ℃、5%饱和度CO2的无菌恒温培养箱中。
1.2 主要试剂
DMEM、RPMI 1640和胎牛血清(上海源培生物科技有限公司);RNA快速提取试剂盒(上海奕杉生物科技有限公司);Real-time PCR试剂盒、SYBR Green Ⅰ及人源JAG1重组蛋白试剂(MCE);CD68抗体(CST),兔抗鼠JAG1抗体(沈阳万类生物公司);Dil荧光染料(上海碧云天公司);佛波酯(PMA)(杭州联科生物公司);IL-4和IL-13(北京神州义翘公司);DAPI染料(北京博奥森公司);0.2 µm 过滤器(Millipore);小干扰RNA(siRNA)及其转染试剂GP-transfect-Mate(上海吉玛基因公司);所有引物由上海生工生物工程公司设计合成(表1)。
1.3 方法
1.3.1 裸鼠原位乳腺癌移植瘤模型的构建 选取6~7周龄,体质量为15 g 左右的雌性裸鼠,分为2 组(MDAMB-231,MDA-MB-231B),5只/组,用10%的水合氯醛注射入腹腔进行麻醉;往裸鼠乳房脂肪垫处使用注射器注射100 µL 细胞悬液(约5×106MDA-MB-231 或MDA-MB-231B细胞),使用镊子和缝合线,缝合其皮肤;6周后处死裸鼠,观察原位肿瘤及其肝转移灶情况,取肿瘤组织进行免疫组化分析。
1.3.2 qRT-PCR 使用RNA快提试剂盒按照说明书进行RNA提取,检测RNA浓度,进行逆转录。逆转录反应体系首先在25 ℃下,反应5 min;随后在55 ℃下反应15 min;最后在85 ℃,反应2 min,所得产物在4 ℃保存。PCR 扩增体系为10 μL,92 ℃20 s,56 ℃30 s,72 ℃20 s,重复40个循环。引物序列见(表1)。
1.3.3 Western blot 收集细胞和外泌体,使用RIPA裂解后提取总蛋白,BCA法测其浓度。用SDS-PAGE分离蛋白质,并转移到PVDF膜。用5%脱脂牛奶封闭后,将膜与各一抗在4 ℃下孵育过夜,β-actin以1∶1000稀释,Jagged1、NICD、ALIX以1∶500稀释。在37 ℃下分别与以1∶5000的稀释辣根过氧化物酶标记的山羊抗兔IgG或山羊抗小鼠IgG孵育1 h,使用ECL底物显影并统计。
1.3.4 细胞条件培养基(CM)收集及实验分组 待MDA-MB-231 细胞贴壁后加入人源JAG1 重组蛋白(rhJAG1,150 ng/mL),长至70%视野,更换为无血清无双抗的DMEM培养基进行饥饿处理,37 ℃培养24 h,收集细胞上清液。其余条件培养基收集与上述类似,均待细胞长至70%视野后,更换为双无培养基,37 ℃培养24 h,收集细胞上清液。细胞上清液放置于-80 ℃保存以待使用。根据处理情况分为5组:Control组:不进行CM处理;231-CM组:使用231细胞上清液处理;231-JAG1-CM组:使用JAG1处理24 h之后的231细胞上清液处理;231B-CM组:使用231B细胞上清液处理;231-DAPT-CM组:使用DAPT处理后的231细胞上清液处理。
1.3.5 单核-内皮黏附实验 首先将HUVEC细胞接种于六孔板中,待生长至单层,移除DMEM完全培养基,加入无血清DMEM培养基进行饥饿处理1 h。使用无血清RPMI 1640培养基配置Dil工作液,加入TNBC条件培养基与无血清RPMI 1640 培养基1∶1 混合预处理24 h 的THP-1 细胞,5×104/孔,使Dil 工作液终浓度为2µg/mL。放置于37 ℃孵箱,孵育5 min,之后置于4 ℃冰箱15 min。800 r/min离心,5 min,去除上清液,用适量PBS重悬,重复此步骤3次。用无血清RPMI 1640培养基重悬,加入六孔板中,每孔细胞悬液500µL,37℃孵育1 h,移去培养基,PBS轻轻洗涤3遍,去除未黏附细胞。倒置荧光显微镜下拍照,计数每孔3个视野单核细胞黏附数量,平均后即得到每个视野单核细胞黏附数。
1.3.6 Transwell实验 单核细胞迁移实验使用10µm孔径小室系统进行。在显微镜下进行计数,2×104/孔,均匀悬于无血清RPMI 1640培养基与条件培养基1∶1混合培养液中,然后加入上室,每孔200µL。在下室加入有血清的RPMI 1640培养基500µL,与上室形成血清浓度梯度。37 ℃孵育24 h后,在倒置显微镜下拍照,计数每孔下室内3个视野的细胞数量,取其平均值。
1.3.7 巨噬细胞极化与破骨分化实验 使用PMA(0.1 mg/mL)处理THP-1细胞24 h,诱导其分化为巨噬细胞(M0 型)。此后在TNBC 条件培养基与无血清RPMI 1640 1∶1混合处理条件下,加入IFN-γ(50 ng/mL)和LPS(100 ng/mL)孵育48 h,使其向M1型巨噬细胞极化;加入IL-4(50 ng/mL)和IL-13(50 ng/mL)孵育48 h,使其向M2型巨噬细胞极化。使用TNBC条件培养基与RPMI 1640 1∶1混合处理THP-1 48 h,qRT-PCR检测破骨相关分子的表达情况。
1.3.8 外泌体提取与鉴定 TNBC细胞分泌的外泌体采用超高速差速离心法提取。将细胞上清液在4 ℃,300 g离心10 min,2000 g离心20 min,10 000 g离心30 min。每次离心后,收集上清,弃沉淀。最后的上清液用0.2µm的孔过滤器过滤以去除大囊泡。收集的过滤液10×104g离心70 min,用无菌PBS重悬沉淀,再次离心,10×104g,70 min。每次超高速离心后,用移液管尽量去除多余的上清。离心结束后,将外囊泡溶于50~100µL无菌PBS中,-80 ℃保存2周,以备后续实验使用。采用透射电子显微镜(TEM)分析外泌体形态。取出10µL外泌体样品,加入铜网沉淀1 min,然后用滤纸吸去浮液。将10µL的醋酸二氧铀加入铜丝中沉淀1 min,用滤纸吸附浮液。10µL外泌体被吸附在碳膜支撑的铜丝上。外泌体用磷钨酸负染2 min,PBS洗涤并干燥。在室温下干燥几分钟,在100 kV透射电镜下观察成像结果。采用纳米颗粒跟踪分析(NTA)来确定外泌体颗粒大小和数量。使用Zeta视图处理软件对数据进行处理。外泌体样品用PBS 1∶300稀释,然后上机测试。分析样品60 s,重复5次。得到待测样品的粒径和浓度,根据稀释浓度计算出原样品浓度。
1.3.9 外泌体摄取实验 外泌体使用Dil(10µg/mL)染色,37 ℃孵育30 min。将标记的外泌体添加到THP-1细胞中,共同孵育24 h后,移去多余外泌体,使用4%多聚甲醛固定15 min,DAPI染色5 min,通过共聚焦显微镜观察THP-1细胞内的外泌体摄取情况。
1.3.10 siRNA转染实验 待THP-1长至每个视野至少有60%的细胞时进行转染。按照试剂说明使用无血清培养基进行转染,每次转染的siRNA浓度为100 nmol/L。转染4~6 h后,更换为含血清的完全培养基,24~96 h后收集细胞进行下一步实验。siRNA-NC 和siRNAMALAT1序列见(表1)。
1.3.11 生物信息学分析 使用Human Protein Atlas(HPA)数据库(https://www.proteinatlas.org)中的“Pathology”模块,可以用来分析蛋白质在不同肿瘤中的表达水平。Kaplan-Meier Plotter (kmplot.com/analysis)是一个基于GEO,TCGA,EGA数据的生存分析网站,利用其中的“Breast RNA-seq”模块,分析三阴性乳腺癌中基因表达与患者生存率之间的关系。在Gene Expression Profiling Interactive Analysis(GEPIA)数据库中,利用“Correlation Analysis”模块,分析肿瘤中两个基因表达之间的相关性。ENCORI(http://starbase.sysu.edu.cn/index.php)数据库和RNAInter(http://www.rnainter.org/)数据库可以用于研究RNA相互作用。在ENCORI中的“miRNA-Target”模块,查找与MALAT1有相互作用的miRNA。在RNAInter的“Search”模块,查找与MALAT1有相互作用的miRNA。使用R包在7个RNA靶向数据库(DIANA,EIMMo,miRanda,miRDB,PicTar,PITA,TargetScan)中进行筛选,确定在3个及3个以上数据库中靶向调控JAG1的miRNA为候选目标。miRCancer(http://mircancer.ecu.edu/index.jsp)数据库一个肿瘤相关的miRNA数据库。该数据库通过收集和整理文献,给出各种肿瘤相关的miRNA以及miRNA在肿瘤中的表达趋势。通过“Search miRCancer”模块筛选出在乳腺癌中低表达的miRNA。将以上得到的miRNA取交集,得到目标miRNA。
1.4 统计学处理
数据采用均数±标准差表示。图形绘制和统计学分析采用GraphPad Prism 6软件。两组间均数比较采用t检验;多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。所有的实验都独立重复3次。
2 结果
2.1 Notch经典膜配体JAG1为TNBC侵袭分子
首先对人类蛋白质表达谱数据库(HPA)中JAG1蛋白表达进行分析,结果显示与正常组织相比,乳腺癌组织中JAG1的蛋白表达显著升高(图1A)。随后,在Kaplan-Meier Plotter数据库中,观察JAG1 mRNA表达与TNBC患者总体生存率(OS)的关系,结果显示,高表达JAG1 的TNBC 患者OS 低于低表达JAG1 患者组(P<0.05,图1B),这提示JAG1的高表达与TNBC的不良预后密切相关。qRT-PCR和Western blot检测MDAMB-231和MDA-MB-231B中的JAG1表达情况。结果显示,侵袭性株MDA-MB-231B细胞中JAG1 mRNA和蛋白均显著升高(P<0.01,图1C、D)。裸鼠原位乳腺癌模型结果显示JAG1升高的侵袭株MDA-MB-231B与MDA-MB-231细胞株相比:原位肿瘤的大小无显著性差异(图1E),但231B组肝脏转移结节数量增加,面积增大(图1F)。此外,免疫组化显示,JAG1升高的侵袭株MDA-MB-231原位肿瘤中单核巨噬细胞标志物CD68表达显著增多(图1G)。
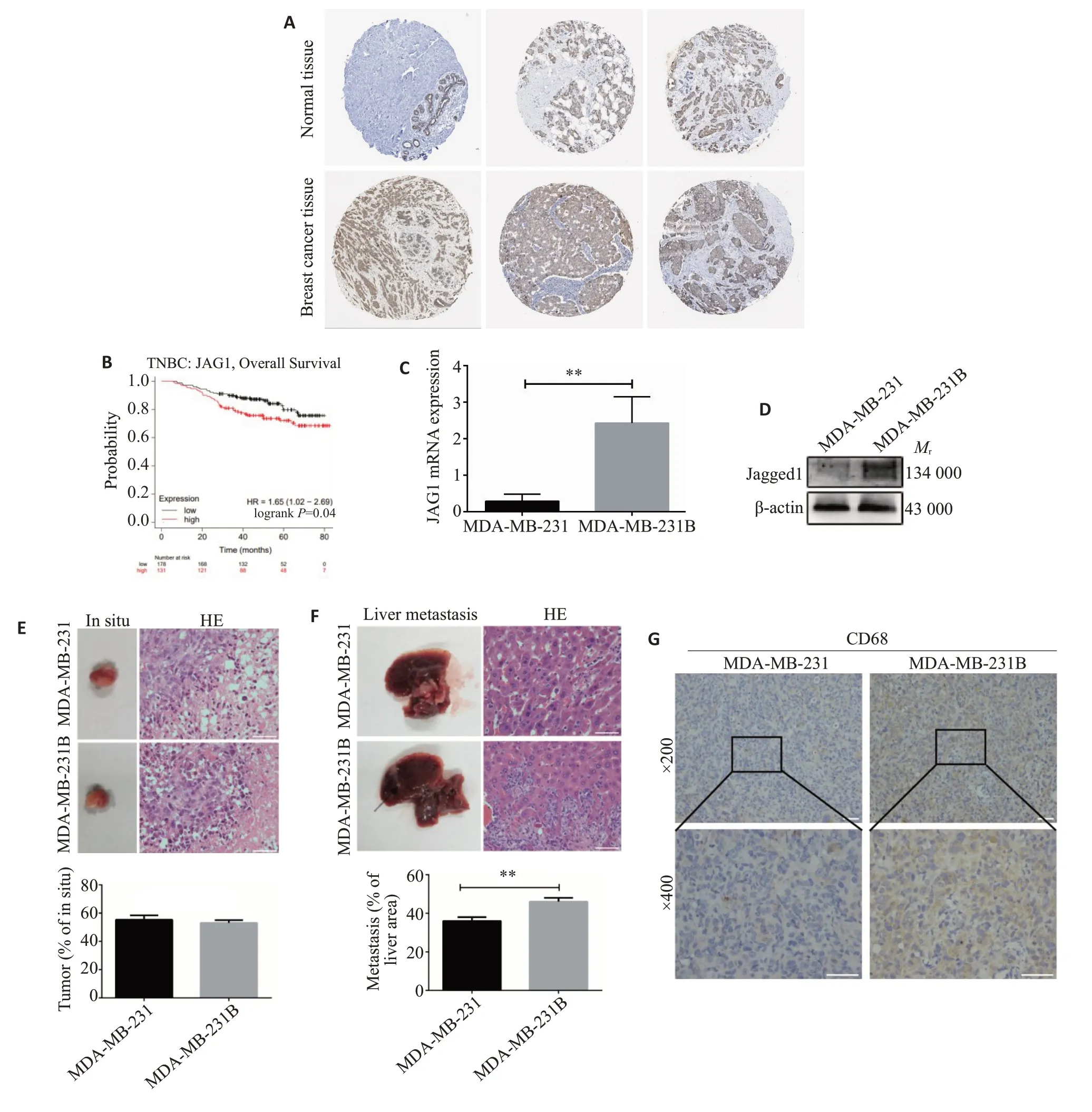
图1 侵袭性TNBC中JAG1表达增高Fig.1 Triple-negative breast cancer(TNBC)with high expression of JAG1 show greater metastatic potential.A:Immunohistochemistry of JAG1 expression in normal and breast cancer tissues from HPA database.B:Analysis of TNBC patients'overall survival in relation to JAG1 expression.C:Expression of JAG1 in MDA-MB-231 and MDA-MB-231B cells detected by qRT-PCR.D:Expression of Jagged1 in MDA-MB-231 and MDA-MB-231B cells detected by Western blotting.E:HE staining of TNBC tumor in situ.F:HE staining for liver metastases of TNBC tumor.G:Immunohistochemistry of CD68 expression in TNBC tumor in situ.E,F,G:Scale bar=50 μm.**P<0.01.
2.2 JAG1促进单核细胞黏附、迁移,影响单核细胞的分化
通过GEPIA数据库进一步证实乳腺癌中JAG1表达与单核细胞标志CD68表达之间的相关性,结果显示JAG1表达与CD68表达呈现显著正相关(R=0.18,P<0.05,图2A)。进一步采用rhJAG1处理单核细胞,观察JAG1对单核细胞的影响。Western blotting检测显示rhJAG1处理单核细胞后单核细胞内Jagged1蛋白的表达显著增加(图2B)。黏附方面:与对照组相比,JAG1组单核细胞的黏附数量显著升高(P<0.05,图2C)。qRT-PCR 也证实单核细胞内黏附分子ICAM-1 的表达显著升高(P<0.01,图2D)。迁移方面:Transwell结果显示,JAG1组细胞迁移数量显著多于对照组(P<0.05,图2E)。qRT-PCR显示单核相关趋化因子CCL2 mRNA表达显著上调(P<0.0001,图2F)。破骨分化方面:qRTPCR结果显示,rhJAG1处理后单核细胞内破骨促进因子RANKL(P<0.01),PTHrP(P<0.05),TGF-β(P<0.05)mRNA 表达显著上升,破骨抑制因子OPG(P<0.01)mRNA表达则显著下降(图2G)。
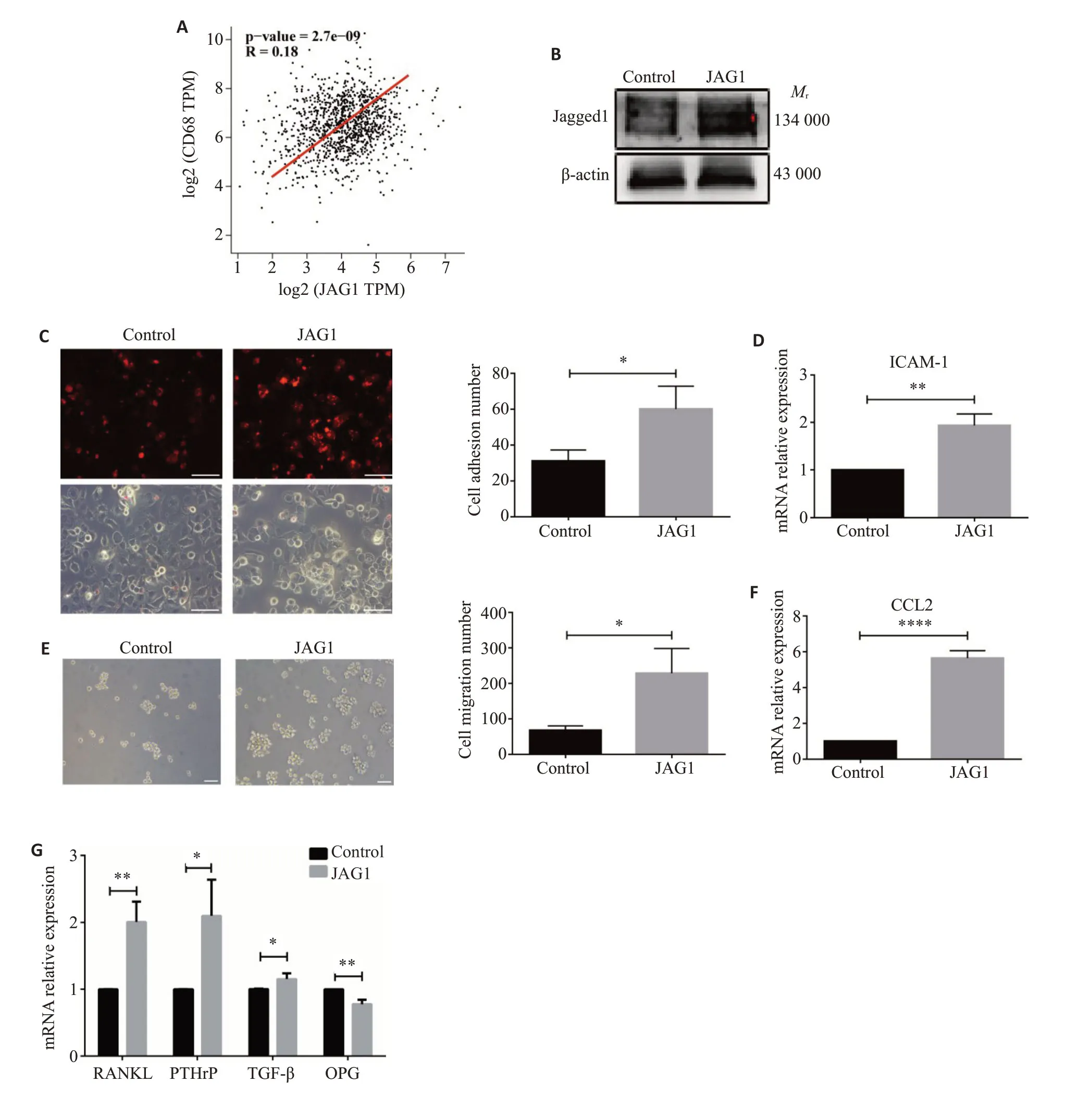
图2 JAG1直接促进单核-巨噬细胞黏附、迁移和破骨分化Fig.2 JAG1 directly promotes adhesion,migration and osteoclast differentiation of monocytes-macrophages.A: Correlation between JAG1 expression and CD68 expression in breast cancer in GEPIA database.B: Expression of Jagged1 in THP-1 cells treated with rhJAG1 detected by Western blotting.C: Effect of JAG1 on the number of adhesive monocytes measured by monocyte-endothelial adhesion test.D:Expression of adhesive molecule ICAM-1 after JAG1 treatment detected by qRTPCR.E:Number of migrated monocytes after JAG1 treatment detected by Transwell assay.F:Expression of chemokine CCL2 after JAG1 treatment detected by qRT-PCR.G:Expression of osteoclast-related molecules after JAG1 treatment detected by qRTPCR.C,E:Scale bar=100 μm.*P<0.05,**P<0.01,****P<0.0001.
2.3 JAG1升高的TNBC条件培养基促进单核细胞黏附、迁移,影响单核细胞分化
采用TNBC 条件培养基探讨TNBC 中JAG1 对PMN中单核细胞的影响。分别用231-CM,231-JAG1-CM,231B-CM,231-DAPT-CM处理单核细胞后从3个方面进行检测。Western blotting 和qRT-PCR 结果显示DAPT处理后Notch活化效应因子NICD表达减少(图3A),Notch活化靶基因HEY1表达减少(P<0.01,图3B)。黏附方面:单核-内皮黏附实验和qRT-PCR结果显示,231-JAG1-CM 组(P<0.001)和231B-CM 组(P<0.01)单核细胞的黏附数量(图3C)和黏附分子ICAM-1表达(P<0.05,图3D)相比231-CM 组显著增加,231-DAPT-CM组单核细胞的黏附数量相比231-CM组显著减少(P<0.05,图3C)。迁移方面:Transwell 实验和qRT-PCR 结果显示,231-JAG1-CM 组(P<0.0001)和231B-CM组(P<0.001)能显著增加单核细胞迁移的数量(图3E)和趋化因子CCL2的表达(P<0.01,图3F),231-DAPT-CM组单核细胞迁移数量相比231-CM组减少(P<0.05,图3E)。破骨分化方面:qRT-PCR结果显示,231-JAG1-CM处理单核细胞后,破骨促进因子RANKL(P<0.001),PTHrP(P<0.001),TGF-β(P<0.05)mRNA表达显著增加(图3G)。231-JAG1-CM组中M2型巨噬细胞标志物CD206表达均显著上调(P<0.01,图3H)。
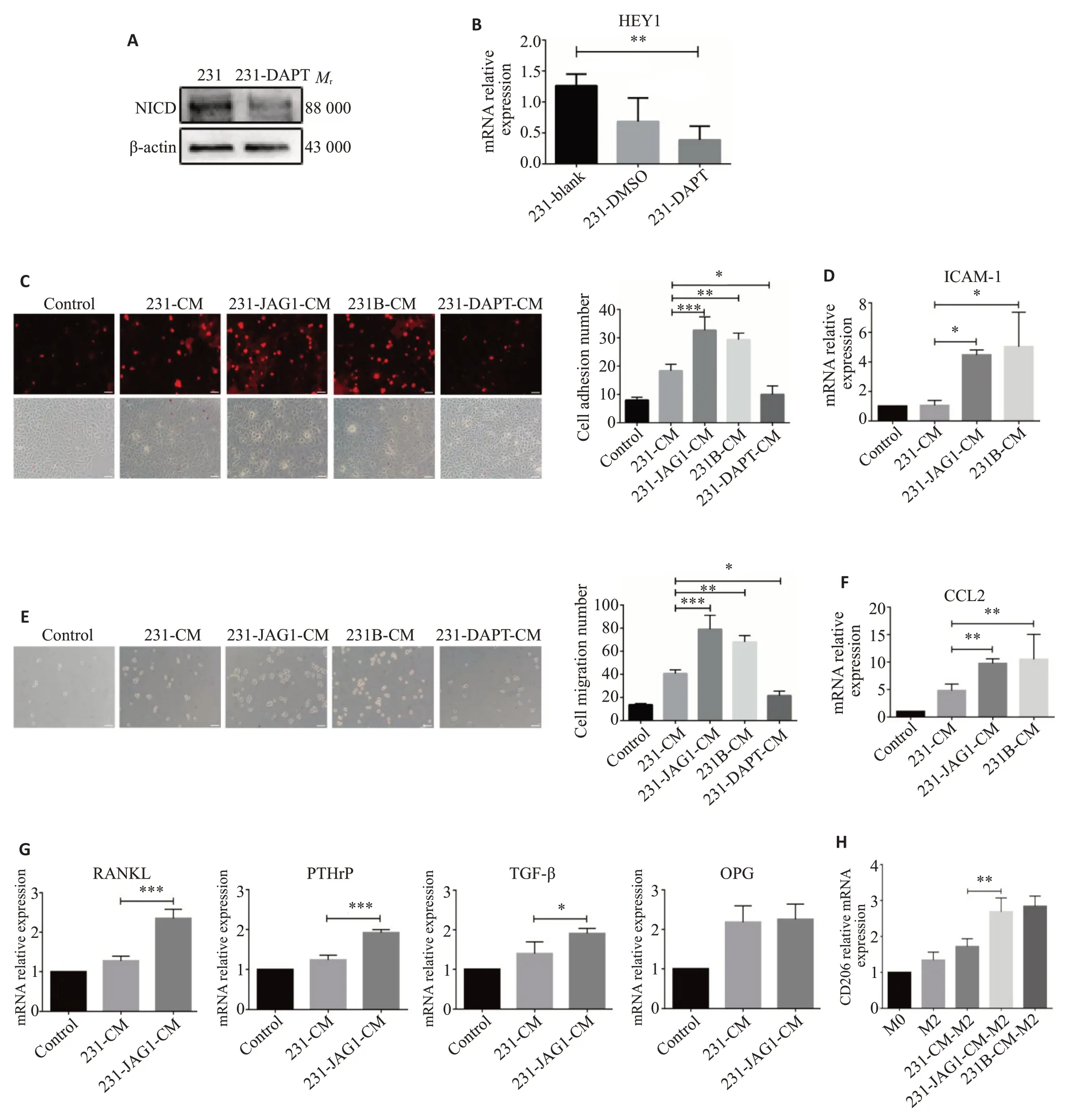
图3 JAG1升高的TNBC条件培养基促单核细胞黏附、迁移和破骨分化Fig.3 Conditioned medium of TNBC with increased JAG1 promotes adhesion and migration of monocytes and affects differentiation of macrophages.A: Expression of NICD in MDA-MB-231 and MDA-MB-231-DAPT cells detected by Western blotting.B:Expression of HEY1 in MDA-MB-231 and MDA-MB-231-DAPT cells by qRT-PCR.C:Monocyte adhesion number after CM treatment measured by monocyte adhesion test.D:Expression of adhesive molecule ICAM-1 after CM treatment detected by qRT-PCR.E:Number of migrated of monocytes after CM treatment in Transwell assay.F:Expression of chemokine CCL2 after CM treatment detected by qRT-PCR.G: Expression of osteoclast-related molecules after CM treatment detected by qRT-PCR.H:Expression of M2 macrophage marker CD206 after CM treatment detected by qRT-PCR.C,E:Scale bar=100 μm.*P<0.05,**P<0.01,***P<0.001.
2.4 JAG1 通过TNBC 外泌体中LncRNA MALAT1 靶向miR-26a-5p影响单核细胞中JAG1表达
首先检测JAG1 对TNBC 外泌体分泌的影响。透射电镜、NTA、Western blot证实,与231-Exosome组相比,231-JAG1-Exosome 组外泌体数量显著增多(P<0.01,图4A~D),而231-DAPT-Exosome 组外泌体数量显著减少(P<0.05,图4A~D)。然而Western blot没有检测到外泌体中JAG1蛋白(图4E)。但qRT-PCR结果显示,231-JAG1-Exosome组中靶向调控JAG1的LncRNA MALAT1显著上调(P<0.0001,图4F)。摄取实验提示外泌体能被单核细胞所摄取(图4G)。
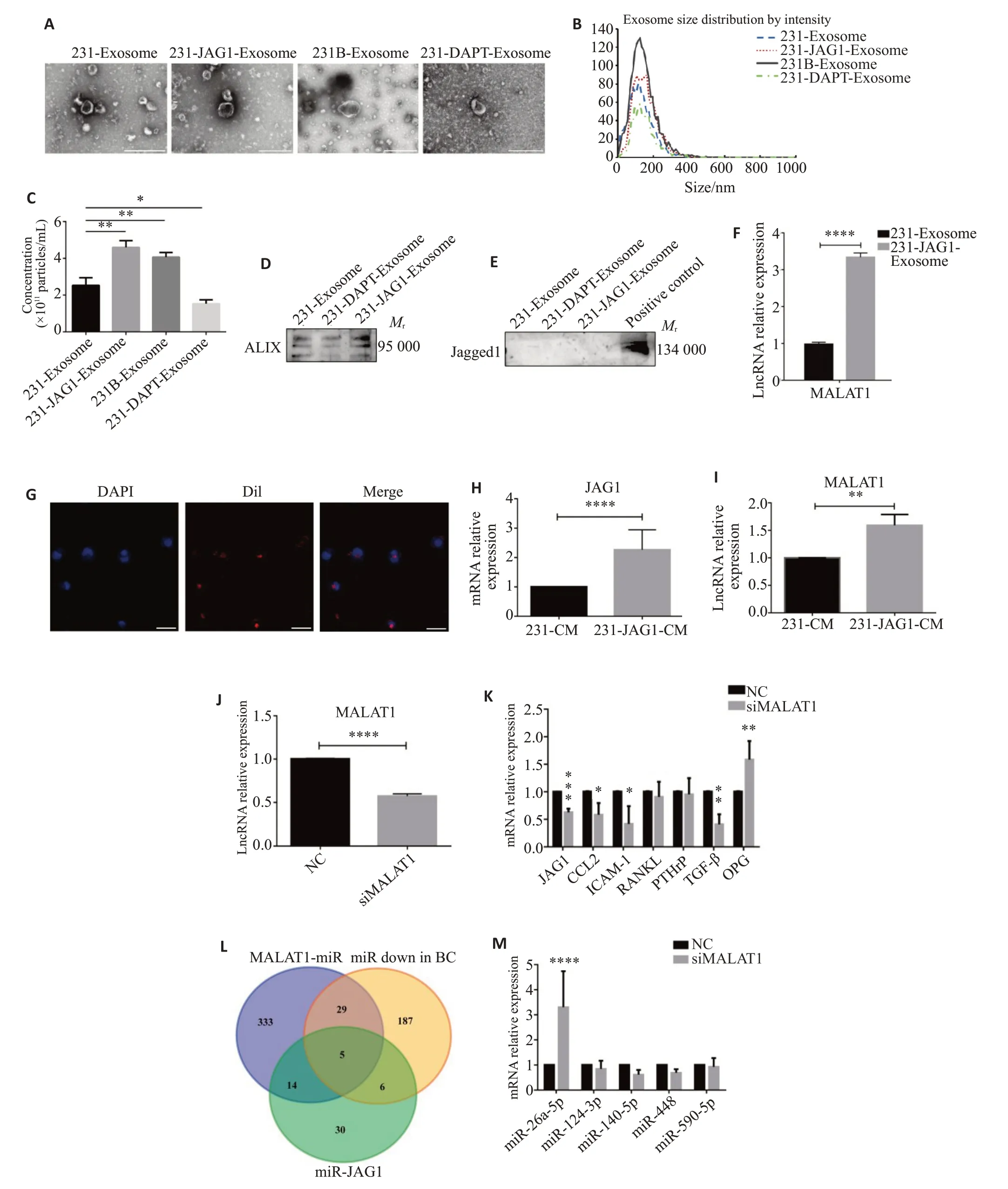
图4 JAG1通过TNBC外泌体中LncRNAMALAT1靶向miR-26a-5p影响单核细胞中JAG1表达Fig.4 JAG1 affects the expression of JAG1 in monocytes by targeting miR-26a-5p through LncRNA MALAT1 in TNBC exosomes.A: Exosome morphology observed under TEM.B,C: Diameter and number of exosomes analyzed by NTA.D: ALIX protein expression in exosomes detected using Western Blot.E:JAG1 protein expression in exosomes detected using Western blotting.F:LncRNA MALAT1 expression in exosomes detected using qRT-PCR.G: Monocyte exosome uptake assay.H,I: Expression of JAG1 and MALAT1 in monocytes treated with CM detected by qRT-PCR.J: Verification of interference effect of MALAT1.K:Expression of JAG1,CCL2,ICAM-1,RNAKL,PTHrP,TGF-β and OPG after siMALAT1 transfection detected by qRT-PCR.L:Down-regulated miRNAs targeted by MALAT1 and JAG1 in breast cancer searched in RNA interaction databases.M:Expression of miRNAs in monocytes after siMALAT1 transfection detected by qRT-PCR.A:Scale bar=500 nm.G:Scale bar=50 μm.*P<0.05,**P<0.01,****P<0.0001.

图5 JAG1高表达的TNBC促进单核细胞黏附、迁移和巨噬细胞分化的假想机制示意图模型Fig.5 Schematic model of the hypothesized mechanism by which TNBC with high expression of JAG1 promotes monocyte adhesion,migration,and macrophage differentiation.
231-JAG1-CM处理后单核细胞内JAG1mRNA显著升高(P<0.0001,图4H);进一步检测显示231-JAG1-CM处理后单核细胞内LncRNA MALAT1 表达显著增高(P<0.01,图4I);siMALAT1处理后单核细胞JAG1表达下降(P<0.001),同时ICAM-1(P<0.05)、CCL2(P<0.05)、TGF-β(P<0.01)表达下降,OPG(P<0.01)mRNA 表达水平显著升高(图4J、K)。
进一步通过ENCORI数据库和RNAInter数据库共找到381 个与MALAT1 相互作用的miRNA;在miRcancer数据库中筛选出227个在乳腺癌中表达下调的miRNA;使用R语言在7个miRNA靶向数据库中筛选到在3个及以上数据库中存在的且靶向调控JAG1的miRNA共55个。三者取交集,结果显示有5个候选miRNA,分别是miR-26a-5p,miR-124-3p,miR-140-5p,miR-448,miR-590-5p(图4L),但qRT-PCR 显 示siMALAT1处理单核细胞后仅miR-26a-5p表达显著增加(P<0.0001,图4M)。
3 讨论
TNBC占乳腺癌的10%~20%,其特征为雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER-2)均阴性,缺乏治疗靶点和伴随多器官转移是其预后差的主要原因[1,26]。PMN形成是乳腺癌等肿瘤远处转移的关键,其包括巨噬细胞、内皮细胞、成纤维细胞等细胞以及多种可溶性分子;外泌体直径为40~160 nm,被证实可以在细胞间转移大量的核酸和蛋白质从而介导细胞间的通讯,在PMN的形成中发挥重要作用[27],其建立支持性和接受性的肿瘤微环境,促进肿瘤细胞定植和转移[28]。另一方面,Notch信号的激活是包括乳腺癌在内的多种肿瘤的特点,其与肿瘤的生长、迁移和侵袭密切相关,是潜在的治疗靶点[29]。然而Notch信号具有明显的异质性,需要进一步探讨其在不同肿瘤亚型中的作用和机制。有研究者提出JAG1 能促进TNBC的远处转移[30,31],其还能通过直接接触调控肿瘤微环境中的血管内皮细胞、巨噬细胞、Treg细胞等[32-34],但JAG1与PMN是否有关尚未见报导。本研究中,我们拟在明确JAG1为TNBC侵袭分子的基础上,进一步研究JAG1升高的TNBC对PMN中单核-巨噬细胞的影响及其可能机制。
我们对公共数据库资料分析结果,一方面证实乳腺癌中JAG1 表达高于癌旁组织,同时还证实JAG1 mRNA高表达水平与TNBC的不良预后相关,我们动物体内实验证实JAG1 表达更高的侵袭株MDA-MB-231B,更容易发生远处转移,这与Yoneda 等[35]的结果一致,结合国内外相关研究[36-38],我们认为JAG1为TNBC较为确定的侵袭分子;那么JAG1对单核巨噬细胞有什么影响呢?我们首先采用rhJAG1处理相关细胞,通过单核-内皮黏附实验和Transwell等实验了解JAG1对单核细胞黏附和迁移的作用,研究结果显示JAG1可招募单核细胞,并影响单核细胞的分化;我们还发现JAG1能促进巨噬细胞向破骨分化,这与Ashley 等[39]的研究结果一致,支持JAG1可通过招募肿瘤微环境中单核细胞,影响其分化,促进肿瘤发生发展观点[40]。那么膜配体JAG1是否会影响PMN中的单核-巨噬细胞呢?我们使用TNBC条件培养基处理单核-巨噬细胞,结果显示:JAG1升高的MDA-MB-231-CM可以影响PMN中单核细胞的黏附、迁移和分化。由于外泌体已经被公认为是肿瘤细胞远处转移主要媒介,那么JAG1升高的MDAMB-231-CM是否是通过外泌体影响PMN中的单核-巨噬细胞呢?我们首先通过透射电镜、NTA、Western blot等多种方式证实JAG1的确能促进MDA-MB-231外泌体的分泌,这与Lin 等[41]认为Notch信号能促进外泌体分泌的结论相符合;我们首先考虑高表达JAG1 的TNBC通过外泌体包裹JAG1相关分子影响PMN中的单核细胞,然而我们在MDA-MB-231和JAG1升高的MDA-MB-231外泌体中没有检测到JAG1蛋白的表达;但是在JAG1升高的MDA-MB-231外泌体中检测到靶向调控JAG1的LncRNA MALAT1显著上调,因此,我们猜测高表达JAG1的TNBC是通过外泌体核酸形式影响PMN 中单核细胞JAG1 表达。为了证实这一猜想,我们进一步证实231-JAG1-CM处理后单核细胞内JAG1 mRNA 显著升高,同时LncRNA MALAT1 表达也显著增高,而siMALAT1处理后单核细胞JAG1表达下降,这一实验结果支持我们关于高表达JAG1 的TNBC通过外泌体中LncRNA上调靶细胞单核细胞中JAG1表达的猜想。由于LncRNA主要通过miRNA影响基因调控,因此,我们进一步通过生信分析筛选出能与LncMALAT1相互作用、在乳腺癌中表达下调,同时靶向JAG1的5个miRNA,最后通过qRT-PCR等实验证实LncMALAT1可能通过miR-26a-5p调控单核细胞中JAG1基因表达,进而影响单核细胞黏附、迁移和分化。
综上所述,本研究在证实文献中报道的高表达JAG1的TNBC可能通过直接影响肿瘤微环境中单核细胞数量和分化等影响肿瘤侵袭性的基础上,进一步探讨高表达JAG1的TNBC是否通过外泌体影响PMN的单核细胞及其可能的机制。我们研究结果提示JAG1升高的MDA-MB-231细胞可以通过外泌体中LncRNA MALAT1,调控PMN中单核细胞中的miR-26a-5p,使单核-巨噬细胞的JAG1表达升高,从而影响单核细胞的黏附、迁移和分化,进而重塑PMN达到远处转移的目的。这一结果进一步丰富了JAG1促进TNBC转移的可能机制,为TNBC诊疗提供了新思路和靶点。但因各种原因,本研究仅使用了重组蛋白JAG1和DAPT进行相关研究,且LncMALAT1/miR-26a-5p/JAG1的调控轴尚需要更多的实验加以证实,我们将在后继研究加以完善,并探讨相关外泌体核酸是否有早期诊断TNBC远处转移的价值。