胰腺癌细胞的异质性和肿瘤细胞分子亚型鉴定:基于CEACAM5、LGALS1和CENPF基因表达
孙敬杰,卢 鹏,管莎莎,刘淞淞
中国人民解放军总医院海南医院1肿瘤内科,2肝胆外科,海南 三亚572013
胰腺癌是最致命的恶性肿瘤之一,自20世纪60年代以来,胰腺癌的存活率基本尚未提升[1,2]。由于胰腺癌通常在晚期才得以诊断,且大多数治疗方案效果欠佳,导致患者总体预后不良[3,4]。多种因素与患者的不良预后相关,如性别、年龄、肿瘤分期、营养状况、基础疾病等[5]。然而,各胰腺癌患者恶性程度不一的原因还未完全阐明。
胰腺癌在发展过程中涉及了大量细胞丰度改变和基因表达的变化,这造成了肿瘤的高度异质性[6,7]。同时,胰腺癌相较于其他肿瘤更高的异质性也是造成该病难以规范化诊疗的重要原因[8,9]。在胰腺癌进展中部分基因可能对肿瘤的增殖、侵袭及迁移功能有重要促进或抑制作用,提示是该病治疗的潜在靶点。寻找并鉴定胰腺癌细胞的特殊分子亚型,对肿瘤发展过程中关键分子的寻找有明显帮助,也对疾病的个性化治疗和疗效的提高有较大意义。
因此,本文利用了数据库已有的单细胞测序数据,分析了胰腺癌细胞异质性情况和各类群特征基因,鉴定了胰腺癌细胞在发展过程中的不同亚型和不同的潜在功能,并结合临床样本基因与蛋白表达情况及患者预后信息,探讨肿瘤细胞分子亚型鉴定新方法,并寻找胰腺癌发展过程中的特征基因,最后对所鉴定的不同亚型胰腺癌的特征基因进行增殖、侵袭和迁移等功能实验验证,为胰腺癌潜在治疗靶点的寻找提供了新的依据。
1 资料和方法
1.1 研究对象
本研究从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)提取了GSE155698数据集中16个胰腺癌原癌组织单细胞测序样本,共分析了48 570 个细胞的28 411个基因的表达情况。同时,本研究纳入了癌症基因组图谱179例胰腺癌患者和正常胰腺组织基因表达库中171例正常人,分别提取各研究对象的基因表达数据、临床信息及预后情况。
1.2 单细胞数据初步聚类和提取肿瘤细胞
将下载的单细胞测序样本进行预处理,重命名、合并样本。读入R(版本号4.0.4)软件,载入Seurat包,创建对象,去除检测到基因数目超过2500或低于200的细胞,去除单个细胞中线粒体基因数目占比超过>5%的细胞。标准化数据,鉴定高变基因,并进行PCA分析。由于UMAP在分群过程中考虑了每一群细胞相似基因表达的特征,也保留了了数据的全局结构,因此选用UMAP聚类,并初步分析细胞聚类情况和各类群特征基因。根据细胞表面标志物EPCAM、PTPRC、PECAM1等基因的表达情况,去除免疫细胞、基质细胞等,提取肿瘤细胞进行后续分析。
1.3 分子亚型分析和特征基因鉴定
对所提取的到的肿瘤细胞进行分子亚型分析,对细胞基因表达矩阵标准化后,鉴定高变基因,利用UMAP对肿瘤细胞的基因表达谱进行二次降维、细胞类型注释。利用FindAllMarkers函数根据差异倍数和P值计算每个亚型肿瘤细胞的特征基因,min.pct参数设置为0.25,logfc.threshold参数设置为0.5,最终得到各亚型的特征基因。
1.4 通路富集分析
使用WEB-based GEne SeTAnaLysis Toolkit(http://www.webgestalt.org)进行GO 和KEGG 通路富集分析。分别输入各亚型特征基因,分别与GO和KEGG数据库中通路进行比对和富集,计算富集分数和FDR值,按照富集分数由高到低排序,并利用条形图可视化。
1.5 发育轨迹分析
利用拟时序分析方法寻找各亚型细胞发育轨迹。使用monocle3包进行拟时序分析,按照前述步骤对胰腺癌细胞基因表达矩阵进行降维、聚类和分群,运行monocle进行拟时序分析,推断发育轨迹,检测关键特征基因在各分子亚型的细胞中的表达变化趋势。
1.6 基因表达分析与检测
胰腺癌组织和正常胰腺组织的基因表达检测采用GEPIA2(http://gepia2.cancer-pku.cn/#index),生存分析使用Kaplan-Meier Plotter(http://kmplot.com/analysis/)分析工具,胰腺癌组织中蛋白表达检测参照人类蛋白表达图谱(The Human Protein Atlas project,https://www.proteinatlas.org)。
1.7 qRT-PCR实验
引物通过NCBI在线设计,并经BLAST验证产物特异性。引物长度范围在16~24 个碱基对,Tm值约60 ℃,选择GC含量在40%~60%,由重庆擎科生物公司合成。使用PrimeScript RT试剂盒子和SYBR Premix Ex Taq™试剂盒(Takara,日本)进行反转录及荧光定量反应。采用2-ΔΔCt法计算mRNA相对表达量,并归一化至GAPDH 表达量。CEACAM5 前后引物分别为GGACTTTCCAGCAATCCACC、GGGCTTGGCACG TATAGGAT;LGALS1 前后引物分别为GACGC TAAGAGCTTCGTGCT,CGTTGAAGCGAGGGTTG AAG;CENPF 前后引物分别为TCTCCGAGAGGTCG TTTTCC,AGCTGAAACTGCCTTTGCTG。
1.8 载体构建与细胞转染
构建目标基因的siRNA片段,其中基因CEACAM5靶序列5-GCCGCAAUAAUUCCAUAGU-3;基因CENPF 靶序列5-GTTTCAGCTTGACAGTC TCG-3;基因LGALS1 靶序列5-ACCUGUGCCUACACUUC AA-3(吉玛基因)。取生长状态良好的细胞行siRNA转染操作。细胞接种密度使其第2天汇合度50%~70%为宜,接种后继续培养。第2天进行转染操作:向无酶无菌的1.5 mL Eppendorf管加入125 μL Opti-MEM培养基和5 μL Lipofectamine 3000(Invitrogen),充分混匀(A),静置5 min。向无酶无菌的1.5 mL Eppendorf管中分别加入125 μL Opti-MEM培养基和5 μL siRNA或阴性对照,混匀(B),静置5 min。将上述AB溶液混合,静置10~20 min。将转染混合液均匀加入6孔板中,放入培养箱培养。转染过后的细胞用来做qPCR检测以及行细胞功能实验。
1.9 细胞增殖实验
细胞转染24 h 可行细胞活力CCK8(索莱宝)和EdU(锐博)的检测。对于CCK8实验,每孔加入10 μL CCK8试剂,孵育2.5 h。用酶标仪测量细胞的吸光度A450nm并记录。连续测量4 d细胞活性。对于EdU实验,按照EdU标记、细胞固定、Apollo 染色、细胞核DNA染色、荧光检测步骤以此完成实验操作。
1.10 细胞迁移和侵袭实验
细胞转染48 h后,行细胞transwell迁移和侵袭实验。对于迁移实验,细胞接种个数调整至5×104/孔;对于侵袭实验,细胞接种个数调整至8×104/孔,接种前小室中预先加入培养基稀释后的Matrigel 30 μL(Corning),放入细胞培养箱中孵育1~2 h。16~24 h后取出孔板中的小室(MERCK),用细胞固定液(碧云天)固定15 min后,放入1%的结晶紫(索莱宝)染料中,染色,约5~10 min。染色完成后立即放入PBS中清洗干净,干燥后于显微镜观察拍照。
1.11 统计学分析
使用SPSS 20.0进行统计学分析,组织基因表达差异分析比较采用Wilcoxon非参数秩和检验,细胞功能实验中两组间差异比较采用t检验,生存分析使用Kaplan-Meier法,P<0.05时认为差异具有统计学意义。单细胞数据分析采用Seurat 包,归一化采用harmony包,细胞发育轨迹分析采用monocle3包。
2 结果
2.1 胰腺癌原癌组织细胞初步聚类情况
利用UMAP对16个胰腺癌原癌组织单细胞样本的48570个细胞进行分析后发现,细胞总共被聚类为22群(图1A)。部分类群间所处空间位置紧密,如0群和2群细胞,提示这些类群的细胞可能有相同或相近的基因表达模式;部分类群间所处空间位置相隔较远,提示这些类群的细胞基因表达模式可能有明显差异,具有不同的生物学功能,如14群和16群。对各类群特征基因进行鉴定(图1B),发现各类群细胞的基因表达模式有明 显差异,如:0 群主要高表达S100A8、S100A9 和S100A12;1群细胞高表达IL7R、GIMAP7和LTB;3群细胞高表达SPP1、RNASE1和CSTB。
2.2 鉴定和分析胰腺癌原癌组织中的肿瘤细胞
根据细胞表面标志物EPCAM、PTPRC、PECAM1等基因的表达情况,利用人工标注的方法鉴定免疫细胞、基质细胞和肿瘤细胞等。去除免疫细胞、基质细胞,提取肿瘤细胞。鉴定发现4、9、11、12和20群细胞高表达EPCAM(图2A),共2010个细胞,提示这些细胞为肿瘤细胞,因此将其进行后续分析。这些类群的细胞高表达KRT19、PMEPA1、ITGB4、S100A16和KRT7等基因(图1B)。将提取的肿瘤细胞使用UMAP再聚类,共将其分为3类:亚型1、亚型2和亚型3(图2B),各亚型间整体基因表达模式有明显差异。
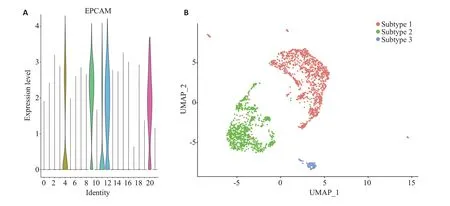
图2 鉴定和分析胰腺癌原癌组织中的肿瘤细胞Fig.2 Identification and analysis of tumor cells in pancreatic cancer primary tumor tissue.A:Expression of the tumor marker EPCAM in different cell clusters.B:UMAP clustering of extracted tumor cells.
2.3 不同亚型胰腺癌细胞的分子特征分析
分别分析亚型1、亚型2 和亚型3 胰腺癌细胞的基因表达情况(图3A),发现亚型1 主要高表达CEACAM5、CD55、CEACAM6、S100P、CLDN18、LMO7、TFF1、SPINK1 等基因;亚型2 主要高表达RPL32、RPS18、RPL13、RPS4Y1、LGALS1、RPS3A、PMEPA1、NNMT、KRT19 等基因;亚型3 主要高表达MKI67、CENPF、ASPM、CDKN3、TOP2A、UBE2C、CDK1、BIRC5、PTTG1等基因。3种亚型的胰腺癌细胞有完全不同的基因表达模式,提示各类细胞的发展可能有明显不同。通过进一步分析发现CEACAM5、LGALS1、CENPF分别在亚型1、亚型2和亚型3胰腺癌细胞中高表达(图3B~D)。
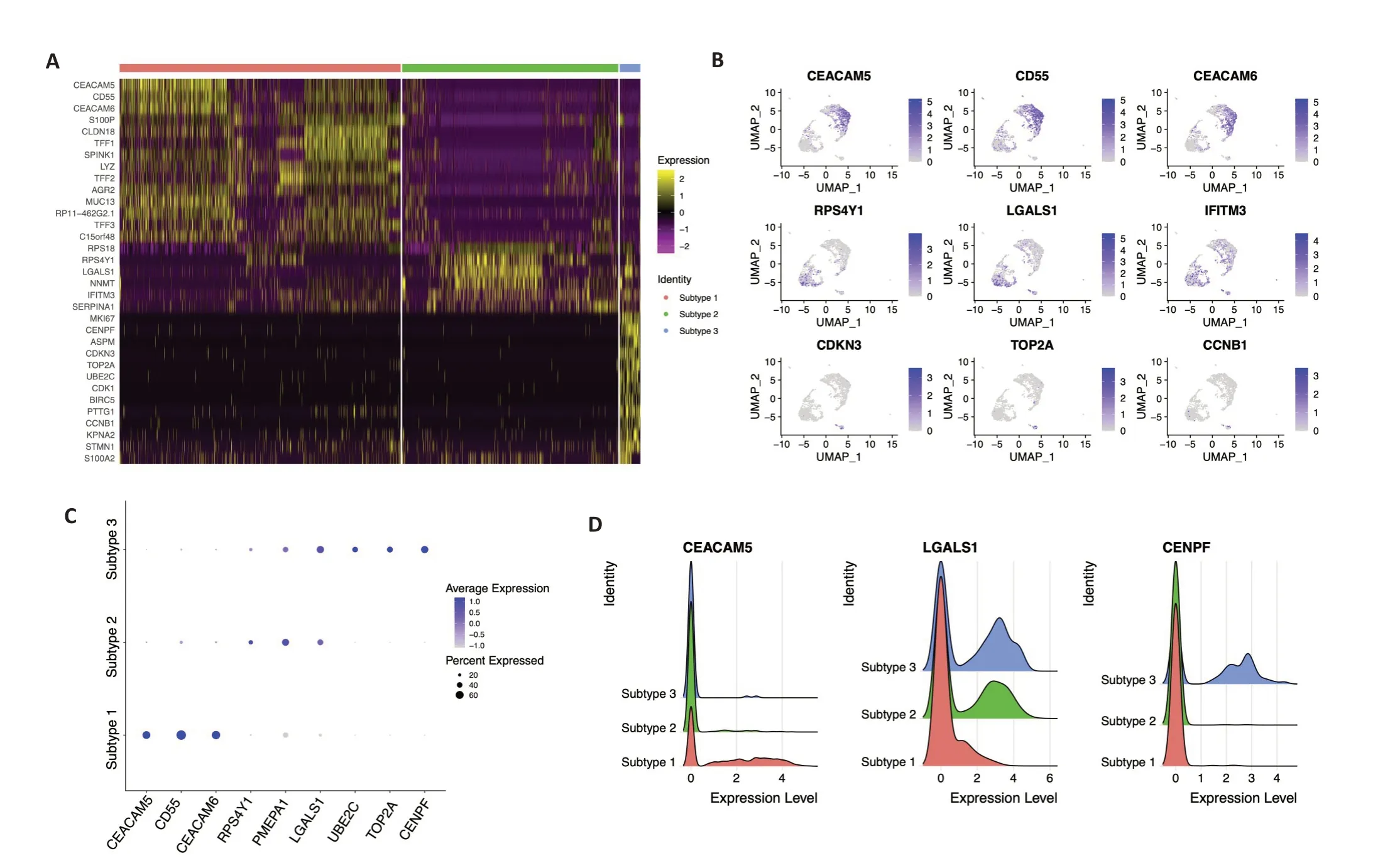
图3 不同亚型胰腺癌细胞之间的分子特征分析Fig.3 Molecular feature analysis of different subtypes of pancreatic cancer cells.A: Heatmap of gene expression in different subtypes of pancreatic cancer cells;B:Gene mapping diagram;C:Scatter plot of gene expression;D:Peaks and valleys plot of gene expression.
2.4 各亚型胰腺癌细胞特征基因功能分析
亚型1胰腺癌细胞的特征基因主要富集于蛋白代谢过程的负调节、铁死亡和抗原提呈相关通路(图4A、B);亚型2胰腺癌细胞的特征基因主要于肽合成过程、翻译和核糖体相关通路(图4C、D);亚型3胰腺癌细胞的特征基因主要富集于ATP代谢过程、糖酵解/葡萄糖生成和细胞周期相关通路(图4E、F)。
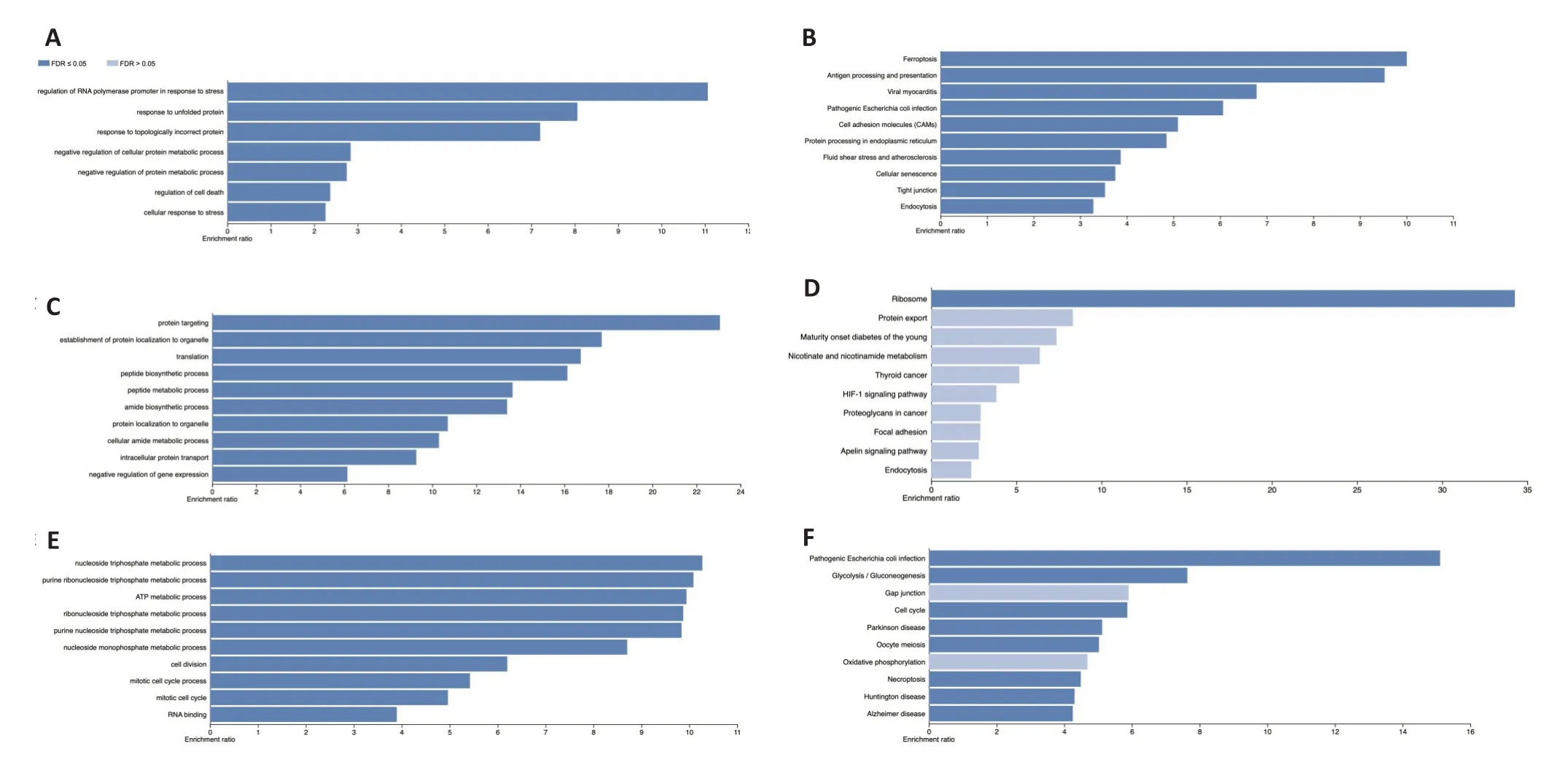
图4 通路富集分析Fig.4 Pathway enrichment analysis.A: GO enrichment analysis of characteristic genes in Subtype 1;B: KEGG pathway enrichment analysis of characteristic genes in Subtype 1;C:GO enrichment analysis of characteristic genes in Subtype 2;D:KEGG pathway enrichment analysis of characteristic genes in Subtype 2;E:GO enrichment analysis of characteristic genes in Subtype 3;F:KEGG pathway enrichment analysis of characteristic genes in Subtype 3.
2.5 不同亚型胰腺癌细胞的发育轨迹分析
图5A、B显示亚型2和亚型3胰腺癌细胞可能是由亚型1发展而来,且亚型3可能是胰腺癌细胞发育的最终状态。其中,各亚型的关键特征基因CEACAM5、LGALS1、CENPF的表达情况也在发育轨迹中展现了不同状态,提示这些基因在胰腺癌发展过程中可能起关键作用(图5C)。
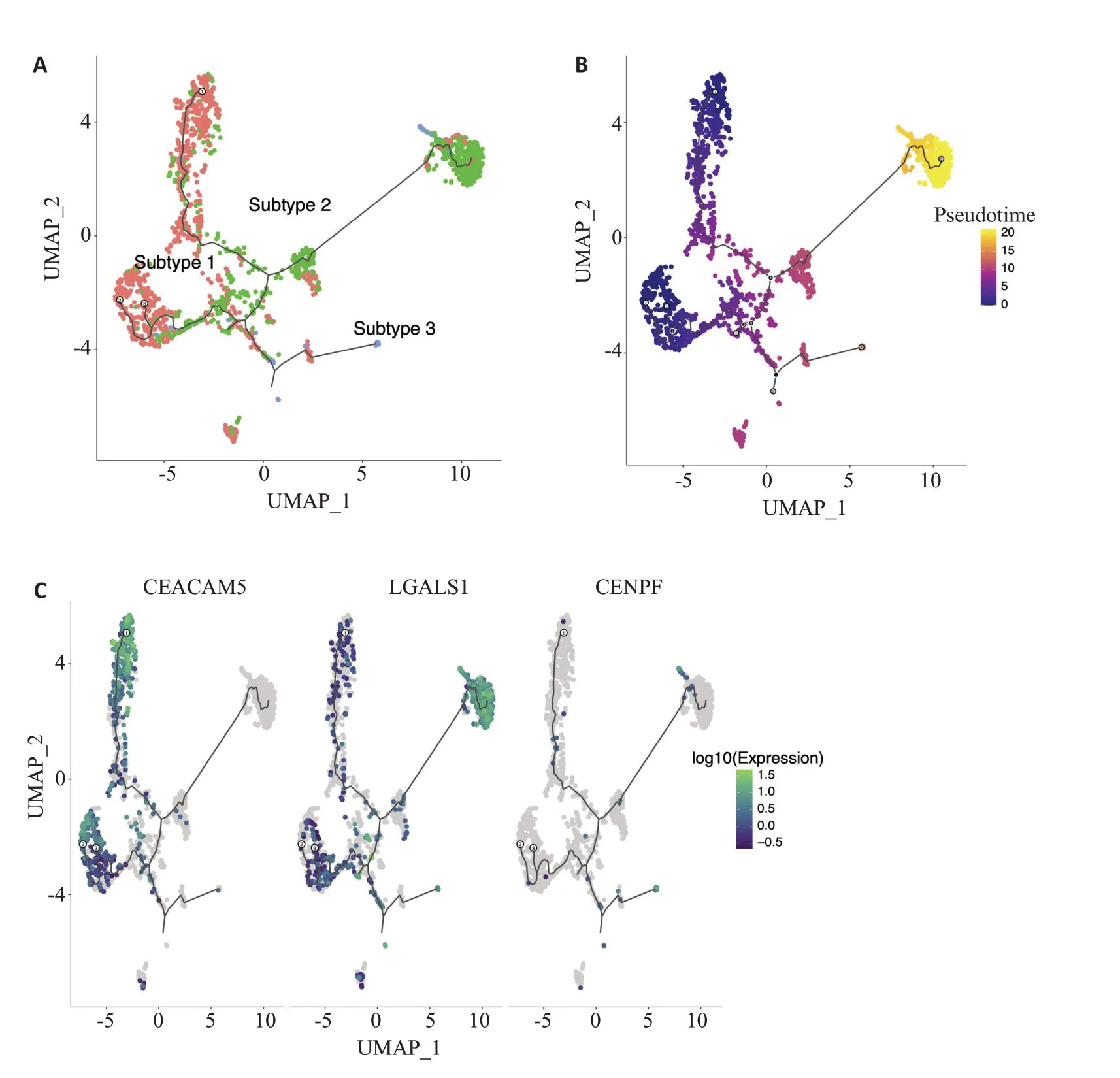
图5 胰腺癌细胞发育轨迹分析Fig.5 Developmental trajectory analysis of pancreatic cancer cells.A: Pseudo-time analysis based on subtypes;B:Pseudo-time analysis based on time;C: Pseudo-time analysis based on molecular expression.
2.6 各亚型肿瘤的基因表达和临床相关性分析
Kaplan-Meier Plotter工具使用自由度高、能自动选择最优的分组策略,根据基因表达量对患者进行最优分组,得以寻找到各基因的最佳临界值。高表达CEACAM5(P=0.049)、LGALS1(P=0.009)、CENPF(P<0.001)的胰腺癌患者有明显较差的预后(图6A~C)。同时,CEACAM5、LGALS1、CENPF基因在胰腺癌组织中的表达量均高于正常胰腺组织(P<0.05,图6D~F)。
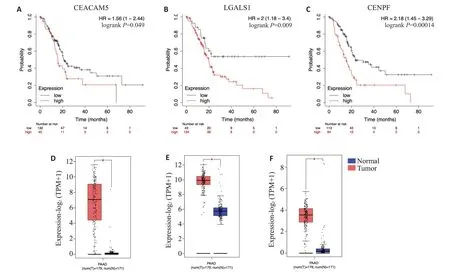
图6 各亚型肿瘤的基因表达和临床相关性分析Fig.6 Analysis of gene expression and clinical relevance in different tumor subtypes.A: Relationship between CEACAM5 gene expression and survival prognosis of pancreatic cancer patients.B:Relationship between LGALS1 gene expression and survival prognosis of pancreatic cancer patients.C:Relationship between CENPF gene expression and survival prognosis of pancreatic cancer patients.D:Expression of CEACAM5 gene in pancreatic cancer tissue compared to normal pancreatic tissue.E:Expression of LGALS1 gene in pancreatic cancer tissue compared to normal pancreatic tissue.F:Expression of CENPF gene in pancreatic cancer tissue compared to normal pancreatic tissue.*P<0.05.
2.7 胰腺癌组织中各亚型关键分子蛋白表达分析
利用蛋白表达数据库(The Human ProteinAtlas)胰腺癌组织中对各亚型关键特征分子蛋白表达情况进行了检测,发现与基因表达情况一致,各胰腺癌组织中亚型的关键特征基因CEACAM5、LGALS1、CENPF均高表达(图7)。
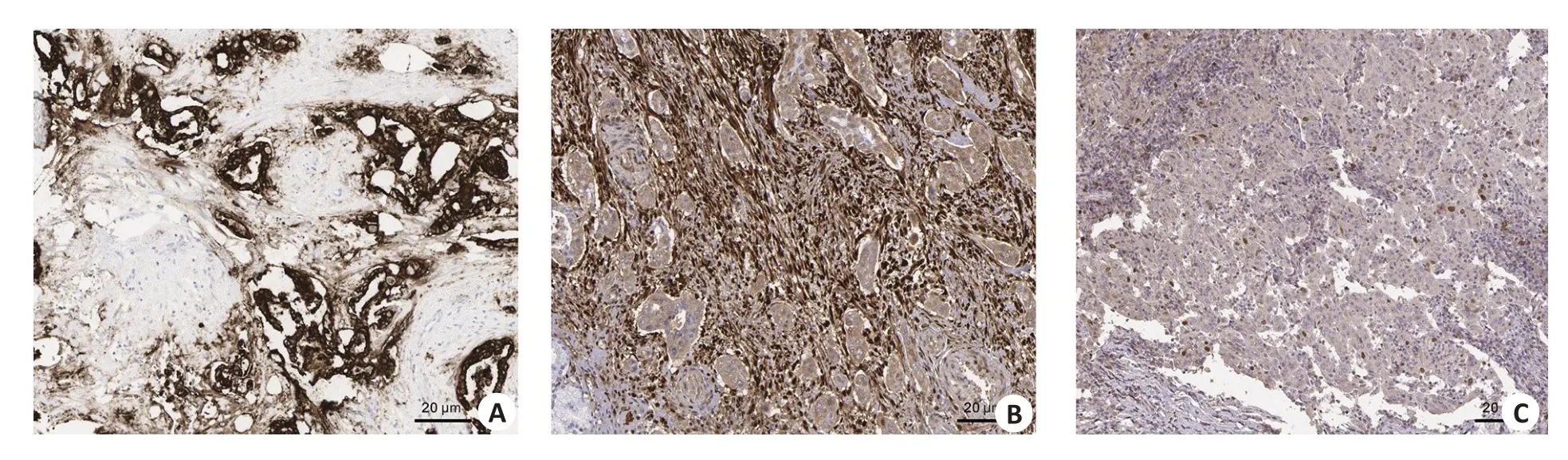
图7 胰腺癌组织中各亚型关键分子蛋白表达分析Fig.7 Analysis of key molecular protein expression in different subtypes of pancreatic cancer tissue (Immunohistochemical staining,original magnification:×40).A: CEACAM5 protein expression.B: LGALS1 protein expression.C: CENPF protein expression.
2.8 CEACAM5、LGALS1、CENPF对胰腺癌细胞的增殖、侵袭与迁移等功能的影响
通过qRT-PCR检测三者在5株胰腺癌细胞系和正常胰腺导管上皮细胞中的表达水平(图8A~C),其中CEACAM5在BXPC-3细胞中表达最高,而LGALS1和CENPF在PANC-1细胞中表达最高。因此我们主要选择这2株细胞分别行功能沉默实验。采用特异性的siRNA转染后,验证了相应的干扰水平,发现其能有效干扰靶基因的mRNA表达(图8D~F)。
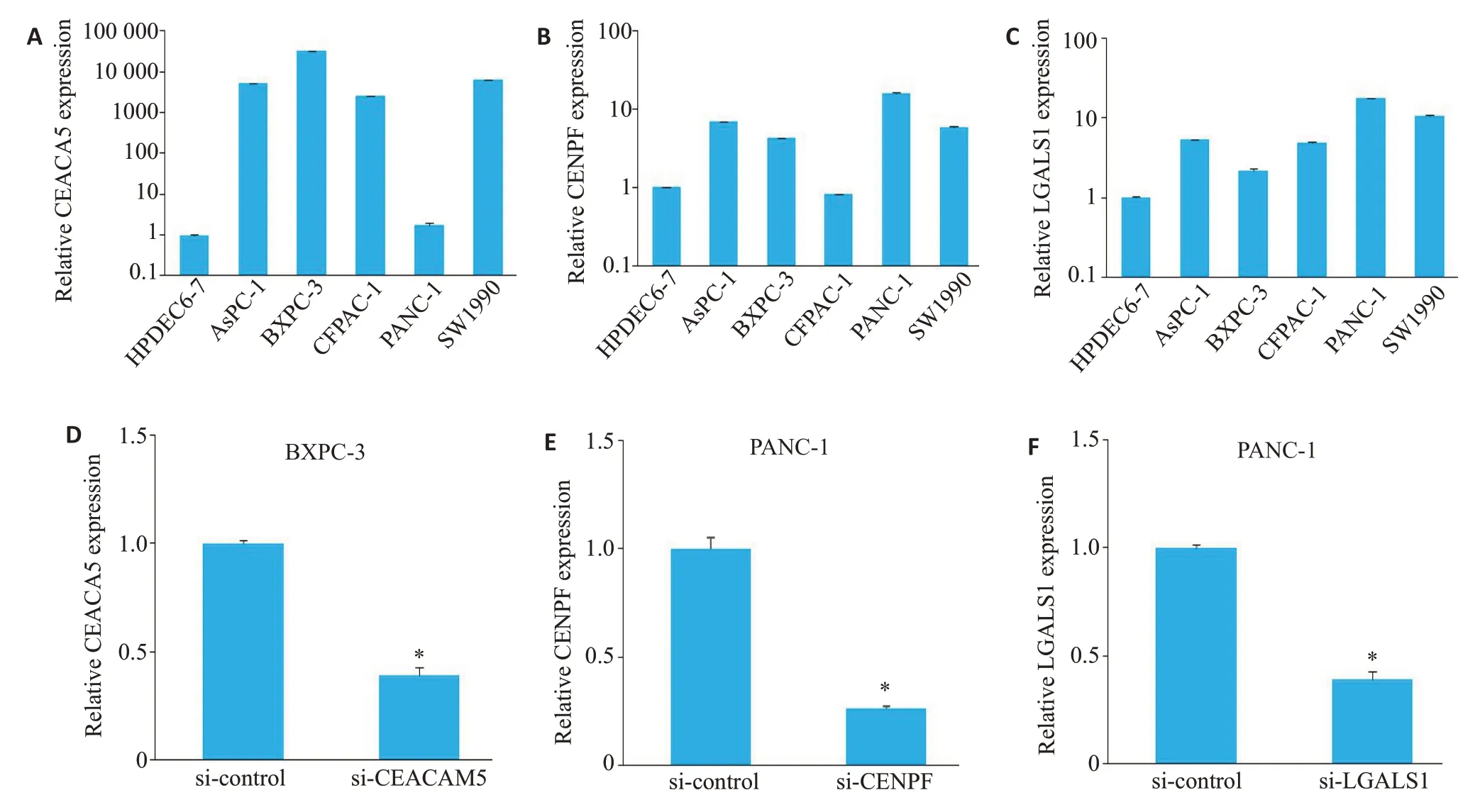
图8 CEACAM5、LGALS1、CENPF在胰腺癌细胞的表达Fig.8 Expressions of CEACAM5,LGALS1 and CENPF in pancreatic cancer cells.A:CEACAM5 expression in Pancreatic cancer cell lines and HPDEC6-7.B: CENPF expression in pancreatic cancer cell lines and HPDEC6-7.C: LGALS1 expression in pancreatic cancer cell lines and HPDEC6-7.D: qRT-PCR analysis of BXPC-3 cells with siRNA-mediated CEACAM5 knockdown.E:qRT-PCR analysis of PANC-1 cells with siRNA-mediated CENPF knockdown.F:qRT-PCR analysis of PANC-1 cells with siRNA-mediated LGALS1 knockdown.*P<0.05.
我们将在敲低后的细胞中完成细胞增殖和侵袭迁移等相关的功能学实验。其中,CCK8和EdU实验表明(图9),敲低胰腺癌细胞系中的相关基因后,癌细胞的生长活性明显受到抑制和细胞的增殖能力降低。Transwell 迁移和侵袭实验(图10)结果显示,当CEACAM5、LGALS1、CENPF的表达下调后,胰腺癌细胞的迁移和侵袭能力均被抑制。
3 讨论
胰腺癌是一种异质性极高的消化系统恶性肿瘤,这种异质性可能是造成不同患者疗效各异、生存预后不同的原因[10]。由于不同胰腺癌细胞在最初的发育过程中可能具有完全不同的基因表达模式,引起各肿瘤细胞分别向不同类型的细胞分化,形成具有不同生物学功能的细胞亚型,最终导致胰腺癌的高度异质性[11,12]。特异性靶向治疗胰腺癌发展过程中的特定细胞亚型,如高增殖性亚群、高侵袭性亚型,可能有较好的治疗疗效[13]。然而,胰腺癌发展过程中所涉及的具体分子生物学机制和基因表达模式还未完全阐明。因此,鉴定引起胰腺癌异质性的特征基因,并据此分子特征进行分型,对胰腺癌的精准诊断和个体化治疗方案的制定有重大意义。
胰腺癌肿瘤微环境由大量内皮细胞、肿瘤相关成纤维细胞、免疫细胞和癌细胞等细胞组成[14]。其中,不同患者间质细胞和免疫细胞的差异大大增加了胰腺癌肿瘤异质性[15]。我们对16例胰腺癌样本48 570个细胞进行分析后发现,细胞总共被聚类为22群,其中包含5群胰腺癌细胞。肿瘤微环境内非肿瘤细胞亚群的鉴定和分析有助于阐明机体对肿瘤细胞的差异性杀伤作用,也有利于新型靶向免疫治疗药物的开发。
最新的研究报道,导管细胞源性和腺泡细胞源性肿瘤特征分别富集于人类胰腺癌的基底样亚型和经典亚型,且起源细胞是影响胰腺癌分子亚型的一个因素,是癌症发生中最早的事件,对癌症演变产生着根本影响[16]。由此可见,胰腺癌细胞分子亚型的精确分型有至关重要的意义。我们通过对胰腺癌细胞进行再降维分析,我们发现了3个亚型:亚型1、亚型2和亚型3,这些亚型分别具有完全不同的基因表达模式和功能。亚型2和亚型3可能是由亚型1发展而来,亚型3可能是胰腺癌细胞发育的最终状态。亚型1胰腺癌细胞与蛋白代谢过程的负调节、铁死亡和抗原提呈等过程相关;亚型2胰腺癌细胞与肽合成过程、翻译和核糖体等过程相关;亚型3胰腺癌细胞与ATP代谢过程、糖酵解/葡萄糖生成和细胞周期等过程相关。这些结果表明不同亚型可能是胰腺癌细胞发展的不同阶段,且具有相应高增殖、高基因表达活性等功能,特异性抑制某个重要阶段亚型胰腺癌细胞的生长可能会降低胰腺癌的发展速度。
胰腺癌在发展的过程中涉及多种基因表达的改变,包括促癌基因的高表达和抑癌基因的低表达,这些基因表达的变化可能预示着癌症的发展或肿瘤细胞功能的变化,从而形成不同的肿瘤亚型[17,18]。研究报道,EZH2能通过转录抑制GATA6调节胰腺癌亚型识别和肿瘤进展[19]。基于抑制SUMO通路活性的治疗手段对一种侵袭性胰腺癌亚型可能有较好的治疗效果[20]。我们在基因和蛋白表达层面均发现各亚型的关键特征基因CEACAM5、LGALS1、CENPF在胰腺癌中高表达,且与患者的不良预后相关。各亚型的关键特征基因CEACAM5、LGALS1、CENPF的表达情况也在发育轨迹中展现了不同状态。胰腺癌特征基因的鉴定有利于肿瘤治疗靶点的寻找[21-23]。我们结果提示CEACAM5、LGALS1、CENPF等关键特征基因在胰腺癌不同发展过程中可能有重要作用,可能作为该病发展不同阶段潜在的治疗靶点。
综上所述,本研究利用单细胞测序数据分析了胰腺癌细胞异质性情况和各类群特征基因,鉴定了胰腺癌细胞在发展过程中的不同亚型和不同的潜在功能,并结合临床样本基因与蛋白表达情况及患者预后信息,发现了胰腺癌细胞的3 种分子亚型,其关键特征基因是CEACAM5、LGALS1、CENPF,并在临床样本中得以证实。不同亚型代表着肿瘤细胞发展的不同时期,具有完全不同的特征。