食源性抗血栓活性肽的研究进展
李汉琪,王治军,郑清瑶,曹文红,2,*,陈忠琴,2,林海生,2,高加龙,2,郑惠娜,2
(1.广东海洋大学食品科技学院,国家贝类加工技术研发分中心(湛江),广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,广东省海洋生物制品工程实验室,水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;2.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
血栓栓塞及其后遗症在全世界的发病率和死亡率居高不下[1]。年龄增长导致血栓性疾病发生风险上升[2],伴随着人口老龄化趋势加剧,对抗血栓性疾病的形势日益严峻。根据世界卫生组织2021年6月的统计结果,血栓诱发的缺血性心脏病和中风是心血管疾病的两大主要组成部分,累计造成1 790万人死亡,占2019年全球死亡人数的32%。其发病机制为血栓或栓塞在形成部位与血管壁分离并随血流移动,导致栓塞部位的组织损伤甚至梗死[3]。根据血栓和血管疾病的病理生物学特征,将抗血栓药物分为三大类,即抗凝剂、抗血小板药物和溶栓剂。抗凝治疗是临床医学预防和治疗血栓性疾病的重要手段[4],通过抑制机体的凝血功能,以延缓血栓的形成和扩张,降低血栓性疾病的发生率,预防溶栓治疗后的复发。目前美国食品药品监督管理局批准的抗凝剂有4 类:1)肝素,包括低分子肝素;2)VK拮抗剂,如华法林;3)直接凝血酶抑制剂,如比伐卢定和达比加群酯;4)直接活化凝血因子(actived blood coagulation factor X,FXa)抑制剂,如阿哌沙班、依多沙班和利伐沙班[5]。抗凝药物的副作用会引起一系列并发症,已出现如出血性大疱皮炎[6]、胸髓内出血[7]、血小板减少症[8]等病例报告,因此需要寻找更安全的抗凝药物。
生物活性肽通常由2~20 个氨基酸残基组成,能够发挥超出其亲本蛋白质营养价值的有益生物活性[9];其具有一系列的优势,包括低毒性和免疫原性、良好的溶解性、不同的组织分布模式、优良的药代动力学表现[10-11]。食源性生物活性肽是指从体外摄取,直接或间接来源于食物蛋白质的功能性肽。因为食源性活性肽具有安全性高和原料来源广泛易得的优势,目前在营养和食品科学领域受到高度关注[12]。近年来,已有研究报道了以各种食源性蛋白制备的抗血栓活性肽,包括大豆蛋白肽[13]、牡蛎蛋白肽[14]和苋菜蛋白肽[15]等,在体外以及动物实验中均表现出良好的抗凝血效果。在抗血栓治疗药物及功能性食品的研发领域,食源性抗血栓肽有着广阔的应用前景。本文针对食源性抗血栓肽的蛋白来源、制备分离纯化、抗凝血活性评价及作用机制进行综述,以期为未来深入研究开发新型抗凝类血栓药物及血管健康功能性食品提供参考。
1 食源性抗血栓肽的蛋白来源
1.1 食源性抗血栓肽的蛋白来源
蛋白质既是人体必需氨基酸的来源也是生物活性肽的来源,具有特殊氨基酸序列的特定肽段被称为生物活性肽,一旦从母体蛋白中释放出来就会具有相应的生物学效应[16]。近年来,血栓导致的心血管疾病的发病率不断上升,抗血栓活性肽的研究也逐渐成为热点。
食源性抗血栓活性肽绝大多数是从食源性蛋白质中通过一定方法提取制备的。根据现有研究结果,制备食源性抗血栓活性肽的蛋白根据来源主要分为三大类——动物蛋白、植物蛋白、海洋生物蛋白,其中食源性抗血栓肽的动物蛋白来源包括酪蛋白[17]、药用水蛭蛋白[18]、鸡冠肉蛋白[19]等;植物源抗血栓活性肽的蛋白来源有大豆蛋白[20]、花生蛋白[21]等;海洋源抗血栓活性肽的蛋白来源有牡蛎蛋白[14]、贻贝蛋白[22]、虾虎鱼肌肉蛋白[23]、紫菜蛋白[24]等。Tu Maolin等[25]通过模拟胃肠道消化乳铁蛋白,在其水解物中鉴定出一种多肽——ENLPEKADRD,该多肽具有体外抗凝血活性。Liu Hanxiong等[17]分离、纯化酪蛋白水解物后,对其中具有体外抗血栓活性的组分进行多肽序列鉴定并结合分子对接技术评估活性,得到6 种抗凝血多肽(FRQFYQL、NENLLRF、NPWDQVKR、PVVVPPFLQ、PVRGPFPIIV、ARHPHPHLSF)。海洋生物生活在复杂的栖息地并暴露于极端条件下,例如高盐度、高压力、低温度和弱光照,极端环境条件导致它们会产生多种在其他陆地生物体中未发现的次生代谢物,与陆地生物蛋白相比,海洋生物蛋白的氨基酸构成和序列存在显著差异[26],因此海洋生物蛋白具有制备新型生物活性肽的潜力。Jo等[27]从海洋蠕虫中分离到一种特异性靶向凝血因子FIXa的抑制肽(UAP),并鉴定出其氨基酸序列为GELTPESGPDLFFHFLDGNPSYSLYADAVPR(分子质量3 343 kDa),发现其可有效延长活化部分凝血活酶时间(activated partial thrombin time,APTT)。Cheng Suzhen等[28]从牡蛎蛋白胃酶水解物中分离并鉴定了一种新型食源性抗凝剂七肽(P-3-CG)。由表1可知,目前食源性抗血栓肽主要以动植物蛋白和海洋生物蛋白为原料加工提取。虽然鲜有以食源性微生物蛋白提取抗血栓活性肽的相关研究,但从食源性微生物蛋白质中获得抗血栓活性肽具有潜在研究价值。
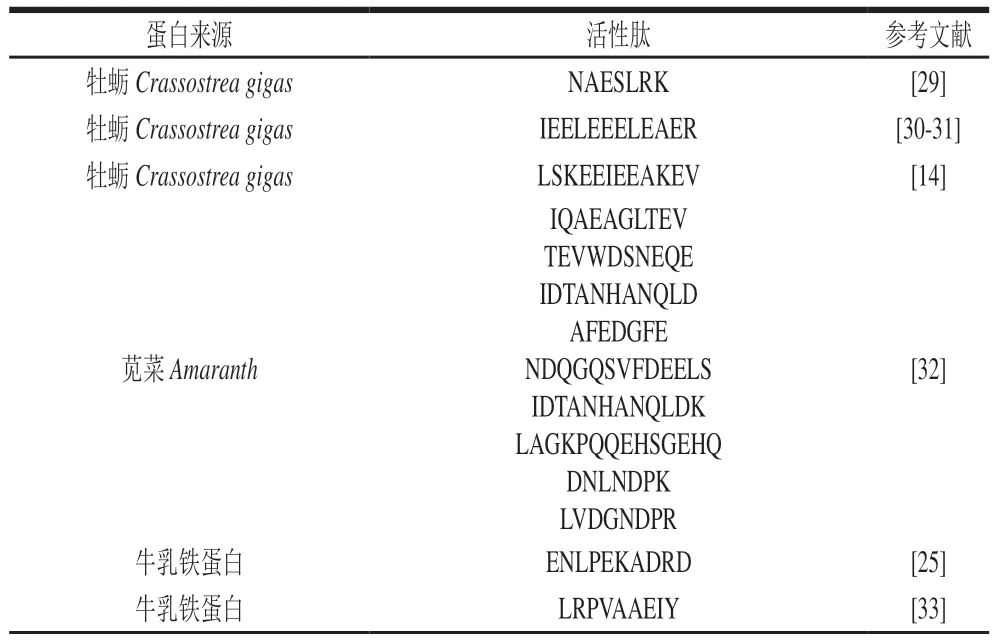
表1 食品蛋白来源的抗血栓肽Table 1 Antithrombotic peptides derived from food proteins
此外,随着工业的快速发展,大量生产废料产生,例如商业鱼类生产和海产品加工会产生大量含氮废料,从而造成繁重的处理问题和环境问题[40]。鱼皮内脏、肉类生产边角料等生产废料富含蛋白质,是生产食源性抗血栓肽的低成本蛋白来源,因此,有效利用这些废料生产有用的适销产品,可在提高企业经济效益的同时实现资源的有效利用。
1.2 食源性抗血栓肽的结构特征
抗血栓肽的活性及作用机制与肽的分子结构有一定相关性,从表1中最长的活性肽序列(GELTPESGPDLF FHFLDGNPSYSLYADAVPR,分子质量为3 412.72 Da)与最短活性肽序列(LCR、HCF,分子质量分别为390、410 Da)可分析得出,已发现的食源性抗血栓肽分子质量在300~3 500 Da范围内。此外,目前文献报道的食源性抗血栓肽主要通过抑制凝血酶的活性达到抗凝血效果,所以对表1中具凝血酶抑制作用的食源性抗血栓肽进行结构特征分析,发现其氨基酸组成占比最高的是脂肪类氨基酸,达到33.59%;其次为酸性氨基酸,占比为18.92%。因此,选择富含脂肪族氨基酸和酸性氨基酸的蛋白质作为抗血栓肽的蛋白来源可能更有优势,例如胶原蛋白富含甘氨酸。对表1中的凝血酶抑制肽的C端氨基酸分析可得:亮氨酸占比最高(14.92%),其次为异亮氨酸、天冬氨酸以及脯氨酸,占比均为10.71%。此外,多肽C端带有电荷的氨基酸被认为可以影响凝血酶抑制活性或者可以同时参与凝血过程[23]。对表1中肽序列的N端氨基酸进行统计分析可知,谷氨酸与精氨酸出现频率最高(14.29%),其次为赖氨酸与缬氨酸,出现频率均为10.71%。α-凝血酶有3 个主要的结构区域:1 个活性部位和2 个外切酶切点(Exosite-I和Exosite-II);其中活性部位更倾向结合带正电的氨基酸,而2 个外切酶切点则倾向与带负电的氨基酸结合[32]。这与谷氨酸(-)、精氨酸(+)还有赖氨酸(+)在食源性抗血栓N端的高频率出现有一定相关性。此外,凝血酶还会强烈地偏好以精氨酸作为剪切性多肽键(P1位)之前的残基[41-42]。凝血酶的活性部位有4 个特定的结合位点:S1、S2、S3和S4,其中S1在其底端包含一个天冬氨酸残基(Asp-189),其作为碱性侧链的识别位点;S2位点是围绕色氨酸残基(Trp-60D)的插入环,其封闭了一个疏水位点,可以接受较大的脂肪族残基,如缬氨酸和脯氨酸;S3位点是平坦的,暴露在溶剂中;S4位点也具有疏水性,包括1 个色氨酸残基(Trp-215)和2 个脂肪族氨基酸(异亮氨酸残基(Ile-174)和亮氨酸残基(Leu-99))[41]。位于食源性抗血栓肽两端的脂肪族氨基酸(亮氨酸、丙氨酸、缬氨酸)以及脯氨酸均可能与S2位点结合从而发挥抑制作用。
多肽的氨基酸组成与母体蛋白质的氨基酸组成有高度相关性,食源性蛋白质多样性导致研究人员在各种蛋白质中寻找抗血栓肽的过程存在一定的盲目性和随机性,因此,希望通过以上讨论为制备食源性抗血栓肽缩小蛋白质来源的选择范围。
2 食源性抗血栓肽的制备方法
选择适宜食源性生物活性肽制备方法,必须结合蛋白来源、制备成本等多方面进行综合考虑。目前最常见的食源性抗血栓肽制备方法为酶解法、化学合成法以及微生物发酵法。随着蛋白质组学发展,近年来也出现了以计算机模拟酶切法为代表的食源性抗血栓肽制备新方法。
2.1 食源性抗血栓肽的常见制备方法
食源性抗血栓活性肽主要通过酶解法获得,蛋白酶的高度特异性既保证了产物成分的稳定性,又能避免最终多肽产物中有毒化学物质残留,使得酶水解成为生产生物活性肽的首选工艺[43]。以特定的蛋白水解酶制剂对蛋白质进行酶促修饰以切割特定的肽键已经被广泛用于食品工业[44]。优质的商业酶通常从动植物和微生物中提取获得[44-48]。Zhang Shaobing[21]发现用碱性蛋白酶制备的花生蛋白水解物具有抗血栓活性,进而使用响应面法确定最佳酶解工艺。通过控制酶浓度、pH值、提取温度、提取时间和料液比不仅能使酶解生产更高效,还能实现可控和可重复的效果[48]。相较于酶解法,微生物发酵生产生物活性肽的优势在于无需使用昂贵的蛋白酶,为低成本生产方法。微生物发酵法是利用微生物生长过程中分泌的蛋白酶水解蛋白质,Rojas-Ronquillo等[35]利用干酪乳杆菌和嗜热链球菌对酪蛋白进行发酵,所得多肽对凝血和血管紧张素转换酶(angiotension converting enzyme,ACE)均有抑制作用。然而,微生物发酵生产生物活性肽的工业化还存在许多问题未克服,包括发酵多肽得率低、发酵条件难以控制以及产物多肽品质不稳定。通过上述两种制备方法所制备的抗血栓活性肽均具有杂质多、纯度低的缺点,需要进一步分离纯化,而化学合成法是一种对已知氨基酸序列的目标肽段进行定向合成的方法,所获得的肽纯度较高,还可实现大规模生产,故目前化学合成肽已经逐渐成为多肽类抗血栓药物研发的常用方法之一[49-50]。化学合成法制备的抗血栓肽常用来探究单一食源性抗血栓肽活性及机制,即已知抗血栓肽氨基酸序列后,通过化学合成法制备高纯度的肽以排除其他物质影响,有效评估其抗血栓活性强度并研究其作用机制,上述步骤组成了抗血栓活性肽研究的常用技术路线。
2.2 食源性生物活性肽制备新方法
2.2.1 计算机模拟酶切法
制备食源性抗血栓肽的酶解法需要选择合适的酶、蛋白质底物以及适宜的酶解条件,因此必须进行大量的平行实验。近年来蛋白质数据库不断丰富,例如UniProtKB、NCBI和BIOPEP,其包含可用于分析前体蛋白质的氨基酸图谱和各种蛋白质序列。使用在线工具BIOPEP和ExPASy-Peptide Cutter能够选择特定的酶和蛋白质模拟酶切反应,已被广泛应用于新型活性肽的开发[51]。Cheng Shuzhen等[30]采用ExPASy-Peptide Cutter在线工具,选择胰蛋白酶对牡蛎肌球蛋白重链蛋白进行在线虚拟酶切,将获得的多肽序列肽段与凝血酶进行分子对接,筛选活性高的序列,结合胰蛋白酶酶解实验对酶解产物中的多肽氨基酸序列进行鉴定,证明计算机模拟酶解获得的活性肽序列可以通过酶解制备获得。计算机模拟酶解方法的出现可避免传统酶解法繁琐的平行实验及漫长的分离纯化步骤,为寻找新的抗血栓肽节约时间及开发成本。但需要注意的是由于食源性蛋白种类繁多,目前只有少部分蛋白质被测定并明确了氨基酸序列,该方法只能对已完成测序的蛋白质进行模拟酶切,存在一定的局限性。
2.2.2 新型辅助提取技术
当前食源性抗血栓肽主要通过酶解法制备,然而酶的高成本、低产量和食品级酶的种类选择有限,这都是探索新型抗血栓肽的限制因素。与此同时,新型辅助技术与酶解法联用以制备生物活性肽越来越受人们关注,例如高静水压力、超声波、欧姆加热、脉冲电场、微波辅助萃取和亚临界水水解,通常与酶法结合使用[52],可有效地优化酶解工艺以提高酶解产物的多肽得率和生物活性。微波辅助萃取和超声辅助提取技术[53-54]是当前酶解制备生物活性肽应用最为广泛的辅助技术。现有研究已表明,微波辅助萃取可以提高从各种基质中所提取生物活性化合物的产量,其机理是通过分子间和分子内的摩擦,加上大量带电离子的运动和碰撞,使反应体系迅速升温,从而导致细胞壁和细胞膜的破坏[55]。超声辅助技术在食品加工中的辅助提取效果是通过3 种机制实现的,包括空穴效应、热效应和机械效应,其协同形成综合效应对细胞壁进行破坏,从而实现高效提取细胞内容物[56]。目前已有微波和超声辅助提取生物活性肽的研究报道,如Mala等[53]使用超声辅助提取和微波辅助提取从而更高效地从菠萝副产品中提取抗氧化肽;Yang Lihua等[46]利用超声辅助双酶水解法提取牛骨低分子肽,在提高牛骨肽产率的同时,也提高了酶解产物的抗氧化活性。综上,新技术应用于食源性抗血栓肽研究领域具有实际可行性以及潜在研究价值。
3 食源性抗血栓肽的分离纯化及序列鉴定
含有生物活性多肽的蛋白水解物和发酵液的成分组成通常非常复杂,因此很难明确混合物中的哪种多肽具有特定的生物活性[57]。必须采用分离技术来降低水解物和发酵液的组成复杂性,以便对目标多肽进行鉴定[58]。从上述对抗血栓肽结构的讨论可知,具有抗血栓活性的肽一般为300~3 500 Da范围内的小分子,因此通常使用沉淀法及膜过滤对粗产物进行初步分离纯化。再根据目标物的电荷性、极性、分子质量等性质,利用色谱分离技术逐级分离纯化出寡肽[59]。离子交换色谱、凝胶层析色谱、反相高效液相色谱都是食源性抗血栓肽常用的分离技术。随着质谱分析技术在生物领域的发展和应用,分离技术与质谱分析联用对纯化后抗血栓肽的氨基酸序列进行鉴定已成为多肽结构分析的常用方法。Jung等[22]使用凝胶过滤柱分离得到目标活性肽组分,采用电喷雾电离质谱对纯化后的贻贝抗凝多肽进行序列鉴定。Chen Fangyuan等[39]使用离子交换色谱柱分离得到目标组分后,利用凝胶层析色谱柱收集高活性组分,对其进行反相高效液相色谱洗脱,再使用液相色谱串联质谱鉴定洗脱成分的多肽序列结构。实际上分离纯化技术各有优势与不足,例如:凝胶过滤色谱分离技术在操作过程中有丢失抗血栓活性组分的可能性,且凝胶填料的使用成本高,不适宜商业化生产;而反向高效液相色谱技术虽然分离效果显著,但受限于使用成本高及高污染性等问题,只能在实验室规模研究使用。所以为了达到预期的分离纯化效果,需要按实际需求对不同分离技术进行组合搭配。
4 食源性抗血栓肽的活性评价
抗血栓肽活性通常从3 个方面进行探究:抗凝血、抑制血小板聚集和促进栓溶。例如Liu Hui等[60]从鲑鱼皮胶原蛋白水解物中发现了抑制血小板聚集的多肽,Ren Yao等[18]从宽体金钱蛭的蛋白水解物中发现了能够促进栓溶的多肽。根据目前研究结果显示,在已知的食源性抗血栓肽中,具有抗凝血活性的肽数量远多于具有另外两种活性的肽数量。因此食源性抗血栓肽在抗凝血方面的研究相对深入,并在活性评价方面已有较为成熟的技术路线,常见的抗凝血评价分为体外评价和体内评价2 个方面。随着生物信息学的发展,近年来出现了第3种可靠的活性评价方法,主要是从分子水平进行定量构效关系(quantitative structure-activity relationship,QSAR)的模型拟合或结合分子对接技术等利用计算机分析预测多肽活性。
4.1 食源性抗血栓肽体外抗凝血活性评价
4.1.1 凝血途径的体外抑制活性评价
凝血四项是体现抗凝剂对凝血途径抑制活性的常用检测指标,包括APTT、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)与纤维蛋白原时间(fibrinogen time,FIB)。其中APTT用于反映内源性凝血途径,若仅延长APTT,应考虑抑制内源性凝血因子FVIII、FIX、FXI或FXII的活性;PT反映外源性凝血途径,PT延长通常是由于凝血因子FVII活性受到影响:TT与FIB都能反映凝血级联共同途径中的凝血因子FV、FX、FII和FI活性受抑制的情况,共同途径受抑制还会导致APTT延长,因此APTT通常与TT、FIB的结果进行对比分析[31]。Ktari等[61]发现分离、纯化后的斑马肌肉酶解物F1组分对APTT和PT有延迟效果,说明F1的抗凝血活性途径为内源性凝血途径及外源性凝血途径。虽然凝血四项方法成熟、实验省时且可信度高,但无法明确抗血栓活性肽对凝血因子的靶向作用机制,仅能反映所抑制的凝血途径,这是凝血四项的使用局限性。此外,需要注意的是,凝血四项以血清作为主要反应溶剂,而不同来源血清的质量差异对实验数据有较大影响。
4.1.2 对凝血酶及其他凝血因子体外抑制活性评价
测定凝血酶抑制率最早出现的两种方法为滴定法与发色底物法[62-63]。滴定法操作简单但灵敏性不佳,实际应用不多。发色底物法因具有高灵敏度的特点被广泛应用于凝血酶及其他凝血因子的抑制效果测定;选择加入凝血因子对应的发色底物:FIIa-S2238、FXa-S2765/S2222/S2732、FXIIa-S2302、FXIa-S2366、FVIIa-S2288,使显色基团从底物中释放,其显色程度与抑制活性呈正相关,由此明确样品靶向抑制凝血因子的肽及抑制强度[64]。但鉴于各种发色底物价格昂贵,Yang Wangen等[65]在凝血酶发色底物法的基础上进行改良,建立了测定凝血酶抑制活性的分光光度法,原理为在纤维蛋白原底物中加入抗凝剂样品和凝血酶,在405 nm波长处反应前后吸光度差值与凝血酶活性成正相关。虽然该方法的标准曲线有效值范围有限,但其有较好的稳定性与经济性,是食源性抗凝血肽活性评价及初步机制探究的高性价比选择。表2分类总结了近年来食源性抗血栓肽体外抗凝血活性评估常见方法及其优缺点,今后研究人员可根据实际实验需求选择适当的方法来评估活性肽的体外抗凝血效果。
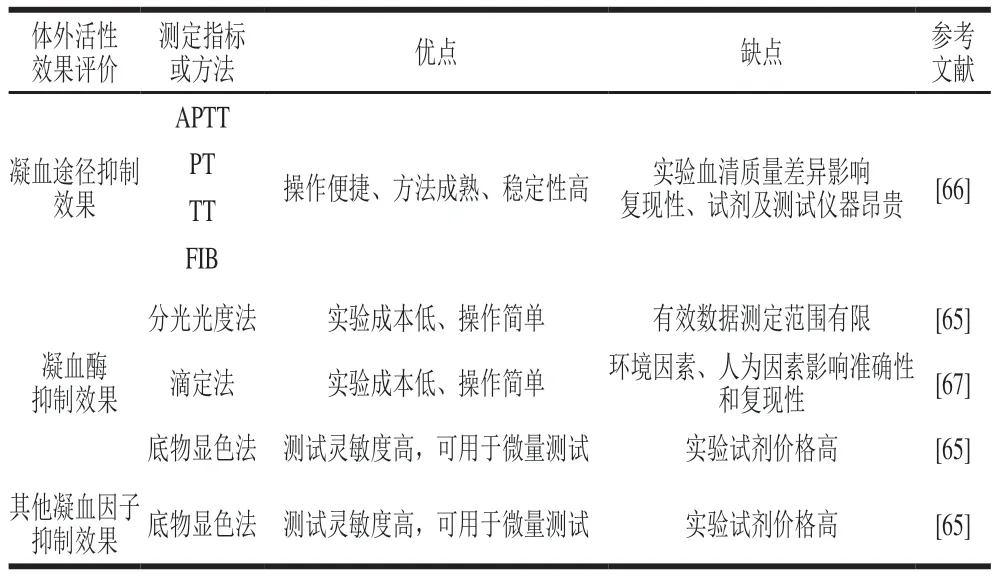
表2 食源性抗血栓肽体外抗凝血活性评价常见方法Table 2 Common methods for in vitro anticoagulant activity evaluation of food-derived antithrombotic peptides
此外,凝血酶与抑制肽之间的相互作用也可以通过其他非标记分析和检测方法来分析,如等温滴定量热法[68]、静态光散射法[69]、动态光散射法[70]、聚丙烯酰胺凝胶电泳法[71]、生物膜干涉法[72]、表面等离子体共振法[70]等。以上方法只能用于确定抑制肽是否与凝血酶结合,而不能推断它们之间的结合部位和作用力,因此使用化学结构分析技术如X射线晶体衍射或分子对接技术,对明确凝血酶抑制剂复合体结构信息及作用机理至关重要[73]。
4.2 食源性抗血栓肽体内活性验证
以化学药物诱导法构建动物血栓模型进行药物体内实验具有可靠性和重复性好的特点,食源性抗血栓肽研究中常用的模型包括:角叉菜胶诱导鼠尾静脉血栓模型(炎症性血栓)、凝血酶诱导急性肺栓塞模型(内源性血栓)、胶原暴露诱导颈动脉血栓模型(损伤性血栓)等。
4.2.1 角叉菜胶诱导鼠尾静脉血栓模型
角叉菜胶也被称作卡拉胶,是由D-半乳糖和3,6-脱水-D-半乳糖重复单元组成的直链含硫大分子多糖。建造模型的方法通常为:室温环境下将一定剂量的角叉菜胶生理盐水溶液注入小鼠腹腔,造模6~12 h内小鼠尾尖出现暗红色血栓并逐渐向尾根扩大,24 h左右血栓区域趋于稳定,观察小鼠尾动脉血栓发生率并测量血栓长度[74]。该模型具有简便快捷、成本低的优点,已应用于多种动物的血栓模型建立。为了提高了动物实验造模成功率及模型的稳定性,Hagimori等[75]通过简单的结扎来改变大鼠的血流动性,显著改善了静脉注射β-卡拉胶后血栓形成的频率和体征,特别是当1 mg/kgmb角叉菜胶注射与尾部结扎10 min相结合,使大鼠血栓形成率增加到近100%。Arslan等[76]通过角叉菜胶诱导的鼠尾血栓模型证实了山楂提取物在小鼠体内具有抑制血栓形成的效果。
4.2.2 凝血酶诱导急性肺栓塞模型
肺栓塞主要由深静脉血栓(deep venous thrombosis,DVT)引起。DVT形成于下肢的大静脉和深静脉血管,随着血液流动进入肺血管中引发肺栓塞,使人体表现出慢性血栓栓塞性肺动脉高压病理状态[77]。静脉注射凝血活酶可使血液达到高凝状态,常用于诱导DVT形成,进而引发动物急性肺栓塞,可利用其构建肺栓塞模型[78]。适度调节凝血活酶注射剂量,可使不同动物体内形成DVT具有可控性和稳定性。Cheng Shuzhen等[28]使用凝血酶静脉注射诱发小鼠急性肺栓塞建立动物实验模型,发现凝血酶组的小鼠死亡率最高(87.5%),幸存的小鼠在5 min内出现瘫痪,灌胃牡蛎肽(P-3-CG)的对照组小鼠生存率为100%,肺部的组织学研究表明,凝血酶组小鼠的肺中形成了大量致命的大血块,而对照组的肺中只有少部分小的血块,证明P-3-CG可通过抗凝血抑制急性肺栓塞发生,从而显著提高小鼠的存活率。
4.2.3 胶原暴露诱导颈动脉血栓模型
胶原蛋白是一种强烈的血栓刺激物质,通过直接和间接与各种血小板受体结合发挥作用。血管组织中已发现了几种胶原蛋白(例如I型、III型、IV型)[79]。该动物模型是用FeCl3溶液外敷血管致血管损伤,利用血管壁组织中胶原蛋白暴露诱发血小板黏附集聚,并与凝血级联反应协同作用形成混合型血栓[80]。FeCl3溶液外敷法建立动物血栓模型简便易行,不同动物、不同血流量的血管所需FeCl3浓度和外敷时间不同,必要时可将FeCl3外敷法与制作狭窄血管或完全阻止血流结合起来提高建模成功率[81]。郑媛媛等[38]为探究双齿围沙蚕抗凝血肽(anticoagulant peptides fromPerinereis aibuhitensis,PAAP)体内活性,建立了小鼠颈动脉血栓模型,发现与模型组相比,高剂量PAAP灌胃的大鼠组颈动脉中血栓块质量显著下降,表明PAAP对血栓形成有抑制作用且存在剂量效应。
近年来,血栓性疾病模型越来越复杂多样,尽管没有单一的动物模型能够完全反映人类血栓栓塞性疾病的所有临床特征和病理特征,但是每种动物模型都有助于更好地理解各种血栓性疾病的发生过程和生理机制。为了客观、真实地反映实验动物体内血栓疾病发展程度,不能仅以分析疾病导致的动物体征变化作为依据,还需结合疾病部位组织学、病理学特征,并从基因水平和蛋白水平等方面来对病情程度做出更加确切的判断,为抗凝药物评价提供依据。
4.3 食源性抗血栓肽计算机预测活性评价
结构特性对食源性多肽针对各种分子疾病靶点的特定生物活性有很大影响,如链长和理化特性(包括氨基酸残基的疏水性、分子电荷和侧链的膨胀性)[82]。基于这些多肽特征,研究人员开发了一系列预测多肽活性的方法,如在线软件Peptide Ranker、QSAR建模和分子对接等[51]。目前根据多肽结构进行抗血栓活性预测主要从3 个方面开展:多肽序列比对、多肽分子结构比对以及分子对接。Feng Liting等[37]对从贻贝蛋白水解物鉴定得到的39 条多肽与凝血酶(PDB:2BVR)进行分子对接结合能分析并与本地数据库中已知的抗血栓多肽进行序列同源性比对,通过多肽构效关系分析其潜在抗血栓活性,结合分子对接非键相互作用进行多方面评估,预测结果显示贻贝抗凝血肽Peptide26(KNAENELGEVTVR)和Peptide 36(NAESLRK)具有较高抗血栓活性及研究价值。Cheng Shuzhen等[28]在凝血酶-牡蛎肽(P-3-CG)分子对接复合体中发现了10 个可能结合凝血酶活性部位的位点,进而分析了凝血酶抑制活性的生化机制。
尽管分子对接、QSAR等作为新方法已广泛应用于生物活性物质设计、发现和分析研究中,但还需根据丰富的理论基础辅以有效的运算模型设计,进一步提高活性预测的准确性[51]。虽然现有研究结果已表明以上方法用于预测活性具有较高可信度,但结合体内外实验进行活性评价仍是不可或缺的环节。
5 食源性抗血栓肽的抗凝血机制
5.1 凝血级联反应
凝血是人体中一种重要的自我保护机制,凝血系统和抗凝血系统在正常生理状态下保持着动态平衡。一旦受伤失血的情况发生,凝血因子被迅速激活从而使血液凝结来防止其过量流失。凝血反应有两个起始途径,分为内源性凝血和外源性凝血,二者区别在于凝血因子X被激活的途径不同。外源性途径启动于血管损伤胶原暴露,随后组织因子(tissue factor,TF)释放与磷脂表面的凝血因子FVIIa结合形成一个复合体,该复合体进一步介导激活FIX和FX分别为FIXa和FXa。内源性途径起始于FXII和FXI的活化,FXIIa介导FXI活化为FXIa的激活反应,然后FIX在FXIa的作用下被激活为FIXa,在磷脂表面的FIXa与其辅助因子FVIIIa一起形成酶复合体,并介导FX的激活反应。可见两种途径的目的均为激活凝血因子FX进入共同的凝血途径,最终激活凝血因子FII,即凝血级联的最终产物凝血活酶使得溶于血清的纤维蛋白原被凝血活酶活化形成不溶的网状纤维,该网状纤维拦截红细胞的同时,血小板黏附于其上共同形成血栓。外源性凝血途径、内源性凝血途径和共同凝血途径被合称为凝血级联反应,凝血级联反应的具体机制见图1。

图1 凝血级联反应:食源性抗血栓肽的抗凝血作用机制Fig.1 Coagulation cascade: anticoagulant mechanism of food-derived antithrombotic peptides
5.2 食源性抗血栓肽的抗凝血机制
5.2.1 食源性抗血栓肽靶向凝血酶的抑制机制
凝血酶是人体凝血系统中的一种丝氨酸蛋白酶,即凝血级联反应所活化的最末端凝血因子(FIIa),凝血酶活化后将可溶性纤维蛋白原转化为不溶性纤维蛋白并与血管内皮细胞表面的蛋白酶激活受体(proteaseactivated receptor,PAR)1/3结合,激活血管内皮细胞,从而激活部分凝血因子,进而诱导血小板聚集快速形成血栓[33]。因此,抑制凝血酶的活性从而阻碍不溶性纤维蛋白形成可有效抑制血栓的形成。但凝血酶活性的调节是通过一个复杂的机制实现的,除了可作用于活性部位外,还可作用于2 个外切酶切点——Exosite-I和Exosite-II。Chen Fangyuan等从黄粉幼虫蛋白酶解产物中分离纯化得到样品由2 种抗血栓肽(SLVDAIGMGP和AGFAGDDAPR)组成,样品质量浓度为0.2 mg/mL时的凝血酶抑制率为28.66%,结合QSAR建模比对分析,预测这两种多肽可能与凝血酶的Exosite-I相互作用,这是它们有效抑制凝血酶活性的原因[39]。Xu Shiqi等[33]对乳铁蛋白多肽LRPVAAEIY进行分子对接发现,该多肽既能与凝血酶的活性部位结合,又能与凝血酶的Exosite-I结合,以此抑制凝血酶活性阻碍血栓形成。
5.2.2 食源性抗血栓肽介入凝血级联的抑制机制
凝血级联反应物质由各级凝血因子组成,一系列凝血因子的活化反应之间呈现为前一凝血因子活化后能够参与下一个凝血因子的酶促反应并逐级放大。Jung等[22]从紫贻贝的可食部分中分离到一种抗凝寡肽(MEAP),该肽能够与凝血因子FIX、FX和FII特异性地相互作用,可抑制FIX对FX的激活作用,进而抑制凝血酶原酶复合体在剂量依赖反应中形成FIIa,从而发挥抑制凝血的效果。Rajapakse等[83]利用黄鳍鱼分离得到抗凝单链蛋白(YAP),YAP是通过与FXIIa形成一个失活的大复合体而不是裂解FXIIa来实现抗凝血效果。Jung等[84]从海洋蠕虫中分离到一种特异性FIXa因子抑制肽(UAP)。UAP通过与FIXa结合阻碍FIXa参与FX转化为FXa的活化反应,从而延长凝血时间。食源性抗血栓肽与各种凝血因子在分子层面相互作用,阻碍凝血级联反应的逐级放大效应,从而延缓或抑制凝血作用。
抗凝策略一直是血栓栓塞症优先考虑的防治方向[85]。现有文献报道的食源性抗血栓肽主要通过靶向抑制FIIa活性和介入凝血级联反应两种机制实现抗凝血效果。凝血系统是一个复杂的调节体系,不同凝血因子对凝血反应都发挥着其独特的作用,从凝血反应的分子层面认识抗血栓肽作用机制,对靶向性抗凝治疗策略的发展有着重要的意义。近年来,传统的VK拮抗剂正在被直接口服抗凝剂(direct oral anticoagulants,DOAC)所取代。DOAC通过靶向抑制FXa或FIIa的活性实现抗凝血效果,但是FXa和FIIa在抗凝血机制和正常止血反应中都发挥着重要作用,所以抑制FXa或FIIa活性在有效预防血栓形成的同时也导致病人止血功能变差[86]。由于功能性食品具有抗凝血功能物质,能够在安全范围内调节血液凝结趋势的同时规避副作用的风险,因此利用靶向抑制FIIa的食源性抗血栓肽开发预防血栓疾病的功能性食品或许是更好的选择。而对于日益增长的患有合并症的人群来说,他们需要不仅能抗凝血预防血栓且不影响正常止血功能的抗血栓药物[87]。由于FXI和FXII在血栓形成的机制中发挥重要的作用,但它们对止血反应来说却是可有可无的,所以靶向抑制FXI或FXII的活性可能会在不影响止血的情况下实现防治血栓的效果,因此FXI和FXII已成为新的抗凝治疗靶点[88]。所以通过介入凝血级联反应发挥靶向性抗凝血作用的食源性抗血栓肽更适用于新型抗凝药物的研发。此外,目前处于在研发阶段的新型抗凝靶向药包括FXII/FXIa抑制剂、FIX/FIXa抑制剂和内源性FXase抑制剂[86]。明确食源性抗血栓肽的作用机制,才能根据其特性开发相关产品,提高食源性抗血栓肽进行科研成果转化的潜在价值,促进食源性抗血栓肽的产业发展。
6 结 语
近年来,人们不断探究新的抗血栓生物活性肽,以期能开发降低疾病发生风险的特医食品和保健食品。但实际上食源性抗血肽从科研成果转化为可供消费者购买的药品、保健食品或功能食品等商业产品的进展相对滞后,仍需要深入且有针对性的研究以解决产品研发过程中所面对的实际难题:1)目前寻找新型食源性血栓肽时传统上通过分离、纯化再鉴定的方法需要耗费大量时间,所以在条件允许的情况下应有效利用生物学信息方法,以实现高效且全面地筛选抗血栓活性肽序列;同时,为了设计可持续且规模化的食源性抗血栓肽生产方案,需要合理利用新技术(如高静水压力、亚临界水解)从而实现高效生产。2)对于大部分食源性抗血栓肽只完成体外实验验证以及通过蛋白质组学分析工具阐明活性机制,在很大程度上忽略了多肽存在体内吸收效率低的问题,且具有在体内消化过程中失去活性的可能性。针对以上情况还需要补充体内实验数据进行验证,并结合新型活性物质载体技术(微胶囊、乳液包埋、天然聚合物、纳米载体等)对其进行消化稳定性、生物利用度优化。3)也有少数食源性抗血栓肽进行了动物模型的体内活性验证,但仍缺乏人体内药代动力学、细胞通路、代谢组学的机理相关研究,即食源性抗血栓肽研究缺乏完整的临床试验数据为其有效性和未来产品的健康益处提供实质性证据。此外,若食源性抗血栓肽在组分复杂的粗水解液中稳定表现其抗血栓效果,在不影响安全性的条件下使用粗水解物配制功能性食品配方,不失为是一种降低产品生产难度的选择。
本文从蛋白来源、制备方法、分离纯化和序列鉴定、活性评价以及活性机制,多方面总结食源性抗血栓肽的研究进展,在提出展望的同时指出食源性抗血栓肽目前面临的挑战,以期为血栓栓塞性疾病的防治和新型抗凝剂的研发提供新思路。纵然食源性抗血栓肽由实验阶段向商业化转变面临各种难题亟待解决,相信随着今后研究的深入,未来会有科研成果成功转化为食源性抗血栓肽产品面世。

