miR-34a-5p 过表达抑制子宫内膜癌AN3CA 细胞的上皮间充质转化
石璐璐, 田雪敏, 董 辉, 杨彩虹
(1.宁夏医科大学临床医学院,银川 750004; 2.宁夏医科大学总医院医学科学研究院,银川 750004;3.宁夏医科大学总医院心脑血管病医院,银川 750004)
子宫内膜癌是女性最常见的妇科恶性肿瘤之一[1],其发病率和病死率呈上升趋势,且容易复发和转移[2-3],对女性的健康和生命构成了极大的威胁。以往研究[4]表明,子宫内膜癌好发于围绝经期和绝经后女性,随着生活水平的提高,肥胖、雌激素水平紊乱、糖尿病及高血压等危险因素促使其发病趋于年轻化[1,5]。因此,探讨子宫内膜癌的致癌基因和发病机制对于子宫内膜癌的预防和治疗尤为重要。
miRNAs 是一类长度为19~25 个核苷酸的单链非编码RNA 分子,通过与靶基因的3’非翻译区结合来调控基因的表达,其异常表达与多种肿瘤的发病机制密切相关。miR-34a-5p 作为miR-34 家族中的一员,具有与p53 通路相关的肿瘤抑制功能[6]。相关研究[7-9]发现,miR-34a-5p 在结直肠癌、乳腺癌和卵巢癌中低表达,这表明miR-34a-5p 的表达失调是肿瘤发生的关键因素之一。上皮间充质转化(EMT)是上皮细胞转化为间充质细胞的过程,也是促进肿瘤细胞迁移和侵袭的重要机制。研究[10]表明,肿瘤细胞通过miRNAs来参与EMT 过程从而调控相关的癌症转移,如miR-451 抑制胶质瘤细胞的侵袭、迁移和EMT过程。但miR-34a-5p 在子宫内膜癌的相关研究较少,故本研究旨在探讨miR-34a-5p 对子宫内膜癌AN3CA 细胞侵袭、迁移和EMT 过程的影响,从而为子宫内膜癌的预防、诊断和治疗提供新的方向。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人子宫内膜癌AN3CA 细胞由宁夏医科大学总医院科研设备管理中心提供。
1.1.2 主要试剂 miR-34a-5p 过表达慢病毒及其空载体慢病毒购自汉恒生物科技(上海)有限公司,SYBR Green PCR 试剂盒购自天根生化科技(北京)有限公司,引物miR-34a-5p 购自生工生物技术(上海)有限公司,引物U6 购自广州锐博生物科技有限公司,高糖DMEM 培养基购自上海源培生物科技股份有限公司,胎牛血清购自以色列Biological Industries 公司,Transwell 小室购自美国Corning Incorporated 公司,胰蛋白酶、青链霉素混合液和结晶紫甲醇溶液均购自北京索莱宝科技有限公司,蛋白转移缓冲液购自大连美仑生物技术有限公司,Tris-甘氨酸-SDS 缓冲液和TBST 购自上海百赛生物技术股份有限公司,Western Lighting Plus ECL 购自Perkin Elmer公司,全蛋白提取试剂盒和BCA 蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司。ZEB1购自ABclonal 公司,E-cadherin、N-cadherin、Vimentin、SNAI1、α-SMA、GAPDH 抗体及辣根过氧化物酶标记的二抗购自美国Proteintech 公司。
1.2 方法
1.2.1 细胞培养 所有细胞均培养于含有10%的胎牛血清、1%的青链霉素混合液的DMEM 培养基中,培养条件为37 ℃、5% CO2。当细胞数量为80%~90%时,PBS 清洗1 次,加入1 mL 的0.25%胰蛋白酶消化,消化后将细胞悬液收集于15 mL 离心管中,1 200 r·min-1离心5 min,弃掉上清液后重悬并传代,用于后续相关实验。
1.2.2 细胞转染 采用处于对数生长期的子宫内膜癌AN3CA 细胞进行转染。细胞分为Control组(空白对照)、NC 组(转染慢病毒空载体)及miR-34a-5p 组(转染miR-34a-5p 过表达慢病毒)。转染前一天,将细胞接种于6 孔板中,待第2 天生长密度为50%~60%时,分别将慢病毒转染于相应细胞组(MOI=60),培养24 h 后换液,至48和72 h 时用荧光显微镜观察荧光表达情况。转染成功后用嘌呤霉素筛选稳定表达的细胞株。
1.2.3 RT-qPCR 检测各组细胞中miR-34a-5p的表达水平 将生长状况良好的各组细胞用Trizol 法提取总RNA,检测各浓度后,以总RNA 为模板反转录为cDNA。以U6 为内参,按照说明书进行PCR 反应,反应条件为:95 ℃3 min,95 ℃5 s,60 ℃30 s,共40 个循环。采用2-ΔΔCt法计算各组细胞中miR-34a-5p 表达水平。反转录引物序列:5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACAACCAG-3’;miR-34a-5p 引物序列:F 引物:5’-ACACTCCAGCTGGCTGGCAGTGTCTTAGC-3’,R 引物:5’-TGGTGTCGTGGAGTCG-3’;U6 引物序列:F 引物:5’-CTCGCTTCGGCAGCACA-3’,R 引物:5’-AACGC TTCACGAATTTGCGT-3’。
1.2.4 Transwell 侵袭实验检测细胞的侵袭能力 预先在Transwell 小室底部铺入40 μL 的水凝胶待用,取对数生长期的各组细胞,用胰酶消化后重悬计数,接种于上室中(细胞数为1×105个/100 μL),下室加入700 μL 含15%胎牛血清的完全培养基,培养48 h 后,弃掉上室中的培养液,用棉签轻轻蘸去小室中未侵入的细胞。4%多聚甲醛固定15 min,0.25%结晶紫避光染色15 min后在显微镜下(×200)随机选取5 个视野拍照并计数,计算各组细胞的侵袭数量。
1.2.5 划痕实验检测细胞的迁移能力 在6 孔板的背面预先画5 条横线,然后将生长状况良好的各组细胞接种于6 孔板中,当细胞完全贴壁且铺满底部后,用牙签在各孔的细胞表面划一条垂直于横线的愈合伤口,PBS 洗去划掉的漂浮细胞,加入不含血清的培养基,显微镜下(×200)拍照记录划痕面积。培养24 h 后,在同一位置再次拍照记录划痕面积,计算各组细胞的迁移率。细胞迁移率(%)=(0 h 划痕面积-24 h 划痕面积)/0 h划痕面积×100%。
1.2.6 Western blot 检测EMT 相关蛋白的表达 收集各组细胞后,使用全蛋白提取试剂盒提取各组细胞中的蛋白质,并用BCA 试剂盒检测蛋白浓度。每孔的蛋白上样量为30 μg,依次进行电泳、转膜、封闭、一抗孵育4 ℃过夜,二抗室温孵育1.5 h,最后加入ECL 发光液曝光目的条带。以GAPDH 为内参,采用Image J 软件计算目的蛋白与内参蛋白的灰度值的比值。
1.3 统计学方法
数据采用GraphPad Prism 9.0 和SPSS 23.0软件进行分析,计量资料以均数±标准差(±s)表示,各组间比较采用单因素方差分析,采用SNK-q检验进行组间两两比较。P≤0.05 为差异有统计学意义。
2 结果
2.1 miR-34a-5p 过表达慢病毒转染后升高miR-34a-5p 的表达水平
慢病毒转染子宫内膜癌AN3CA 细胞后,通过荧光显微镜观察各组细胞,结果发现Control组无荧光表达,而NC 组和miR-34a-5p 组可见明显的绿色荧光,提示转染成功,见图1A、图1B。RT-qPCR 结果显示,与Control 组和NC 组相比,miR-34a-5p 组中,miR-34a-5p 的表达水平均升高(P 均<0.01),进一步证实转染成功。而Control组和NC 组差异无统计学意义(P>0.05),见图1C。
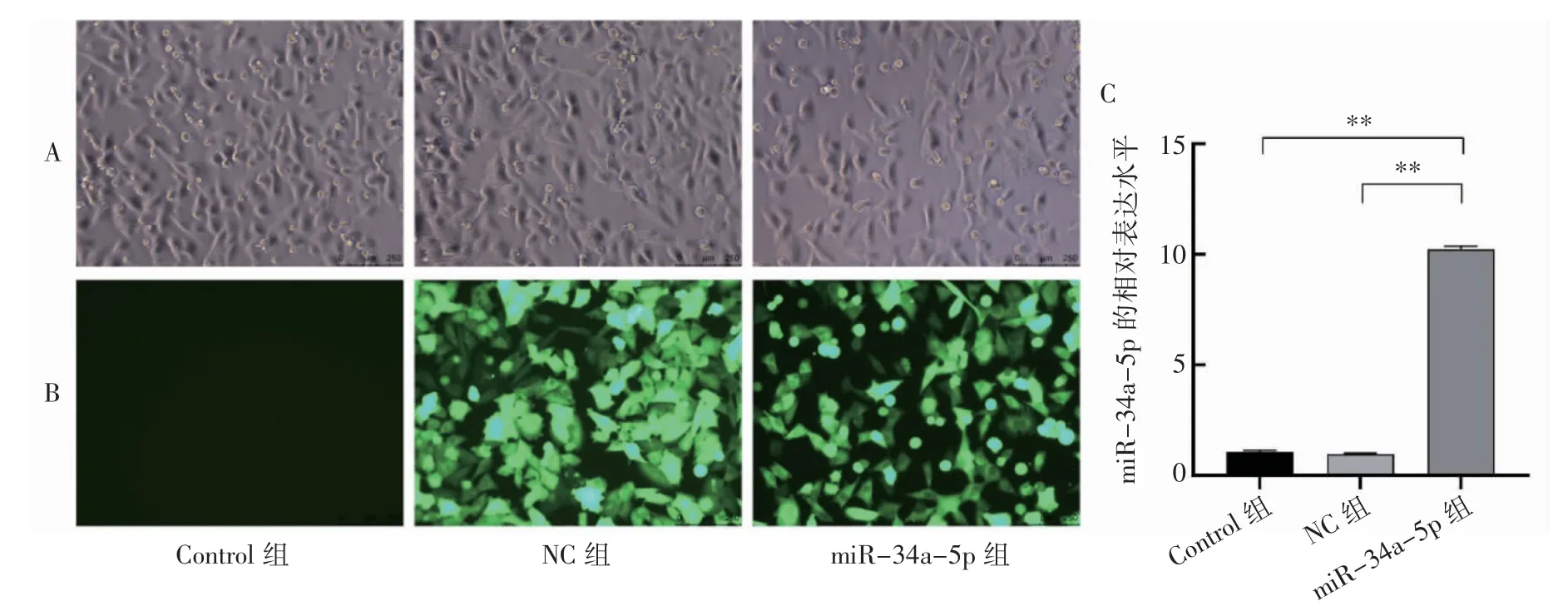
图1 慢病毒转染AN3CA 细胞后的荧光表达及各组细胞中miR-34a-5p 的表达
2.2 miR-34a-5p 过表达抑制子宫内膜癌AN3CA 细胞的侵袭
Transwell 侵袭实验结果显示,Control 组、NC组和miR-34a-5p 组的细胞侵袭数量分别为(492.40±18.80)个、(497.00±36.94)个和(62.60±12.18)个。与Control 组和NC 组相比,miR-34a-5p 组的细胞侵袭数量均减少(P 均<0.01),而Control 组和NC 组差异无统计学意义(P>0.05),见图2。

图2 Transwell 侵袭实验检测miR-34a-5p 过表达AN3CA 细胞的侵袭
2.3 miR-34a-5p 过表达抑制子宫内膜癌AN3CA 细胞的迁移
划痕实验结果显示,Control 组、NC 组和miR-34a-5p 组的细胞迁移率分别为(50.94±4.61)%、(49.66±5.64)%和(34.49±1.15)%。与Control 组和NC 组相比,miR-34a-5p 组的细胞迁移率均降低(P 均<0.01),而Control 组和NC组差异无统计学意义(P>0.05),见图3。

图3 划痕实验检测miR-34a-5p 过表达AN3CA 细胞的迁移率
2.4 miR-34a-5p 过表达抑制子宫内膜癌AN3CA 细胞的EMT 过程
Western blot 实验结果显示,与Control 组和NC 组相比,miR-34a-5p 组中E-cadherin 均增高,N-cadherin、Vimentin、SNAI1、α-SMA 和ZEB1降低(P<0.05 或P<0.01),而Control 组和NC 组差异无统计学意义(P>0.05),见图4。
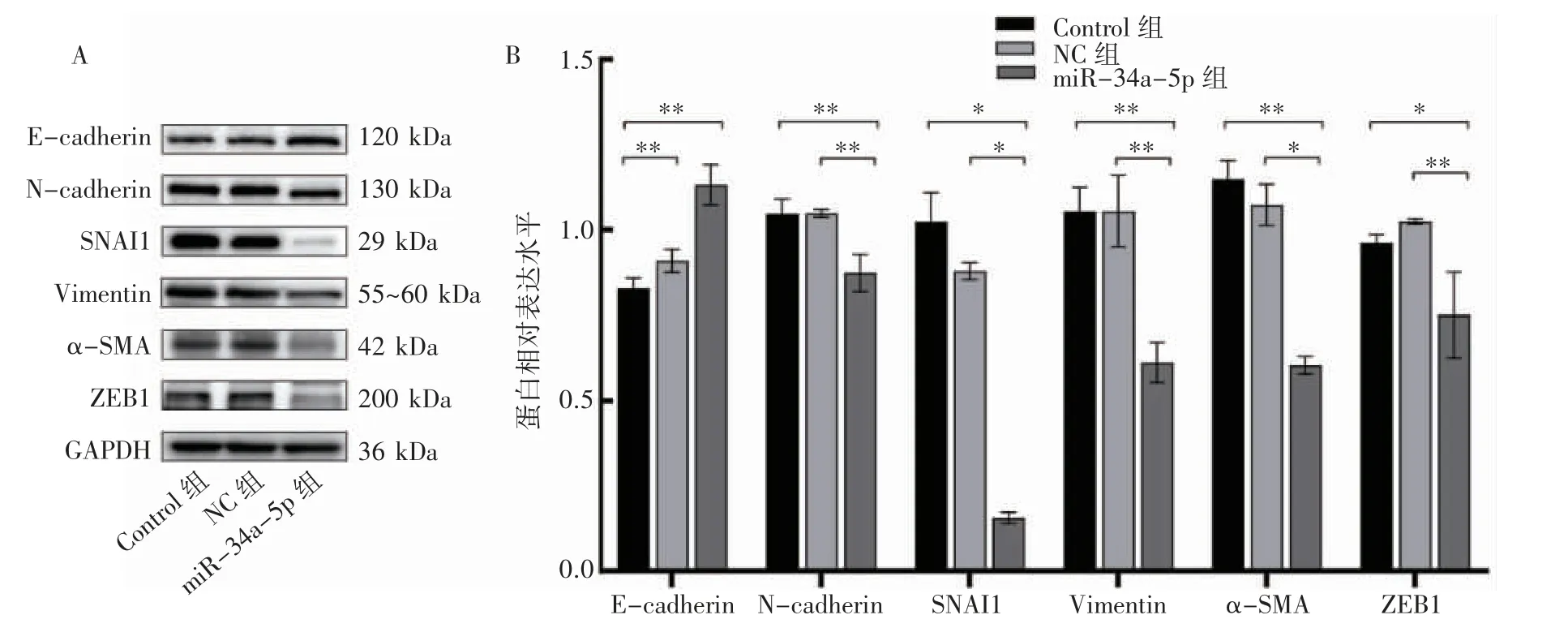
图4 Western blot 检测miR-34a-5p 过表达AN3CA 细胞EMT 相关蛋白的表达
3 讨论
子宫内膜癌是最具侵袭性和致命性的癌症之一,其最常见的症状是绝经后不规则的阴道流血,但绝经后不规则的阴道流血不是子宫内膜癌的特异性表现[11],因此早期诊断比较困难。相关研究[12]发现,早期子宫内膜癌患者具有良好的预后,而那些晚期及被诊断为复发性和转移性的患者的总体生存率很低。因此,迫切需要进一步了解子宫内膜癌的发生和转移机制,从而确立与之相对应的预防措施和治疗策略。近年来,随着对肿瘤相关生物标记物的深入研究,基于分子特征的基因检测和靶向治疗有望成为早期发现和改善子宫内膜癌预后的关键措施[13-14]。
miRNAs 在癌症中发挥着重要的调控作用,既可作为致癌基因,也可作为肿瘤抑制因子。miR-34a-5p 作为肿瘤抑制因子之一,能够影响肿瘤的发生、生长、EMT 过程、侵袭和迁移[15]。在黑色素瘤中,miR-34a-5p 下调能够促进肿瘤细胞的生长和转移,其表达水平与TNM 分期密切相关[16]。在乳腺癌中,miR-34a-5p 通过靶向上皮间充质转化转录因子(EMT-TFs)抑制乳腺癌细胞的增殖和远处转移[17]。在结肠癌中,miR-34a-5p 过表达能够抑制结肠癌细胞的迁移、侵袭和EMT 过程[7]。由此可见,miR-34a-5p 通过肿瘤抑制作用来影响癌症的生物学功能,提示miR-34a-5p 可作为预测不同类型肿瘤诊断和预后的生物标记物。在本研究中,通过慢病毒转染构建了miR-34a-5p 过表达的子宫内膜癌AN3CA 细胞系,采用划痕实验和Transwell 侵袭实验证实了miR-34a-5p 过表达能够抑制子宫内膜癌AN3CA细胞的迁移和侵袭。
EMT 对胚胎发育、伤口愈合、组织再生、器官纤维化和癌症进展至关重要,其异常激活在肿瘤的发生、侵袭和转移中发挥着关键作用[18-19]。EMT过程非常复杂,在该过程中,细胞失去上皮表型而转化为间充质表型,使上皮标记物E-cadherin表达降低,间充质标记物N-cadherin、Vimentin、SNAI1、α-SMA、ZEB1 的表达水平增加,从而赋予肿瘤细胞浸润和转移的特性[20]。而转移是癌症致死的主要原因之一[21],因此抑制EMT 的发生对于预防子宫内膜癌的转移非常重要。许多miRNAs 可通过调控EMT 过程影响肿瘤的转移。An等[22]认为,miR-203a-3p 过表达可以维持胰腺癌细胞的上皮表型,抑制胰腺癌细胞的增殖、迁移和侵袭,并诱导癌细胞凋亡,从而抑制胰腺癌的EMT 进程。为了进一步明确miR-34a-5p 是否影响子宫内膜癌细胞的EMT 过程和转移,本研究Western blot 实验结果显示,miR-34a-5p 过表达能够上调E-cadherin 的表达,而下调N-cadherin、Vimentin、SNAI1、α-SMA 和ZEB1 的表达水平。说明miR-34a-5p 是上皮向间充质转化的抑制因子,其过表达能够抑制子宫内膜癌细胞的EMT过程,从而有效阻断子宫内膜癌远处转移的倾向。
综上所述,miR-34a-5p 过表达能够抑制子宫内膜癌AN3CA 细胞的迁移和侵袭能力,并抑制EMT 过程。 因此,认为miR-34a-5p 可作为预测子宫内膜癌转移倾向的新型生物标记物,从而有效指导子宫内膜癌的靶向治疗。

