基于多组学数据分析PUF 家族基因在肝癌中的表达及其临床意义
唐超峰, 柳科军, 陈本栋, 卜 阳
(1.宁夏医科大学总医院肝胆外科,银川 750004; 2.宁夏回族自治区人民医院肝胆外科,银川 750002)
肝癌是常见的原发性肝癌,占所有原发性肝癌的75%~85%,在全球癌症相关死亡原因中位列第4[1-2]。肝癌的发生、浸润和转移涉及多种癌基因、抑癌基因及生长因子,而转录调控是肿瘤细胞代谢和增殖等生物学行为的关键[3-4]。RNA结合蛋白(RNA-binding proteins,RBPs)在转录调控中有非常重要的作用,PUF 家族蛋白又称Pumilio RNA 结合家族蛋白(主要包括PUM1、PUM2 和PUM3),是高度保守的RNA 结合域,主要参与基因负性调控和特异性识别碱基,参与干细胞分裂增殖、细胞周期、DNA 修复和细胞凋亡等过程,其功能障碍会导致神经退行性变、癫痫、共济失调、不育和恶性肿瘤[5]。既往研究[6-8]已证实,PUM1 在卵巢癌、非小细胞肺癌及淋巴细胞白血病等肿瘤中发挥致癌作用。目前关于PUM1、PUM2、PUM3 基因在肝癌发生发展中的具体作用并不清楚,因此,本研究基于多组学数据分析PUM1、PUM2、PUM3 基因在肝癌中的表达及其临床意义,以期为PUF 家族基因的临床应用提供一定的理论依据。
1 资料与方法
1.1 数据来源
通过The Cancer Genome Atlas(TCGA)数据库下载肝癌患者临床信息和RNA 测序数据,去除重复样本后共纳入371 例肝癌组织基因表达谱样本和50 例癌旁组织基因表达谱样本。所有的表达数据都通过对数转换进行归一化处理。根据Z-score 标准化的中值,将纳入研究的患者分为高PUMs 表达组和低PUMs 表达组,分析PUM1、PUM2、PUM3 基因表达与患者临床病理特征的相关性。人类蛋白质图谱(https://www.proteinatlas.org/)可以使用各种组学技术(包括免疫组织化学法、蛋白质组学、转录组学和系统生物学)来定位细胞、组织和器官中的蛋白质表达情况[9-11]。本研究从该数据库下载免疫组织化学图像来比较肝癌组织中PUMs 的蛋白质表达水平,并深入评估其蛋白质表达情况。String(https://cn.string-db.org/)是已知和预测的蛋白质-蛋白质相互作用网络的在线数据库[12],本研究联合Cytoscape 软件绘制PUMs 蛋白与前20 互作蛋白的网络图。cBioPortal for Cancer Genomics(https://www.cbioportal.org/)是一个开放访问的开源资源,用于交互式探索多个癌症基因组数据集[13]。利用cBioPortal 基于TCGA Pan-Cancer Atlas 分析PUMs 基因在肝癌中的突变特征。
1.2 GO/KEGG 富集分析
通过String 数据库得到的PUMs 相关基因(Spearman 相关系数≥0.9,P<0.05) 全部输入DAVID 数据库[14]进行注释、可视化和综合分析,基因功能分析包括生物过程(biological process,BP),分子功能(molecular function,MF)和细胞成分(cellular components,CC),相关通路主要是KEGG 途径。当FDR<0.05,对主要富集结果进行可视化。
1.3 免疫浸润分析
TumorImmuneEstimationResource(TIMER2.0)(http://timer. cistrome.org/)基于TCGA 数据库分析免疫细胞浸润水平[15]。TIMER 2.0 用于分析肝癌中PUMs 表达与免疫细胞浸润丰度的相关性。Spearman 用于分析PUMs 与免疫细胞浸润丰度的相关性。数据采用GraphPad Prism 软件(Windows 版本8.0.0)进行可视化。
1.4 统计学方法
所有的表达数据均通过log2(data+1)进行标准化和对数转换。采用R38.3 软件进行统计学分析,采用Mann-Whitney U 检验分析肝癌组织和正常肝组织的表达差异,而配对样本t 检验用于配对样本分析。R 包[ggplot2(Version 3.3.3)]用于可视化。使用卡方检验或Fisher 精确概率法分析PUMs 表达水平与肝癌患者临床病理特征的差异。采用Kaplan-Meier 法比较不同PUMs 表达水平患者的总存活率,组间差异比较采用秩和检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 PUF 家族基因在正常肝组织、癌旁组织和肝癌组织中表达水平比较
与正常肝组织相比,PUM1、PUM2 及PUM3 mRNA 在肝癌组织中高表达(W=0.487,P=2.1×10-7;W=0.557,P=8.9×10-10;W=0.821,P=1.1×10-14);与癌旁组织比较,PUM1、PUM2 及PUM3 mRNA在肝癌组织中高表达(t=5.802,P=4.7×10-7;t=6.076,P=1.8×10-7;t=8.294,P=6.8×10-11),见图1。

图1 PUF 家族基因在正常肝组织、癌旁组织和肝癌组织中表达差异
2.2 人类蛋白图谱中PUF 家族基因的免疫组化图像
基于HPA 数据库免疫组织化学结果显示,肝癌组织中PUM1、PUM2 及PUM3 阳性表达,阳性蛋白表达主要集中于细胞核或细胞质,见图2。

图2 人类蛋白图谱中PUF 家族基因在肝癌组织中表达情况(免疫组化×200)
2.3 PUF 家族基因转录水平与临床病理的关系
肝癌组织中PUM1 表达水平在患者年龄、体质量指数(BMI)及组织学分级中差异均有统计学意义(P 均<0.05);肝癌组织中PUM2 表达水平在患者性别、年龄及病理分期中差异均有统计学意义(P 均<0.05);肝癌组织中PUM3 表达水平在患者肿瘤T 分期及病理分期中差异均有统计学意义(P 均<0.05),见表1。

表1 PUF 家族基因表达水平与肝癌患者临床病理特征的关系[例(%)]
2.4 肝癌组织中PUF 家族基因转录水平的预后价值
PUM1、PUM2 及PUM3 高表达组的总生存率(OS)均低于低表达组[危险比(hazard ratio,HR)=1.49(1.06~2.11),P=0.021]、[HR=1.75(1.24~2.46),P=0.001]和[HR=1.47(1.04~2.08),P=0.027],见图3。

图3 PUF 家族基因表达与OS 的关系
2.5 肝癌中PUMs 共表达基因的蛋白-蛋白相互作用、遗传改变及功能富集
蛋白互作网络分析显示,PUMs 共表达基因的Top20 互作蛋白包括SH3D19、NANOS1、CNOT8、DHX58、NANOS3、NOP9、SEPHS1、RBBP6、TRIM71、CLINT1、FTH1、FTL、WDR46、SIRT7、DAZL、DAZ1、RBM45、REXO4、PARP1 及DNAJC6,见图4A。基于R 语言对PUMs 共表达基因进行富集分析,结果显示,BP 中主要富集于RNA 剪切、P53 类介质对信号转导的正向调节作用、RNA 定位、RNA 转运、mRNA 转运、核转运及甲基化等过程;CC 中主要富集于核斑点、剪接体组装、核被膜、转录因子复合体和细胞基质连接等;MF 主要富集于RNA 催化活性、钙粘蛋白(E-cadherin)结合、转录共激活因子活性、P53 结合位点、细胞黏附分子、甲基转移酶活性及Ras-GTP 酶活性等;KEGG 主要富集于剪接体、RNA 转运、真核生物核糖体生物发生、mRNA 监测、细胞周期、泛素介导的蛋白质水解、内吞作用及肌肉萎缩侧索硬化等信号通路,见图4B。采用cBioPortal 探索肝癌中PUMs 的遗传改变,结果显示,348 例肝癌患者样本中73 例(21%)患者PUMs 基因发生了改变,根据TCGA-Pan-Cancer Atlas 数据集,在肝癌中PUM1、PUM2、PUM3 基因改变分别为5%、10%和8%,见图4C。

图4 肝癌中PUMs 的共表达基因蛋白-蛋白相互作用及其遗传改变、GO/KEGG 功能富集
2.6 PUMs 与肿瘤免疫细胞浸润的相关性
基于ssGSEA 免疫浸润算法评估PUMs 表达与24 种不同免疫细胞类型的关系,在肝癌中PUM1、PUM2、PUM3 表达与辅助性T 细胞、中枢记忆性T 细胞、辅助性T 细胞2 及嗜酸性粒细胞浸润水平均呈正相关关系(P 均<0.05),见图5。
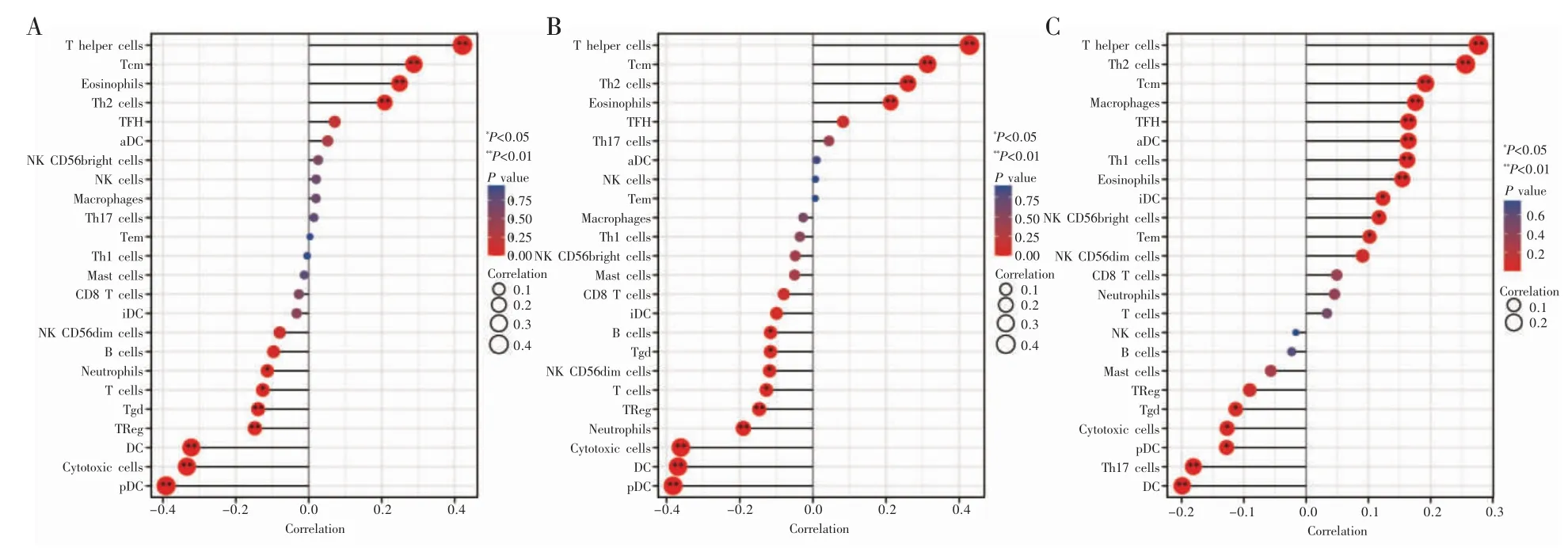
图5 肝癌中PUF 家族基因表达与免疫细胞浸润的相关性
3 讨论
肝癌是目前全球最常见、致死率最高的癌症之一,肝癌患者早期通常无非特异性临床表现,大多数患者就诊时已无根治性手术机会,且肝癌容易对化疗产生耐药性,在治疗方面仍存在较大局限性[16-17]。因此,为了改善肝癌患者的预后,仍需进一步研究肝癌的分子调控机制、挖掘新的诊断和预后指标。既往研究[18]已证明,转录后基因表达调控的失调在癌症中起着非常重要的作用,肿瘤细胞能够劫持转录后基因表达调控机制,介导肿瘤细胞适应局部微环境。RBPs 作为关键的转录后调控因子,参与RNA 剪接、多聚腺苷酸化、调节mRNA 稳定性、亚细胞定位、蛋白质翻译和降解等过程[18]。而PUMs 表达失调介导神经系统疾病、心血管疾病及恶性肿瘤的发生[19]。本研究结果表明,PUM1、PUM2、PUM3 mRNA 在肝癌组织中均为高表达;PUM1、PUM2、PUM3 阳性蛋白表达主要集中于细胞核或细胞质;且PUMs 基因与肝癌恶性进展均有相关性;在生存分析中发现,PUM1、PUM2、PUM3 高表达的肝癌患者预后差。对PUMs 共表达基因进行信号通路富集分析,其中在RNA 剪切、P53 类介质对信号转导的正向调节作用、剪接体组装、转录因子复合体、Ecadherin 结合、P53 结合位点及细胞周期中显著富集,这提示PUMs 基因在肝癌中高表达,导致其靶点RNA 转录失调,而这些靶点RNA 编码肿瘤细胞增殖、细胞凋亡和细胞周期过程中调控因子,进而介导肿瘤恶性进展过程。因此,在癌症背景下对PUMs 蛋白进行研究,能够在未来为肿瘤个体化综合治疗提供新的分子治疗靶点。
PUM1 蛋白在哺乳动物中具有重要作用,参与细胞周期、DNA 修复和细胞更新等生理过程。PUM1 在许多不同类型的癌症中促进细胞生长、侵袭和转移,并抑制细胞凋亡[20]。Guan 等[6]发现,卵巢癌中的PUM1 水平显著高于正常组织,下调PUM1 表达介导STAT3、BCL2、MMP2 和VEGFA的表达水平下调,PUM1 在体外诱导卵巢癌细胞生长、迁移和侵袭。在胰腺癌中,PUM1 mRNA 表达水平与胰腺癌的预后和肿瘤的发生相关,PUM1可作为胰腺癌的潜在诊断指标;此外,PUM1 的DNA 甲基化水平影响其在胰腺癌中的致癌作用,PUM1 能通过改变免疫细胞浸润来抑制免疫微环境,从而影响胰腺癌的免疫治疗反应[20]。在前列腺癌中,PUM1 呈高表达水平,沉默PUM1 表达能够抑制肿瘤细胞增殖和细胞周期阻滞,揭示了PUM1 的过表达通过抑制负细胞周期调节因子CDKN1B 的表达来促进肿瘤恶性进展的新机制[21]。同时,与正常结肠细胞系相比,PUM1 mRNA 在原发性和转移性结肠癌细胞系中呈高表达水平,PUM1 高表达能够促进肿瘤增殖、侵袭和转移,验证了PUM1 在维持癌症干细胞中的作用[22]。并且PUM1 在西妥昔单抗耐药结肠癌细胞系中表达上调,PUM1 靶向正反馈调节DDX5 表达,并在西妥昔单抗耐药机制中扮演重要角色[23]。体内外实验研究表明,下调PUM1 表达介导PERK/eIF2/ATF4 信号通路抑制胰腺癌细胞增殖、侵袭、转移、上皮间质转化(EMT)和促进细胞凋亡,证实敲降PUM1 能够提高胰腺癌细胞对肿瘤坏死因子相关凋亡诱导配体的敏感性,充分表明PUM1可能成为提高胰腺癌细胞对化疗敏感性的新靶点[24],与既往研究一致。本研究佐证了PUM1 参与了肝癌的发生发展过程,具体机制可能是PUM1 的高表达促进了肝癌细胞增殖且介导免疫细胞浸润,从而促进了肝癌恶性进展并降低了患者的总体存活率。
PUM2 全长约80 kb,由20 个外显子构成,位于染色体2p24.1 上,其转录形成985 个氨基酸构成的PUM2 蛋白,常见于大脑、心脏、肝脏、肾脏等组织的细胞质中,能够通过抑制细胞周期基因的表达来促进干细胞增殖[25-26]。Zhang 等[27]研究表明,PUM2 在乳腺癌组织中的表达明显升高,与乳腺癌患者的总生存期和无复发生存期呈负相关,体外实验表明,PUM2 可以通过与miR-376a 竞争性结合NRP1-3’UTR 来促进乳腺癌细胞“干性”。在卵巢癌中,PUM2 的表达水平在顺铂耐药卵巢癌细胞和患者组织中上调,靶向敲低PUM2 表达能够逆转小干扰RNA-USP46 诱导的顺铂耐药性,提示PUM2 参与卵巢癌顺铂耐药的过程[28]。同时,PUM2 在胶母细胞瘤癌组织及细胞系中表达升高,敲低PUM2 表达能够显著抑制肿瘤细胞增殖和迁移[29]。PUM2 在结直肠癌中的高表达,靶向敲低PUM2 表达,显著抑制结肠癌细胞增殖和细胞周期G1/S 阻滞,揭示了PUM2在肿瘤恶性进展中的作用及其作为治疗靶点的潜力[30]。本研究表明,肝癌中PUM2 表达水平升高,且同患者不良预后密切相关。但是PUM2 在骨肉瘤组织中的表达降低,PUM2 通过与miRNA分竞争性结合STARD13 3’UTR 来抑制。骨肉瘤恶性进展[31]。由此可见,肿瘤中PUM2 的表达及作用具有一定的异质性。因此,探索PUM2 在正常组织中转录调控机制及其在不同类型癌症中的失调至关重要,可能为未来的治疗提供新的候选目标。
PUM3 结构域呈L 形,其通过和磷酸骨架的相互作用与RNA/DNA 结合,PUM3 在原始生殖细胞核中定位,沉默PUM3 表达介导生殖细胞中P53 过度活化,揭示了PUM3 在生殖细胞发育过程中的重要作用[32]。然而,关于PUM3 在肿瘤进展中的作用知之甚少。PUM3 表达与宫颈癌患者的总生存期相关,敲低PUM3 表达能够显著抑制肿瘤细胞增殖、侵袭、转移[33]。Chodary 等[34]利用生物信息学分析表明,PUM3 基因能够作为结直肠癌的预后/诊断生物标志物。采用免疫组织化学研究表明,在Ⅰ、Ⅱ、Ⅲ和Ⅳ期乳腺癌标本中,PUM3 的表达水平明显高于导管原位癌,PUM3 过表达能够促进乳腺癌的发生发展,其机制可能与调节其下游靶点mRNA 表达相关[35]。本研究表明,肝癌组织中PUM3 过表达,且其表达水平在患者肿瘤T 分期及病理分期中差异有统计学意义,PUM3 高表达的肝癌患者预后不良,为PUM3 在肿瘤恶性进展中的重要作用提供了一定的理论依据。此外,在肝癌中,本研究分析了PUM1、PUM2、PUM3 表达与免疫细胞浸润的关系,结果显示PUM1、PUM2、PUM3 表达与辅助性T 细胞、中枢记忆性T 细胞、辅助性T 细胞2 及嗜酸性粒细胞浸润水平呈正相关,但PUM1、PUM2、PUM3 与肿瘤浸润免疫细胞的直接关系仍需组织样本及细胞实验进一步研究。
综上所述,PUF 家族基因参与调控mRNA 在人体各种组织中的翻译过程,其相关基因表达在癌症中受到干扰,导致其靶点mRNA 表达失调,进而介导肿瘤相关恶性进展过程。本研究结果表明,PUM1、PUM2、PUM3 过表达是肝癌恶性进展过程中的关键分子特征,提示PUM1、PUM2、PUM3 可能是肝癌药物治疗的潜在靶点。

