蜀葵ArbHLH148 基因克隆与表达分析
高 文,闫庚洋,左俊凯,许 乐,侯蕊利,景其昌,任 昊
(河南科技大学 园艺与植物保护学院,河南 洛阳 471000)
植物在生长发育及响应各种胁迫时,其结构基因的表达除了受外部环境因素的调控,还受内部转录因子的调节,如MYB、bHLH、WRKY、MADS-box、bZIP、NAC、AP2/ERF、TCP 等转录因子[1-8]。它们主要通过与结构基因启动子中的顺式作用元件相结合来激活或者抑制结构基因的表达,从而满足植物生长发育需求或者响应胁迫反应。其中,碱性螺旋-环-螺旋(Basic helix-loop-helix,bHLH)转录因子[9],在其氨基酸序列的N端有15~20个保守氨基酸组成的碱性区域(Basic region),该区域可识别Ebox(5′-CANNTG-3′)结构,并与之结合。在C 端有约40 个疏水氨基酸组成的螺旋-环-螺旋区域(Helix-loop-helix,HLH),2 个HLH 区域通过疏水氨基酸的相互作用形成同源或者异源二聚体来调控结构基因的表达。目前已在多种植物中鉴定出了大量的bHLH 转录因子,如在水稻、拟南芥、玉米、番茄、海滨木槿、枇杷、梅中分别有167、147、208、159、162、160、100个成员[10-16]。bHLH 转录因子在植物花器官发生、激素应答、次生代谢、胁迫响应等方面均有重要作用[17-21]。
蜀葵是我国的传统观赏花卉之一,因具有丰富的花色和漂亮的花型而深受人们青睐。尤其是重瓣花型,因具有层次分明、形式多样、立体感强等特点而备受关注。赵印泉等[22]认为重瓣花有6 种起源方式,包括积累起源、苞片起源、雌雄蕊起源、台阁起源、重复起源和花序起源。而雄蕊瓣化现象在蜀葵中非常普遍,是产生重瓣花型的重要原因。课题组前期采用转录组测序技术分析了蜀葵雄蕊瓣化的相关基因[23],筛选出一个高表达的bHLH 转录因子基因,根据功能注释,将其命名为ArbHLH148。本研究采用逆转录PCR 方法克隆该基因并进行生物信息学鉴定、qPCR 表达分析等,进一步探讨其生物学功能,旨为该基因在蜀葵花型分子改良中的应用奠定基础。
1 材料和方法
1.1 蜀葵材料
供试蜀葵种植于农丰农业科技有限公司(洛阳辛店镇)。采集刚开放的红色重瓣蜀葵的花朵及其萼片、花瓣、雄蕊、瓣化雄蕊,每样5 份,分别置于50 mL 塑料管中,液氮速冻后,于-80 ℃冰箱保存,备用。
1.2 RNA抽提及其反转录
RNA 抽提严格按照M5 HiPer Plant RNeasy Complex Mini Kit(货号MF045-01,北京聚合美生物科技有限公司)使用说明书进行。反转录则按照M5 First Strand cDNA Synthesis Kit(货号MF011-T,北京聚合美生物科技有限公司)使用说明书执行。
1.3 ArbHLH148基因克隆及其序列分析
将转录组拼接结果TRINITY_DN6354_c0_g2 用NCBI 中的ORF finder 工具进行分析,发现其具有672 bp 的开放阅读框,编码223 个氨基酸。据此开放阅读框设计引物bHLH148-Fo:5′-TAGTGGATCCAAAGAATTCATGGCGTCCACGATAACGAAT-3′,bHLH148-Ro:5′-CGAGAAGCTTTTTGAATTCTTACTGACAAGTCGACGGAGGAG-3′。以红色重瓣蜀葵花朵cDNA 为模板,按照M5 Magic High-Fidelity DNA Polymerase(with dNTPs)使用说明书进行扩增。具体扩增条件:95 ℃2 min;95 ℃25 s,61 ℃25 s,68 ℃25 s,共36 个循环;68 ℃5 min。用1%琼脂糖凝胶电泳检测正确的PCR 产物与载体pSAK277 重组,转化大肠杆菌DH5α,并送上海生工生物工程股份有限公司测序。
首先,将测序结果进行BLASTn分析(NCBI),以确认其是否为bHLH 转录因子。其次,进行系统进化树分析(MEGA 11.0),以明确其进化关系;用在线程序(MEME)识别其结构功能区域。然后,对其蛋白质的理化性质、疏水性、跨膜区域、亚细胞定位、信号肽等信息进行分析(Protparam 程序等),进一步了解其可能的结构和功能。
1.4 ArbHLH148基因表达模式分析
分别抽提红色重瓣蜀葵萼片、花瓣、雄蕊、瓣化雄蕊的RNA 并反转录成cDNA,具体操作与1.2 相同。为了更好地了解ArbHLH148基因功能,同时分析了与其功能发挥有关的基因[24-27]的表达模式。以18S作为内参基因,引物序列详见表1。qPCR 按照2×M5 HiPer SYBR Premix Es Taq(with Tli RNaseH)(货号MF787-01,北京聚合美生物科技有限公司)使用说明书于CFX96 PCR 仪中完成,每样品设3 个生物学重复。具体程序:预变性95 ℃30 s;变性95 ℃5 s,60 ℃30 s,共40个循环。基因表达量采用2-△△Ct方法计算。

表1 实时荧光定量PCR引物序列Tab.1 Primer sequences for real-time fluorescence quantitative PCR
1.5 生长素(IAA)含量检测
采用植物IAA 酶联免疫检测试剂盒(货号FX-96T,上海研谨生物科技有限公司)分别检测萼片、花瓣、雄蕊、瓣化雄蕊的IAA 含量。按试剂盒说明书进行具体操作。每个样品设3个生物学重复。用SPSS 20.0软件进行数据分析。
1.6 基因表达量与IAA含量之间的相关性分析
为 了 明 确ArbHLH148、ArIAA1、ArARF8和ArTIR1基因表达量与IAA 含量之间的相关性,根据宋粉鲜等[28]的相关性标准对二者进行相关性分析。
2 结果与分析
2.1 ArbHLH148基因克隆
以红色重瓣蜀葵花朵cDNA 为模板,以引物bHLH148-Fo 和bHLH148-Ro 进行PCR 扩增。PCR产物用1%琼脂糖凝胶电泳检测,可知其片段大小与引物扩增长度相吻合(图1a)。通过测序分析可知,其片段大小为672 bp,编码223个氨基酸(图1b)。与NCBI 数据库比对,发现其与树棉(Gossypium arboreum)bHLH148 转录因子基因(LOC108487387)序列具有80%的一致性(E 值为1e-119),因此命名为ArbHLH148。

图1 ArbHLH148基因克隆Fig.1 Cloning of ArbHLH148 gene
2.2 ArbHLH148系统进化分析
用MEGA 11.0 软件对ArbHLH148 与162 个拟南芥的bHLH 转录因子[29]做系统进化分析,结果表明,其与拟南芥AtbHLH147、AtbHLH148、AtbHLH149、AtbHLH150在进化关系上很近(图2)。
2.3 ArbHLH148结构功能域识别
在http://meme-suite.org/meme/tools/meme 网站,进一步将ArbHLH148 与AtbHLH147、AtbHLH148、AtbHLH149、AtbHLH150 的氨基酸序列做比对分析,发现其具有典型的碱性螺旋-环-螺旋结构,即bHLH 保守结构域(图3)。表明ArbHLH148 确实是 bHLH家族成员之一。

图3 ArbHLH148及其同源蛋白的保守结构域分析Fig.3 The conserved domain analysis of ArbHLH148 and its homologous proteins
2.4 与ArbHLH148功能相关的其他分析
采用http://web.expasy.org/网站的Protparam 程序对ArbHLH148的理化性质进行分析,其氨基酸序列由223个氨基酸组成,分子式为C1056H1798N332O314S10,相对分子质量为24 490.53。理论等电点为11.09。其在280 nm 处的水溶液消光系数为14 105 L/(mol·cm)。不稳定指数为44.08。亲水性平均值(GRAVY)为-0.613。表明该蛋白质是中性溶液中带正电荷的、不稳定的亲水性蛋白质。
采用http://www.csbio.sjtu.edu.cn/bioinf/eukmulti-2/网站的Euk-mPLoc 2.0 软件对ArbHLH148的亚细胞定位情况进行分析,结果表明,其定位于细胞核中。采用http://www.cbs.dtu.dk/services/SignalP/网站的SignalP-5.0 软件对ArbHLH148 的信号肽进行分析,结果表明,其没有信号肽。采用www.cbs.dtu.dk/services/网站的TMHMM-2.0 软件对ArbHLH148 的跨膜区域进行分析,结果表明,其没有跨膜区。
综合上述分析结果,表明该蛋白质是位于细胞核内的、没有跨膜区的非分泌蛋白。这些结果与ArbHLH148的转录因子属性是一致的。
2.5 qPCR表达分析
以红色重瓣蜀葵的萼片、花瓣、雄蕊和瓣化雄蕊为试材,并以18S作为内参基因,对ArbHLH148及其功能相关基因在不同组织中的表达水平进行实时荧光定量PCR 分析。结果显示,ArbHLH148在萼片、花瓣、雄蕊和瓣化雄蕊中均有表达。但其在雄蕊中的表达量相对较多,在花瓣、瓣化雄蕊和萼片中的表达量依次减少。而且,ArbHLH148与生长素信号相关基因ArIAA1、ArARF8、ArTIR1在雄蕊和瓣化雄蕊中的表达量差异很大,均已达到了显著水平(图4)。表明其在蜀葵花的发育中发挥着重要作用,特别是对蜀葵雄蕊的发育影响较大。说明ArbHLH148基因可能通过生长素信号途径间接对蜀葵雄蕊发育起重要作用。

图4 ArbHLH148及其功能相关基因在不同组织中的表达分析Fig.4 The expression analysis of ArbHLH148 and itsfunctionally related genes in different tissues
2.6 IAA含量分析
为 了 验 证ArbHLH148、ArIAA1、ArARF8和ArTIR1基因的表达差异对IAA 含量水平的影响,进一步对萼片、花瓣、雄蕊和瓣化雄蕊中的IAA 含量进行分析。结果发现,IAA在雄蕊、花瓣和瓣化雄蕊中的含量依次降低,且在雄蕊中的平均含量最多(159.16 ng/g),而在瓣化雄蕊中的平均含量最少(49.58 ng/g),二者差异达到了显著水平(图5)。这与IAA 信号相关基因在雄蕊、花瓣和瓣化雄蕊中的相对表达量依次降低相似。说明这些基因的表达差异与IAA含量水平可能有一定的关联。
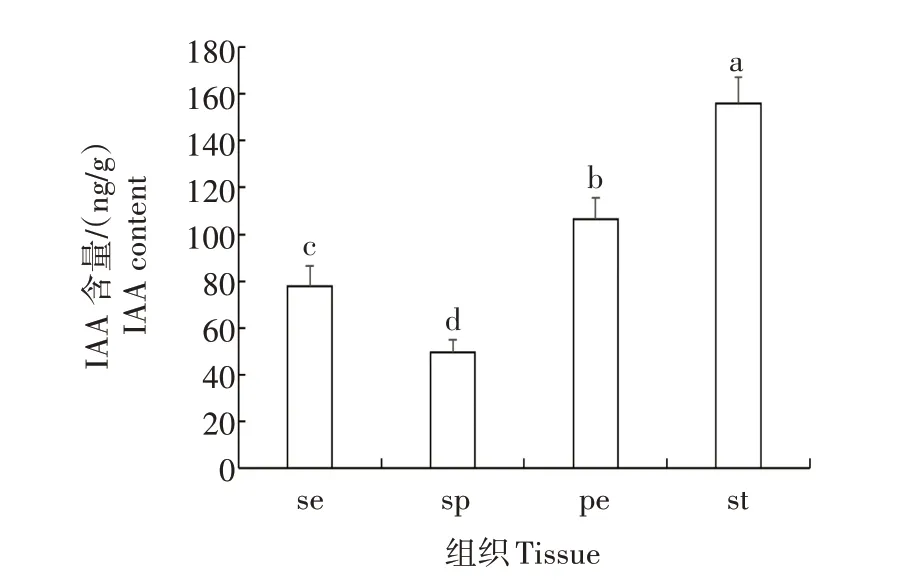
图5 不同组织IAA含量分析Fig.5 Analysis of auxin content in different tissues
2.7 基因表达量与IAA含量的相关性分析
为 了 明 确ArbHLH148、ArIAA1、ArARF8和ArTIR1基因的表达差异与IAA 含量水平之间的关系,分析这些基因的相对表达量与IAA 含量的相关性。结果表明,每个基因的相对表达量与IAA 含量均呈正相关关系(相关系数r>0)(图6)。其中,ArbHLH148和ArIAA1基因的相对表达量与IAA含量呈显著正相关,相关系数分别为0.994 和0.961(图6a—b);而ArARF8和ArTIR1基因的相对表达量与IAA 含量呈高度正相关,相关系数分别达到了0.887和0.854(图6c—d)。说明不同组织中的IAA含量水平确实与这些基因的表达差异密切相关。尤其是在雄蕊和瓣化雄蕊中IAA 含量的剧烈变化可能是造成蜀葵雄蕊瓣化的重要原因。

图6 不同组织中基因表达量与IAA含量的相关性分析Fig.6 Correlation analysis of gene expression levels and IAA content in different tissues
3 结论与讨论
有研究表明,随着植物花发育的启动,植物生长素信号被生长素受体蛋白TIR1/AFBs 感知,同时招募AUX/IAA-ARFs 蛋白复合体并降解其中的AUX/IAA 蛋白,从而释放ARFs 转录因子以调节雄蕊的发育[24]。与野生型相比,在tir1、afb1、afb2和afb3四重突变体中,由于缺乏感知生长素信号的TIR1/AFBs蛋白,造成雄蕊发育异常,致使约25%的花丝变短和约90%的早熟花药开裂[25]。在生长素反应因子arf6和arf8的双重突变体中,由于生长素信号缺失导致下游茉莉酸水平的降低,从而使雄蕊和花瓣的生长均受到了阻碍,最终造成了花苞开放延迟。但是在喷施外源茉莉酸后,该双重突变体的雄蕊和花瓣又恢复了正常生长[26]。在茉莉酸诱导下,JAZ 蛋白被降解了,使bHLH-MYB 转录复合体激活下游基因的表达以促进雄蕊发育[27]。这些结果表明,参与生长素和茉莉酸信号途径的TIR1、ARF8、bHLH基因的异常表达确实造成了雄蕊发育异常。为了验证ArbHLH148 转录因子与蜀葵雄蕊瓣化的关系,选取了与其功能发挥密切相关的基因进行qPCR 分析,如ArIAA1、ArARF8、ArTIR1。结果发现,除了ArIAA1外,ArbHLH148、ArARF8、ArTIR1在雄蕊中的表达量均较高,但是这4 个基因在瓣化雄蕊中的表达量却相对较低。表明生长素水平降低可能是导致蜀葵雄蕊发育异常,造成其雄蕊瓣化的原因。进而对样品中的生长素含量进行分析,发现生长素在雄蕊、花瓣和瓣化雄蕊中的含量依次降低,这与ArbHLH148、ArIAA1、ArARF8、ArTIR1基因在雄蕊、花瓣和瓣化雄蕊中的表达趋势一致。进一步表明,生长素含量变化及其相关基因的表达差异可能是蜀葵雄蕊瓣化的原因。但是,关于生长素含量变化以及ArbHLH148、ArIAA1、ArARF8、ArTIR1基因的表达差异是否为蜀葵雄蕊瓣化的直接原因,仍需要转基因试验加以验证。这也为进一步研究雄蕊瓣化现象指明了方向。
花瓣原基的起始也是受植物生长素信号调控的[30],且生长素水平梯度变化是所有植物器官形成的一种共同的调控方式,而无论其成熟形态或发育起源如何[31]。蜀葵ArbHLH148、ArIAA1、ArTIR1和ArARF8基因在瓣化雄蕊、花瓣、雄蕊中的表达量呈现由低到高的趋势,表明这些基因的表达变化调控着雄蕊和花瓣的发育。拟南芥bHLH 转录因子BIGPETALp(BPEp)与ARF8 的复合体通过控制细胞的分裂和繁殖来影响花瓣的发育,如arf8突变体的花瓣明显大于野生类型,且这种变化是与早期生长素反应基因的表达变化相一致的[17]。同时,通过生长素信号调控的ETTIN/ARF3 也影响着花瓣的数量[32]。菊花bHLH 转录因子CmBPE2 与TIFY 家族CmJAZ1-like 的复合体通过调控细胞扩张来影响花瓣的大小,如抑制CmBPE2的表达会引起细胞扩张相关基因的下调表达,从而导致花瓣变小[33]。这些研究表明,bHLH 转录因子通过植物生长素信号途径和茉莉酸信号途径参与了花瓣发育过程。
综上所述,ArbHLH148 转录因子可能通过复杂的植物激素调控网络间接参与了蜀葵雄蕊瓣化现象。但是这需要进一步的试验加以验证。希望将来有更多的试验结果来解析雄蕊瓣化现象,为重瓣植物的选育及其观赏品质的提升奠定基础。

