猪IFN-α8 的原核表达及抗猪繁殖与呼吸综合征病毒活性研究
方剑玉,张青娴,郎利敏,徐 彬,2,王改利,2,席燕燕,2,冯现明,王克领,李绍钰,2
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;2.河南省农业科学院 畜禽繁育与营养调控河南省重点实验室,河南 郑州 450002;3.林州市动物疫病预防控制中心,河南 林州 456550)
我国是世界生猪第一生产与消费大国,猪的规模化养殖在我国呈现持续稳步增长,随之而来的猪病毒性传染病也成为困扰我国养猪业的一大难题,严重威胁着养猪业的健康、绿色、可持续发展。猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征 病 毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的以母猪流产和仔猪呼吸道症状为主要特征的高度接触性传染病[1]。PRRSV 属于尼多病毒目(Nidovirales)、动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus),该病毒感染后可破坏猪的肺泡巨噬细胞(Porcine alveolar macrophages,PAM),造成猪的免疫抑制,极易引起其他病原体的继发感染[2-3]。目前,PRRS 已成为危害我国养猪业的重要动物疫病之一,而且目前预防该病的商品疫苗效果并不理想。因此,研发低毒高效且无生物残留的新型抗PRRSV药物,已经成为目前养猪业健康发展的当务之急。
干扰素(Interferon,IFN)是一种由细胞产生的具有抗病毒、抗细胞增殖及免疫调节作用的分泌性糖蛋白。干扰素可用于多种病毒病的治疗,如乙型肝炎[4]、丙型肝炎[5]、人免疫缺陷病[6-7]、猪流行性腹泻[8]、非洲猪瘟[9]等。病毒感染机体后诱导干扰素产生,识别细胞干扰素受体后,通过一系列信号级联反应,诱导数百个干扰素下游基因(ISG)转录,从而发挥其抗病毒作用[10]。根据干扰素的分子结构与受体相结合的方式,可将其分为Ⅰ型(IFN-α、FN-β、IFN-ε、FN-κ和IFN-ω)、Ⅱ型(IFN-γ)和Ⅲ型(IFNλ)[11]。其中IFN-α 是最重要的Ⅰ型干扰素,研究证明,IFN-α 干扰素抗病毒活性最强。猪干扰素α(poIFN-α)包括17 个亚型,且不同亚型poIFN-α 的抗病毒活性差异较大[12-13]。有研究报道,poIFN-α能有效抑制PRRSV的感染和复制,但具体到各个亚型对PRRSV 感染的抑制效果,目前尚未见报道。因此,明确不同亚型poIFN-α 对PRRSV 的抗病毒活性,筛选对PRRSV 具有最强抗病毒活性的poIFN-α亚型,在PRRS 预防和治疗上具有重要意义。前人研究表明,真核系统表达的重组猪干扰素α8(poIFN-α8)在牛肾细胞(Bovine kidney cell,MDBK)上对猪伪狂犬病毒(Pseudorabies virus,PRV)具有较好的抗病毒活性[14]。采用基因工程方法制备的重组干扰素,克服了传统干扰素表达量低、时间长等缺点。与真核表达系统相比,原核表达系统具有培养方法简单迅速、经济、适合大规模生产工艺等优点,商业化的干扰素产品多采用原核表达系统进行生产。目前,采用原核系统表达重组IFN-α8 的抗病毒活性研究未见报道。鉴于此,首次采用原核表达系统对poIFN-α8 进行表达,用Ni-琼脂糖凝胶纯化柱纯化后,在猪肺泡巨噬细胞(PAM)细胞上测定重组蛋白对PRRSV 的抗病毒活性及其对ISG 的诱导水平,旨在为新型抗PRRSV药物的研发提供依据。
1 材料和方法
1.1 主要材料
PAM 分 离 自4~6 周 龄 的SPF 仔 猪,PRRSV BB0907 株由南京农业大学动物医学院惠赠,含His-Tag的温控型原核表达载体pCSMH和重组猪干扰素α2(poIFN-α2)蛋白、猪干扰素α5(poIFN-α5)蛋白由河南省农业科学院畜牧兽医研究所兽医实验室制备并保存[15]。
1.2 主要试剂
预染蛋白质Marker、氨苄青霉素(Ampicillin)、DMEM 细胞培养液、Ni-NTA 琼脂糖凝胶、尿素、盐酸胍购自北京索莱宝科技有限公司;DH5α 感受态细胞、XhoⅠ和BamH Ⅰ限制性内切酶、Ni-琼脂糖凝胶纯化柱购自TAKARA 生物工程有限公司;核酸提取试剂盒、质粒提取试剂盒、反转录试剂HiScriptⅢRT SuperMix for qPCR(+gDNA wiper)、SYBR Green Real-time PCR Master Mix 试剂盒、T4 连接酶均购自南京诺唯赞生物科技股份有限公司;鼠源抗猪IFN-α 多克隆抗体购自武汉云克隆科技股份有限公司;羊抗鼠荧光二抗(IRDye®680RD)购自美国LI-COR 公司;BCA 蛋白质浓度测定试剂盒购自碧云天生物技术公司;蛋白质浓缩柱购自LABSELECT 公司;RNA 提取试剂盒购自OMIGA公司。
1.3 重组表达质粒pCSMH-poIFN-α8的构建
poIFN-α8基因序列(GenBank ID:GQ415068)用DNAStar 软件分析后,去掉N 端69 bp 的信号肽序列,由浙江尚亚生物技术有限公司进行合成。将合成的poIFN-α8基因和pCSMH 空载体用XhoⅠ和BamH Ⅰ限制性内切酶进行双酶切,经胶回收纯化后,用T4 连接酶在16 ℃连接15 min。将连接产物转化DH5α大肠杆菌感受态细胞,提取质粒,用XhoⅠ和BamH Ⅰ限制性内切酶进行双酶切鉴定,将双酶切产物进行琼脂糖凝胶电泳。将鉴定的阳性质粒送浙江尚亚生物工程有限公司进行测序,将重组质粒命名为pCSMH-poIFN-α8。
1.4 重组IFN-α8蛋白的表达及分离纯化
将阳性单克隆菌落接种至含50 μg/mL 氨苄青霉素的LB 培养基扩大培养,30 ℃条件下180 r/min振荡培养至菌液OD600在0.6~0.8。进一步将菌液转移至42 ℃条件下,进行温度诱导,200 r/min 振荡培养6 h;收集菌体,6 000 r/min 离心15 min,弃上清,加入PBS 缓冲液(pH=7.0)洗涤菌体,重复清洗一次;按照菌体∶溶解Buffer(50 mmol/L NaH2PO4,300 mmol/L NaCl,pH=8.0)=1∶10 将菌体悬浮混匀,加入1 mmol/L PMSF 和0.2~0.4 mg/mL 溶菌酶,冰上孵育20 min。将菌体用超声破碎仪破碎25 min,超声5 s 间歇5 s,至菌液澄清。将破碎后菌液转移至离心管中,4 ℃条件下12 000 r/min离心20 min,弃上清,用菌体裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,6 mol/L guanidine hydrochloride,pH=8.0)将包涵体进行溶解变性,采用Ni-琼脂糖凝胶纯化柱按照说明书对重组poIFN-α8 蛋白进行分离纯化,采用浓缩柱进行脱盐复性处理后,用BAC 蛋白质浓度测定试剂盒测定目的蛋白浓度,最后采用SDSPAGE电泳对纯化后的目的蛋白进行检测。
1.5 Western blot 试验鉴定重组poIFN-α8反应原性
采用Western blot 试验鉴定纯化后的重组poIFN-α8 蛋白,将纯化后的重组poIFN-α8 蛋白进行SDS-PAGE 电泳,将电泳后的蛋白质转印醋酸纤维素膜(NC),23 V 电压转印30 min。NC 膜用含10%脱脂乳的PBST(10 mmol/L Na2HPO4,2 mmol/L KH2PO4,137 mmol/L NaCl,2.7 mmol/L KCl,0.5%吐温-20)过夜封闭后,加入1∶1 000 稀释的鼠源抗猪干扰素的抗体进行特异性反应,用TBST 洗膜3 次,加入羊抗鼠荧光二抗(IRDye®680RD),进行显色反应。
1.6 重组poIFN-α8抗PRRSV活性测定
1.6.1 实时荧光定量PCR 引物的设计及合成 根据GenBank 中 登 录 的OSA1、ISG15、MX1、PRRSVORF7、β-actin基因序列,利用软件Oligo 7 设计实时荧光定量PCR 引物,其引物序列信息见表1,引物由浙江尚亚生物技术有限公司进行合成。
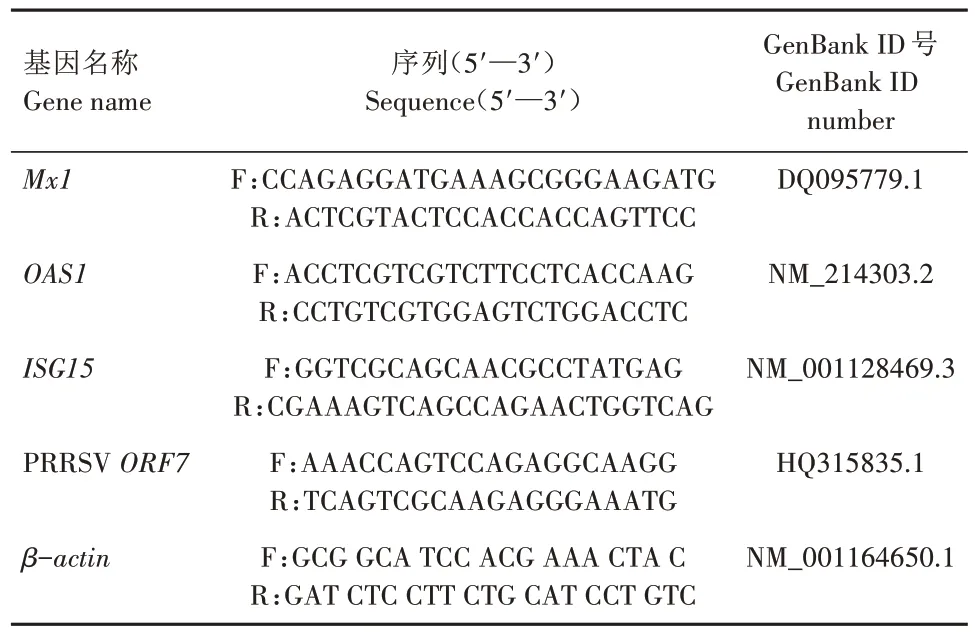
表1 实时荧光定量PCR引物序列Tab.1 Sequences of the primers used in real-time fluorescence quantitative PCR
1.6.2 重组poIFN-α8抑制PRRSV 增殖试验 用含2%胎牛血清(Fatal bovine serun,FBS)的DMEM 将获得的重组干扰素稀释成相应质量浓度[12]。将PAM 细胞接种至24 孔板,每孔2×105个细胞,待细胞铺满单层后,分别加入0.01、0.05、0.1、1 ng/mL 的重组poIFN-α8,同时设置未处理对照组(CK)。24 h后接种1 000 TCID50的PRRSV,感染24 h 后收集细胞,采用实时荧光定量PCR方法检测细胞内PRRSV的RNA 水平。首先采用OMIGA 公司的RNA 提取试剂盒提取细胞总RNA,利用HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)反转录试剂盒合成cDNA,反转录体系:8 μL 提取的RNA(总RNA 不超过500 ng)及2 μL 5×qRT SuperMix Ⅱ。逆转录反应过程:25 ℃10 min,50 ℃30 min,85 ℃5 min。合成的cDNA 用SYBR Green Real-time PCR Master Mix预混酶在ABI公司7300型全自动荧光定量PCR仪上进行实时荧光定量PCR 扩增反应,同时β-actin基因作为内参。反应条件:预变性95 ℃5 min;95 ℃10 s,60 ℃30 s,共40个循环;反应结束后利用ABI 7300 软 件 分 析 数 据,采 用2-ΔΔCt法 进 行 相 对 定量[16]。同时,收集细胞上清,检测上清中PRRSV 的TCID50[17]。进一步比较poIFN-α8 与poIFN-α2、poIFN-α5在PAM 上 的 抗PRRSV 活 性,将0.05 ng/mL 的poIFN-α2、poIFN-α5、poIFN-α8 分别处理PAM(未处理组为CK),24 h 后接种1 000 TCID50PRRSV,感染24 h 后,收集细胞,采用荧光定量PCR 方法检测细胞内PRRSV 的RNA 水平。同时,收集细胞上清,检测细胞上清中PRRSV的TCID50。
1.6.3 重组poIFN-α8 对细胞ISG 的激活作用试验 将PAM 细胞接种24 孔板,每孔2×105个细胞,24 h 待细胞长成单层后,加入0.1 ng/mL 的重组poIFN-α8处理PAM细胞,同时设置空白对照(CK)。24 h 后收集细胞,采用实时荧光定量PCR 的方法检测细胞内干扰素刺激基因Mx1、OAS1、ISG15的mRNA水平。
2 结果与分析
2.1 重组表达质粒pCSMH-poIFN-α8的鉴定
将poIFN-α8基因序列合成后,克隆入含His-Tag 的真核表达载体pCSMH,获得重组质粒pCSMH-poIFN-α8,经XhoⅠ和BamH Ⅰ双酶切鉴定,结果如图1 所示,在大小3 800 bp 和545 bp 位置有特异性条带,与预期目的片段大小相符,对酶切产物进行测序,采用DNAStar软件进行比对分析,结果证明重组质粒构建成功。
2.2 重组poIFN-α8蛋白在大肠杆菌的诱导表达和纯化
离心收集温度诱导后的菌体,随后使用Ni-琼脂糖凝胶纯化柱纯化poIFN-α8 蛋白,样品经SDSPAGE 分析后,结果如图2 所示。从图2 可以看出,在19.1 ku 的位置可观察到高纯度的重组蛋白目的条带,与预期相符。

图2 纯化后的poIFN-α8蛋白SDS-PAGE电泳结果Fig.2 SDS-PAGE analysis of purified poIFN-α8 protein
2.3 Western blot鉴定重组poIFN-α8蛋白
从图3 可以看出,poIFN-α8 重组蛋白在预期位置出现了相应的特异性条带,poIFN-α8重组蛋白可与鼠源抗猪干扰素的抗体进行特异性反应,证明本试验表达蛋白具有良好的反应原性。
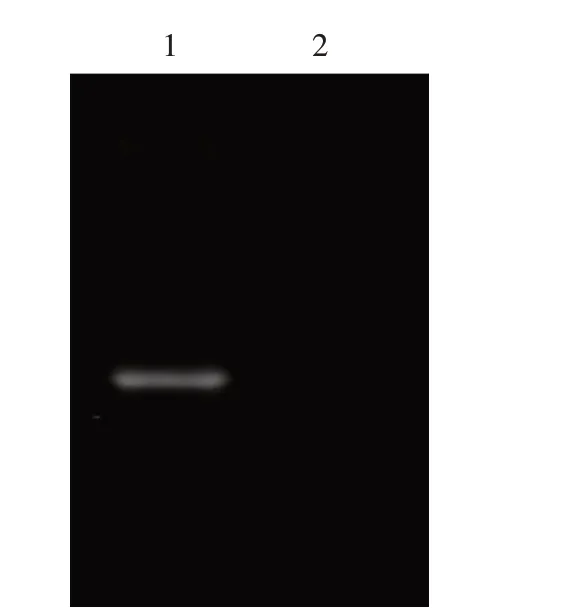
图3 重组poIFN-α8蛋白Western blot鉴定结果Fig.3 Western blot identification of recombinant poIFN-α8 protein
2.4 重组poIFN-α8蛋白活性测定结果
2.4.1 重组poIFN-α8 抑制PRRSV 增殖试验结果
从图4A 可以看出,0.05 ng/mL 重组poIFN-α8 处理PAM 细胞,显著抑制了PRRSV 的RNA 复制。而0.01 ng/mL重组poIFN-α8处理细胞后,PRRSV RNA在细胞内仍维持较高水平。同时,从图4B 可以看出,在 接 种1 000 TCID50的PRRSV 24 h 后,0.05 ng/mL 重组poIFN-α8 处理细胞,细胞上清中病毒拷贝数相比对照组显著下降,而0.01 ng/mL 重组poIFN-α8 处理细胞,细胞上清中PRRSV 的病毒拷贝数相比对照组下降较少。同时比较0.05 ng/mL的重组poIFN-α2、poIFN-α5、poIFN-α8 在PAM 上的抗PRRSV 复制作用(图4C、D),poIFN-α8 的抗PRRSV 效果显著优于poIFN-α2、poIFN-α5,0.05 ng/mL 重组poIFN-α8 在PAM 细胞上对PRRSV 具有最优的抑制活性。
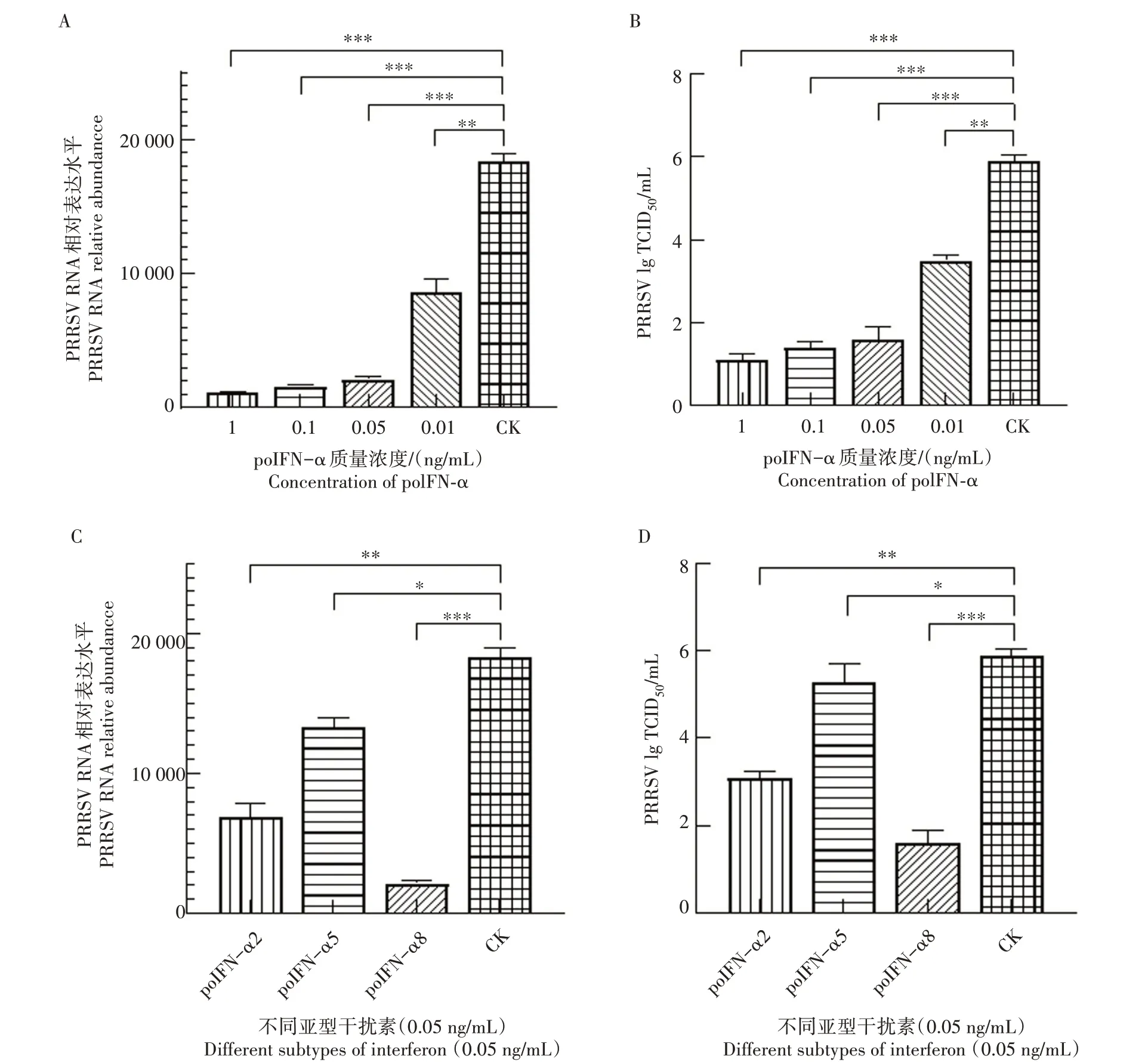
图4 重组蛋白poIFN-α8抑制PRRSV复制效果Fig.4 Antiviral effect of recombinant poIFN-α8 against PRRSV
2.4.2 重组poIFN-α8 蛋白对细胞ISG 的激活试验结果 图5 结果显示,与未处理细胞组相比,0.1 ng/mL poIFN-α8 处理组Mx1、OAS1、ISG15基因mRNA 水平显著升高,证明重组蛋白poIFN-α8诱导了PAM 内干扰素下游基因的上调表达,从而发挥抑制PRRSV复制的作用。同时,对比了重组poIFN-α2、poIFN-α5、poIFN-α8 对下游基因的诱导活性,结果显示,重组poIFN-α8在细胞上诱导ISG 的水平高于poIFN-α2、poIFN-α5处理组。

图5 重组poIFN-α8处理PAM细胞后ISG基因上调结果Fig.5 Up-regulation of ISGs gene induced by recombinant poIFN-α8 in PAM cells
3 结论与讨论
天然免疫系统是宿主抵抗病原体感染的第一道防线。当病毒感染动物机体后,干扰素作为抗病毒因子之一,在很短时间内便可迅速达到峰值[18]。已有研究证明猪的Ⅰ型干扰素在针对PRRSV 感染的抗病毒免疫中发挥了重要的作用,poIFN-α 已应用于PRRSV 感染的临床治疗[19-21]。poIFN-α 干扰素具有17个亚型,各亚型针对不同病毒的抗病毒活性差异较大[14,22]。有研究报道,真核系统表达的poIFN-α8 对猪伪狂犬病毒(PRV)有较好的抗病毒活性[14],但真核表达系统由于表达量低、成本高等特点,较难应用于工业化生产。此外,前期研究结果也表明,原核表达的重组poIFN-α2 蛋白能有效抑制PRRSV 在Marc-145 和PAM 细胞上的复制[15]。为了明确原核表达的poIFN-α8蛋白对PRRSV 的抗病毒活性,比较不同亚型poIFN-α对PRRSV 的抑制作用。本研究采用原核表达系统温度诱导表达poIFN-α8 蛋白,处理PAM 细胞后,采用实时荧光定量PCR 的方法检测细胞内PRRSV 病毒的RNA 水平,与无干扰素处理感染组相比,poIFN-α8 处理细胞内PRRSV RNA水平显著下降,结果证明poIFN-α 8 显著抑制了PRRSV 在细胞内的复制。此外,从本研究结果来看,poIFN-α8 的抗病毒活性高于poIFN-α2、poIFN-α5 等 亚 型 的 干 扰 素。尽 管poIFN-α8 与poIFN-α2、poIFN-α5 等亚型的核苷酸和氨基酸序列同源性高达95%以上,但其在细胞上抑制PRRSV复制的能力却存在较大差异,分析该差异可能与不同亚型poIFN-α 诱导ISG 的水平和与受体结合的能力相关。
与真核和酵母表达系统相比,原核表达系统具有表达量高、表达蛋白活性好、成本低、易于纯化、便于工业化生产等优点[23-24],本研究获得的原核表达重组poIFN-α8 的抗病毒效价为0.05 ng/mL,高于HUANG 等[25]用酵母表达系统表达的poIFN-α 的抗病毒效价,低于SANG 等[26]以真核系统表达的poIFN-α6 在Marc-145 细胞上针对PRRSV 的抗病毒效价(0.02 ng/mL)。本研究结果表明,原核表达的poIFN-α8 对PRRSV 具有较好的抗病毒效果,为抗PRRSV药物的筛选提供了数据。
IFN识别细胞上的干扰素受体,诱导ISG的转录和表达,从而发挥抗病毒作用。本研究将poIFN-α2、poIFN-α5、poIFN-α8接种PAM 细胞,检测了不同亚型poIFN-α 干扰素诱导下游基因Mx1、OAS1、ISG15转录的水平,研究结果表明,poIFN-α2、poIFN-α5、poIFN-α8 在PAM 细胞上诱导下游ISG 转录的水平与其抑制PRRSV复制的效果基本一致。可见,不同亚型poIFN-α 诱导细胞ISG 转录的能力与其抗PRRSV 的效果具有重要的相关性。以前对于不同亚型poIFN-α 抗病毒活性差异的研究相对较少,在临床上盲目用一种亚型poIFN-α 治疗病毒感染的效果并不理想。明确不同亚型poIFN-α 的抗病毒活性,对于提高干扰素临床治疗PRRS 的效果具有重要意义。
本研究结果表明,通过原核表达系统制备的重组poIFN-α8 蛋白活性高、易于纯化生产、成本低,对PRRSV 具有较好的抗病毒活性,为PRRS 的防治提供了新的数据和资料。

