ENU 诱变构建Jag1 基因mRNA 剪接异常眼畸形小鼠模型
徐 佳,魏婉娥,吴秋一,释晓纯,王 烁,陈 兵,3,4
(1.扬州大学 学报编辑部,江苏 扬州 225009;2.扬州大学 兽医学院,江苏 扬州 225009;3.扬州大学 江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.扬州大学 教育部禽类预防医学重点实验室/江苏省动物预防医学重点实验室,江苏 扬州 225009)
齿状基因1(Jag1)编码的细胞膜表面蛋白齿状蛋白1(Jagged1),是缺刻蛋白(Notch)受体的主要功能性配体之一,目前已发现哺乳类动物有4 种不同的Notch,均属于单次跨膜蛋白,其结构由胞外区(ECN)、跨膜区(TM)及胞内区(NICD/ICN)三部分组成。相邻细胞间Notch 受体与配体相互作用引发2次Notch 受体蛋白水解反应,从而将Notch 细胞膜内区域(NICD)从质膜中释放出来。NICD 进一步转移到细胞核,结合效应蛋白和转录激活蛋白,调控蛋白质表达,对细胞的增殖、分化与凋亡有着重要作用[1-3]。
1997 年,人类第1 次在Alagille 综合征(ALGS)中发现了Jag1基因突变[4]。此后,便不断出现Jag1基因突变引发相关人类疾病的报道,其中除了多系统发育异常的常染色体显性遗传病ALGS之外[5],还有一部分法洛四联症(TOF)[6-7]。此外,Jag1基因变异与多种类型的恶性肿瘤相关,包括乳腺癌、脑癌、结肠直肠癌和卵巢癌等[2,8-11]。也有报道Jag1基因敲除可引起小鼠眼畸形(包括角膜病)[12-14],但未对其角膜病变特点进行进一步分析。
乙烷基亚硝基脲(ENU)是人工合成的高效烷化剂,通过将ENU 注射小鼠及后代表型筛选可获得多种突变表型,从而建立多种模拟人类和其他动物疾病的小鼠模型[15-18]。角膜位于眼球壁最外层,由于其特定的生理位置,使得角膜疾病成为动物临床上最为常见的眼科疾病之一。宋怡文等[19]于2016年4 月至2017 年12 月在中国农业大学动物医院共接诊223 例犬角膜病病例,说明该病在犬中多见。廖诗英等[20]研究发现,坏死性角膜炎是猫较为常见的角膜疾病。在猫科动物中也报道过有关彼得异常(Peters anomaly)的眼部疾病,患猫角膜混浊并伴有青光眼,经证实,该眼病为遗传性眼病,可能与晶状体泡从表层外胚层分离不全有关[21]。马属动物也易患角膜病,患马表现为角膜变白且混浊、视力减弱等,严重时会导致马匹失明[22]。除上述动物常见角膜病外,角膜病也是人类第四大致盲眼病[23]。鉴于此,通过ENU 诱变获得眼畸形(含角膜病变)小鼠模型,以期为人和动物角膜病致病同源基因的鉴定及防治等奠定基础。
1 材料和方法
1.1 供试动物及饲养条件
成年清洁级C57BL/6J(B6)小鼠由扬州大学比较医学研究院提供。实验动物生产许可证号为SCXK(苏)2022-0007,实验动物使用许可证号为SYXK(苏)2022-0044。
饲养条件:试验小鼠均在屏障环境内饲养,温度为(23±2)℃,湿度为(55±5)%,昼夜12 h/12 h明暗交替。小鼠饮食和采水自由,饲料购买于江苏省协同医药生物工程有限公司,经过60Co 照射。定期更换鼠笼和垫料并且进行环境消毒。
1.2 主要试剂及仪器
ENU(#3385-1G,美国Sigma 公司);一抗:抗Keratin10(K10)抗体(#ab76318,英国Abcam 公司)、抗Keratin12(K12)抗体(#ab185627,英国Abcam 公司)、抗Keratin14(K14)抗 体(#ab181595,英 国Abcam 公司);二抗:山羊抗兔IgG(#BA-1000,美国Vector labs公司);SABC(#PK-6100,美国Vector labs公司);DAB 显色试剂盒(#SK-4100,美国Vector labs 公司);Mayor’s 苏木素(#AR0005,武汉博士德生物工程有限公司);蛋白酶K[#9034,宝生物工程(大连)有限公司]。
石蜡切片机(RM2235,德国Leica公司);光学显微镜(DM1000,德国Leica 公司);PCR 仪(T100 Thermal Cycler,美国Bio-Rad 公司);凝胶成像系统(ChemiDoc XRS+,美国Bio-Rad公司)。
1.3 试验方法
1.3.1 ENU 诱变、突变表型筛查及遗传试验 用pH 值6.0 的磷酸盐缓冲液配制质量浓度为5 mg/mL的ENU。然后将ENU 以100 mg/kg 剂量腹腔注射野生型B6雄鼠(G0),每周注射1次,共注射3次。ENU诱变的雄鼠会有一段时间的不育期,因此最后1 次腹腔注射B6 雄鼠(G0)后,约2 个月之后以1∶3 的比例配种同品系野生型雌鼠,获得子代小鼠(G1)。在G1小鼠断奶时,主要针对其眼部等表型进行筛查。将获得的异常表型小鼠与野生型B6小鼠配种,观察并记录后代小鼠中是否出现相同表型以及出现的比例。
1.3.2 苏木精-伊红(HE)染色 舒泰麻醉后颈椎脱臼法处死小鼠,取8 周龄小鼠混浊眼球及同龄对照组眼球各3 只,置于4%多聚甲醛中于4 ℃固定24 h 以上。固定后组织按常规方法进行石蜡切片的制作,HE染色后于光学显微镜下观察。
1.3.3 免疫组织化学染色 将眼球组织切片脱蜡、脱水等处理后采用常规步骤进行免疫组织化学染色。
(1)内源性过氧化物酶的灭活:利用3%的过氧化氢溶液于室温条件下处理组织切片10 min,用PBS 缓冲液(pH 值7.4)洗涤3 次;(2)抗原修复:将组织切片浸入pH 值为6.0 的柠檬酸盐缓冲液(0.01 mol/L)中,置于微波炉中加热至沸腾后停止,间隔5 min 后进行二次修复,冷却至室温,用PBS 缓冲液(pH 值7.4)洗涤3 次;(3)封闭:滴加5% BSA 封闭液,于室温条件下封闭20 min,轻轻甩去封闭液;(4)加 一 抗:滴 加 稀 释 的K10(1∶4 000)、K12(1∶300)、K14(1∶4 000)一抗,4 ℃孵育过夜,次日用PBS 缓冲液(pH 值7.4)洗涤2 次,每次4 min;(5)加二抗:滴加稀释后的生物素化二抗(1∶400),于37 ℃条件下孵育25 min,用PBS 缓冲液(pH 值7.4)洗涤2次,每次3 min;(6)加SABC:滴加SABC(1∶100),于37 ℃条件下孵育25 min,用PBS 缓冲液(pH 值7.4)洗涤3次,每次4 min;(7)DAB 染色:使用DAB显色试剂盒于室温条件下显色10 min,蒸馏水洗涤3 次,每次2 min;(8)复染细胞核:用Mayor’s 苏木素染色液复染2 min,蒸馏水洗涤3 次,自然晾干后用中性树胶封片并观察。
1.3.4 微卫星定位标记体系的选择 小鼠基因组有19 对常染色体,为了对小鼠进行全基因组扫描,选择的微卫星要平均分布于各条染色体上,在同一染色体上的遗传距离不超过40 cM,并且B6和C3之间的差异尽量在10 bp 以上。根据以上方式选择定位所需微卫星标记,共挑选出49个微卫星标记用来定位眼畸形小鼠的突变基因,其中45个微卫星用于初 步 定 位(D1Mit373、D1Mit415、D1Mit291、D2Mit369、 D2Mit249、 D2Mit311、 D2Mit200、D3Mit49、D3Mit127、D4Mit111、D4Mit42、D5Mit356、D5Mit168、D6Mit274、D6Mit15、D7Mit56、D7Mit145、D7Mit66、D8Mit190、D8Mit271、D9Mit191、D9Mit11、D10Mit194、 D10Mit233、 D11Mit20、 D11Mit333、D12Mit46、 D12Mit233、 D13Mit3、 D13Mit224、D13Mit76、 D14Mit259、 D14Mit165、 D15Mit63、D15Mit245、 D16Mit88、 D16Mit76、 D16Mit106、D17Mit66、D17Mit123、D18Mit149、D18Mit187、D19Mit41、D19Mit91、D19Mit33),4 个微卫星则是用于 精 确 定 位(D2Mit336、D2Mit258、D2Mit107、D2Mit423)。
1.3.5 DNA 提取及PCR 反应 将B6背景眼畸形小鼠与野生型C3小鼠配种得到F1,再将F1小鼠与野生型B6小鼠回交获得N2眼畸形小鼠,采用蛋白酶K 消化和酚氯仿法[18]提取每只具有突变表型N2小鼠的鼠尾DNA,用PCR 法对提取的DNA 进行扩增。微卫星PCR反应体系为25 μL,利用梯度PCR反应,摸索所选微卫星PCR 反应的最佳退火温度,根据试验需要选择最合适的退火温度,其中D2Mit107、D6Mit274、D14Mit165 的 退 火 温 度 为55 ℃,D2Mit249 的退火温度为60 ℃,其余的微卫星引物的退火温度均为58 ℃。
1.3.6 连锁分析 因为微卫星是共显性标记,在分析[(B6×C3)F1×B6]N2小鼠的微卫星PCR 产物电泳检测结果时,把携带突变表型且只伴有来源于B6微卫星标记的样本记为亲组合,把携带突变表型且同时伴有B6及C3微卫星标记的样本记为重组合。采用优势对数计分(Log odds score,LODs)法将致病基因定位于小鼠的特定染色体上。
1.3.7 候选基因信息搜集与引物设计 根据突变基因的精确定位结果,利用Mouse Genome Informatics(MGI)数据库的信息资源,查询定位区域间的各基因序列相关信息,再对这些基因进行相关功能查询并分析,最终确定了候选基因Jag1。根据数据库中信息查询Jag1基因的DNA 或mRNA 序列信息,设计相关引物(表1),表1 中的引物覆盖了Jag1基因整个编码区序列。
1.3.8 PCR、RT-PCR 产物测序 分别提取野生型或眼畸形小鼠鼠尾DNA 及脑总RNA,采用表1 中的引物进行PCR 或RT-PCR 扩增,扩增产物经过胶回收后直接测序,将眼畸形小鼠直接测序结果与野生型及数据库中B6小鼠的基因序列进行对比分析,逐一筛查突变位点。
1.3.9 T-A 克隆测序结果分析 由于突变杂合子RT-RCR 产物中出现连续重叠信号,故将该RTPCR 产物进行T-A 克隆后再次测序并对测序结果进行分析,评估该突变对Jag1基因mRNA 剪接过程的影响。T-A 克隆及序列分析由上海生工生物工程有限公司完成。
2 结果与分析
2.1 ENU诱导眼畸形小鼠及遗传试验结果
通过ENU诱变B6雄鼠(G0)20只,待其恢复生殖能力后分别与野生型B6雌鼠配种,生产了G1小鼠共305 只,经显性突变筛选法筛选出眼部异常、卷尾、腹部白斑等突变表型的G1小鼠共33 只,其中1例小鼠突变表型为眼畸形。
将该小鼠(G1)与野生型B6雌鼠配种,得到G2小鼠,将筛选到有突变表型的G2小鼠继续与野生型B6小鼠配种,得到G3小鼠,以此类推,持续传代。在记录的120 只后代小鼠中,有56 只小鼠出现虹膜缺损、角膜混浊或同时可见虹膜缺损及角膜混浊的眼部异常表型(图1),其中角膜混浊小鼠22 只、虹膜缺损小鼠20只、同时可见角膜混浊及虹膜缺损表型小鼠14 只。在56 只携带突变表型的后代小鼠中记录雌性小鼠30只,雄性小鼠26只。

图1 眼畸形小鼠表型特征Fig.1 Phenotype picture of mice eye malformation
2.2 眼畸形小鼠眼球组织学分析
选择8 周龄出现角膜混浊表型的眼畸形小鼠,制作小鼠眼球组织石蜡切片。
2.2.1 HE 染色结果 HE 染色后显微镜下观察,可见野生型小鼠角膜结构层次分明,上皮细胞层呈整齐排列,且上皮基部平整,胶原纤维呈平行排列,内皮细胞完整且明显(图2A);角膜混浊表型的突变小鼠角膜整体形态发生改变,分为2种情况:仅角膜上皮细胞层出现大量且明显的空泡样病变(图2B);角膜晶状体黏连导致的内皮细胞层断裂脱落且角膜上皮细胞层出现大量明显的空泡样病变(图2C)。

图2 小鼠角膜HE染色结果Fig.2 HE staining of mouse corneas
2.2.2 免疫组织化学分析 对眼球组织切片进行免疫组织化学染色,结果显示,野生型小鼠K10 表达呈阴性(图3A);K12 表达呈强阳性,分布于角膜上皮层的所有细胞(图3B);K14 局部表达呈阳性,主要集中在角膜上皮基底部细胞(图3C)。角膜混浊表型的突变小鼠,K10 表达呈阴性(图3D);K12表达大多呈强阳性,而角膜上皮的空泡病变部位表达明显减弱(图3E);K14 在整个角膜上皮均有表达,并且呈强阳性(图3F)。
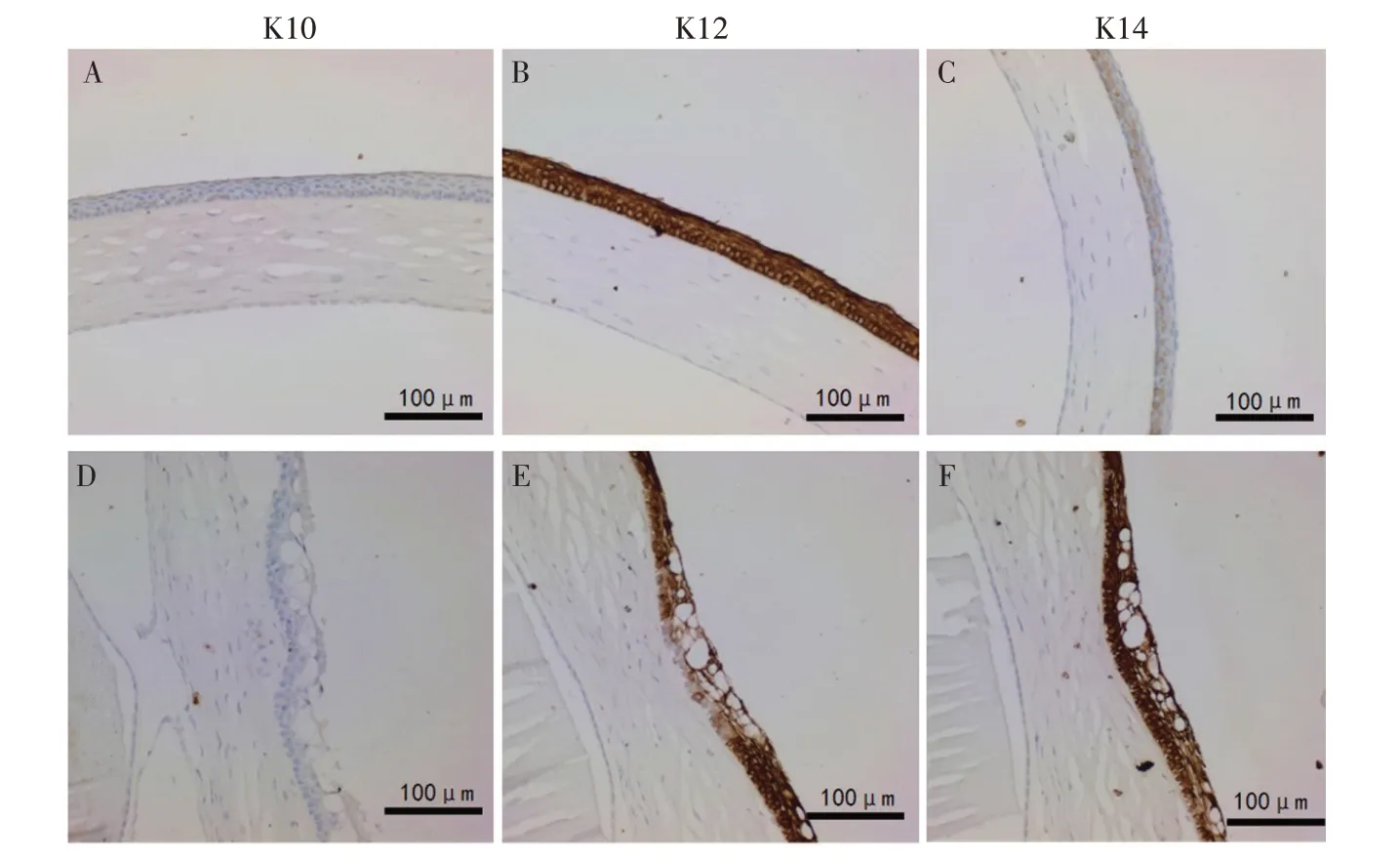
图3 角膜混浊小鼠角膜上皮抗K10、K12、K14抗体免疫组化分析结果Fig.3 Immunohistochemistry staining using anti-keratin 10/12/14 antibodies of corneal epithelium in mice with corneal opacity phenotype
2.3 眼畸形小鼠突变基因的定位结果
采用微卫星标记对常染色体进行扫描,结果显示,微卫星D2Mit249(距着丝粒54.07 cM)在16个N2小鼠的DNA 样品中只发生了1例交换(图4),LODs为3.19,可以判定该突变基因与微卫星D2Mit249 连锁(表2)。
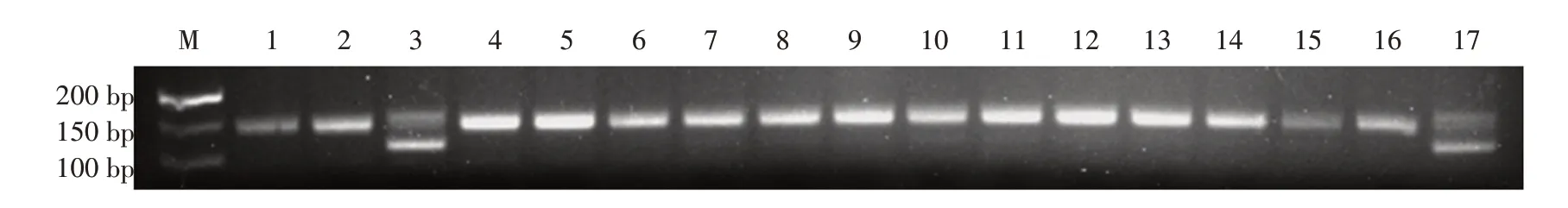
图4 D2Mit249对部分[(B6×C3)F1×B6]N2小鼠检测结果Fig.4 Detection of some N2 mice with eye malformation[(B6×C3)F1×B6]by D2Mit249

表2 眼畸形突变基因与D2Mit249的连锁分析过程Tab.2 Linkage analysis between eye malformation mutant gene and D2Mit249
为了进一步缩小突变基因的位置范围,在初步定位结果的基础上增加N2小鼠的DNA样品数至122例并且选择较高密度的微卫星标记。定位结果显示,122个N2样品中突变基因与微卫星D2Mit107(距着丝粒65.13 cM)处发生2例交换,LODs为32.27,与微卫星D2Mit423(距着丝粒73.57 cM)处发生5例交换(图5),LODs 为27.66,可以确定该突变基因位于小鼠第2号染色体D2Mit107与D2Mit423之间。
2.4 眼畸形小鼠候选基因的鉴定
利用MGI 数据库的信息资源,对精确定位区域内的基因逐一进行分析,发现定位区域内的Jag1基因突变会出现眼部畸形表型,故确定了Jag1基因为眼畸形小鼠的候选基因。采用所设计引物对Jag1基因PCR或RT-PCR,产物经胶回收后直接测序,结果显示,从外显子25 开始,突变杂合小鼠测序信号图出现连续的重叠信号,结果重复3 次(图6A),初步推测存在mRNA剪接异常。
将RT-PCR回收产物直接测序结果出现重叠信号的序列条带进行T-A 克隆,然后随机挑选8 个克隆进行测序分析。结果显示,其中3 个克隆为野生型序列,5 个克隆从外显子25 起出现7 个碱基的缺失(图6B)。正常的Jagged1蛋白由1 218 aa构成,蛋白质预测结果显示,该基因突变导致Jagged1 蛋白从1 016 aa 后开始发生移码(图6C),最终引起该突变蛋白质翻译提前终止(1 032 aa)。
继续对外显子25侧翼序列测序发现,Jag1基因第24 号内含子3′端碱基AG 被碱基GG 所替代,最终导致在mRNA剪接过程识别外显子25中第6位及第7 位AG 碱基(图6D),从而引起突变序列7 个碱基的缺失。
3 结论与讨论
通过比较大量的真核生物的内含子发现,它们的两侧边界绝大部分有1 对保守GT-AG 内含子序列,即5′端为GT,3′端为AG,这类称为GT-AG 的内含子均以相同的方式剪接。一般按照内含子的方向从左到右依次称为5′剪接点和3′剪接点,也叫作供体位点(Donor)和受体位点(Acceptor)[24]。ENU诱导小鼠引起的主要突变类型包括A/T颠换成T/A、A/T转换成G/C、G/C颠换成C/G、A/T转换成C/G及G/C转换成T/A。这些类型的突变在蛋白质水平上会导致10%的无义突变、26%的拼接错误和64%的错义突变[15]。本研究发现,在DNA 水平上,由于Jag1基因第24 号内含子的3′端AG 碱基被GG 碱基所替代(属于A/T 转换成G/C 型),导致在mRNA 剪接过程识别外显子25中第6位及第7位AG碱基,从而引起mRNA 剪接异常,是导致眼畸形小鼠突变表型形成的分子基础。该突变导致Jagged1 蛋白跨膜区与胞内区完全缺失,属于功能缺失型突变。
Jagged1 蛋白属于Notch 受体的主要功能性配体之一,目前关于Jagged1 的研究主要在其与ALGS关系[5]。Jag1基因敲除可出现小鼠眼畸形表型,其中包括角膜病[14],但未对角膜组织进行进一步组织学分析。角蛋白(Keratins)参与构成细胞的骨架系统,对细胞或组织结构的稳定起着重要作用。角蛋白成对表达,其表达具有分化类型依赖性、组织特异性,故角蛋白可作为上皮细胞分化状态或分化阶段的重要生化标记。K5/K14 在有丝分裂活跃的上皮细胞表达,即复层鳞状上皮的基底层细胞;K3/K12 是成熟角膜上皮细胞分化的特征;K1/K10主要表达于皮肤上皮,被视为皮肤型分化晚期阶段的特征[25]。本研究对Jag1基因突变小鼠角膜病变特点进行进一步分析,发现突变小鼠角膜上皮局部K12 免疫组化分析结果为阴性并且K14 表达增强,而K10 不表达。结果提示,该突变小鼠角膜上皮细胞分化发生异常,但未发生角质化。
综上,本研究通过ENU 诱变获得1 例Jag1基因等位突变小鼠,该小鼠眼部表现出角膜混浊和虹膜缺损等眼部畸形,并对其病变特点进行分析,为人和动物相关眼病的研究奠定了基础。

