废旧三元锂离子电池正极材料资源化回收研究进展
赵丹阳,张 翔,徐 帆,隋艳伟
(中国矿业大学材料与物理学院,江苏 徐州 221000)
中央全面深化改革委员会第二次会议强调,要建设更高水平开放型经济新体制,推动能耗双控逐步转向碳排放双控。“双碳”背景下,构建以电化学储能为主体的新型电力系统已成为实现清洁能源的高效利用,推动能耗双控逐步转向碳排放双控的重要途径[1]。锂离子电池自1991年商业化以来,全球锂离子电池产业蓬勃发展。锂离子电池凭借重量轻、工作范围宽、能量密度高、使用寿命长以及自放电率低等优点,目前已广泛应用于电动汽车、便携式电子设备及储能装备等领域[2-5]。随着电动汽车行业对于电池质和量的需求不断提高,锂离子电池作为储能型和动力型的电化学储能器件成为当前研究热点之一,其产量也逐年增长[6]。据统计,仅2021年,我国生产的锂离子电池多达232.64亿只,当年同比增长22.4%[7],2022年增长至235.2亿只,相较于2015—2021 年期间年均产量137.67 亿只,增长率高达70%。随着电子设备的更新迭代及电动交通工具产业的迅猛发展,中国锂离子电池的市场需求不断增大,这不仅给锂离子电池原材料供应带来了严峻的挑战,随之带来的退役锂电池循环利用问题也被广泛关注。
然而锂离子电池使用寿命是有限的(3C类产品用锂离子电池约为1~3年,动力电池约为8~10年),新能源行业的快速发展产生了大量的退役锂离子电池[8]。第一批电动汽车的使用寿命开始接近尾声,据估测[9-10],在2017—2030年期间,全球范围内预计将产生超过1100 万吨退役锂离子电池,并且自2025 年起,报废动力电池将超过便携设备用锂离子电池,主导锂离子电池回收市场,这成为巨大的市场机遇。在“电动中国”背景下,我国近年来新能源汽车领域的快速发展将使我国成为全球最大的锂离子电池回收市场。根据预测[11-12],2040年全球锂离子电池回收的市场规模可增长至310 亿美元,而其中超过50%的份额在中国实现。科学、高效且低成本地回收废旧锂电池中的金属元素,成为国家发展规划中的战略重点之一。
废旧锂离子电池具有突出的资源特性,富含锂(Li)、钴(Co)、镍(Ni)、锰(Mn)和铜(Cu)等金属元素,成为重要的有价金属矿藏[13-14],而正极材料中这些金属含量可占整个电芯总质量的50%,尤其是Li(1.9%)、Ni(12.1%)、Co(2.3%)、铜(13.3%)等元素含量远高于金属矿石[15]。我国为贫锂国家,锂资源重度依赖进口,同时Ni、Mn、Co等资源的大量消耗也使得锂离子电池无法满足我国在动力电池和大规模储能方面的战略布局[16-17]。因此,合理地对废旧锂离子电池中金属元素进行回收将有效缓解电池原材料供应链紧张的问题,成为促进资源循环利用的重要举措。此外,三元锂离子电池中重金属、有机溶剂、电解质等丰富化学物质对环境构成了严重的威胁[18]。因此,开发相应的回收再利用技术对这些废旧三元锂离子电池进行处理和管理,将有效缓解自然资源枯竭和环境污染问题[19]。开展废旧锂离子电池的回收与再生工作具有重要的经济价值和环保意义。
因此,本文论述了废旧三元锂离子电池回收的必要性与发展现状,展望废旧锂离子电池资源化回收工艺存在的问题和面临的挑战,以期最大化发展锂离子电池的应用价值,同时保障电池产业链稳定健康发展。
1 预处理
锂离子电池主要由电池壳、正极、负极、电解液、隔膜和集流体组成,组分复杂,为了安全高效地对废旧锂离子电池三元正极材料进行回收,一般需要对退役锂离子电池进行完全放电、拆卸、分离等预处理工序,详细的预处理过程如图1所示。
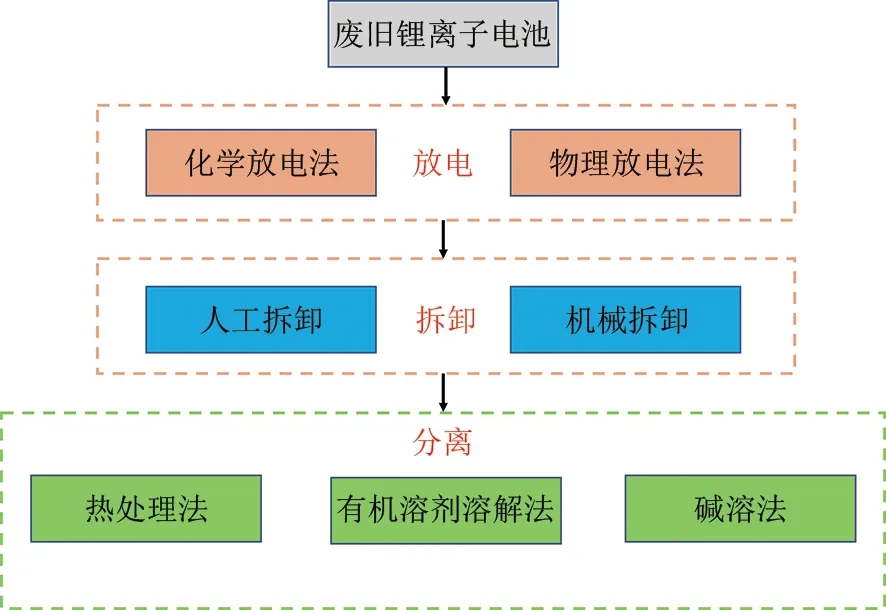
图1 废旧锂离子电池的预处理过程Fig.1 Pre-treatment process of waste lithium-ion batteries
1.1 放 电
常用的放电方法有物理放电法和化学放电法,2 种方法均是通过使电池形成有效回路,从而释放废旧锂离子电池中的余能,降低后续处理过程中电池短路或自燃的风险。苏勇等[20]将放电装置直接与废旧锂电池相连接形成短路放电,最终使电池电压降到0.1 V 左右。物理放电法不会对电池结构造成破坏,但放电过程中电池中剩余电能快速转化为热能,大规模处理时极易发生电池爆炸等危险。NaCl 溶液由于放电效率稳定以及较低的成本备受关注,但高浓度的盐溶液容易腐蚀电池外壳,造成有价金属的损失以及有机电解质的泄漏。Fang等[21]比较了锂离子电池在不同盐溶液中的放电效率以及电极腐蚀程度,发现锂离子电池在(CH3COO)2Zn溶液中拥有较快放电效率的同时,电极腐蚀受到了明显的抑制。化学放电法操作简单、放电效率高,但是有机电解质极易从腐蚀的电极中泄漏,对环境造成污染。
1.2 拆 卸
拆卸过程一般分为人工拆卸和机械拆卸2种方式。实验室中为得到高纯度的产品一般采用人工拆卸的方式分离出正极片、负极片和隔膜。然而,人工拆卸处理效率低并不适合大规模的工业应用[22]。因此工业上一般采用机械对其自动化拆卸,首先将废旧锂离子电池进行机械破碎处理[23],利用锂离子电池中各组分不同的物理性质,通过筛选[24]、磁选[25-26]、热解[27-28]和浮选[29-30]等辅助方法,对各组分进行高效分离和富集。然而,锂离子电池结构复杂,不同组分之间不可避免地相互渗透,机械处理很难完全分离各组分。此外,机械破碎过程中伴随着粉尘、噪声和有机物挥发污染。
1.3 分 离
拆卸后,正极需要进一步分离,正极活性物质通过PVDF等有机黏结剂紧密地黏附在铝箔上,如何从铝箔上高效分离正极活性物质是锂离子电池回收利用的关键前提。常见的分离方法有热处理法[31]、有机溶剂溶解法[32]和碱溶法[33]。三种方法的优劣势如表1所示。

表1 预处理正极活性物质分离方法比较Table 1 Comparison of pretreatment anode active substance separation methods
热处理法是利用正极活性物质、黏结剂、导电剂和铝箔热解温度的不同,选择合适的热处理温度使正极活性物质从铝箔上脱离并去除有机杂质。PVDF 初始分解温度为350~450 ℃,完全分解温度为600 ℃[34],在此完全分解温度下,导电剂也可发生氧化分解同步除去,得到纯度较高的正极材料[35]。此法操作简单且成本较低,适用于大规模生产,但热处理过程中有机黏结剂和电解质的分解会产生HF 等有害气体。为了避免高温热处理所带来的环境危害,Wang 等[36]通过引入氧化钙,大大降低了PVDF的分解温度,在300 ℃的低温下,黏结剂PVDF 可以被CaO 原位分解吸收,并且正极活性物质与铝箔的分离率达到97.1%。
有机溶剂溶解法是采用与PVDF表现出高溶解度的溶剂通过相似相溶原理以除去PVDF。常用的有机溶剂有N-甲基吡咯烷酮(NMP)[37]、N,N-二甲基甲酰胺(DMF)和二甲基乙酰胺(DMAC)[38]。有机溶剂溶解法分离效率高,但存在着分离时间较长的缺陷,因此,超声辅助分离常常与有机溶剂溶解法并行使用。He等[39]从PVDF的溶解和超声波引起的空化2个方面揭示了分离的机理,超声波加速对流运动并提供大量能量,增加固体和液体的接触面积以加快分离效率,在最佳条件下,正极活性物质的分离效率可以达到99%。鉴于有机溶剂有毒、价格高昂且会排放有机废液,工业上大多不采用此类方法,通常运用于实验室小规模实验。
碱溶法是利用正极活性物质与铝箔在碱性溶液中溶解度的不同来实现活性物质的分离。李春艳[40]从NaOH溶液浓度、固液比、温度、反应时间4个因素探究了NaOH溶液的脱铝效率,实验表明,在最佳溶解条件下,脱铝效率可以达到92%,最终在马弗炉中500 ℃煅烧5 h 除去PVDF 和导电炭黑等杂质以得到正极活性物质。碱溶法虽分离效率高,但强碱溶液容易对设备造成腐蚀,且强碱废液的排出也会对环境造成污染。
Senćanski 等[41]比较了上述3 种方法的正极活性物质分离效率,结果表明,碱溶法最高可以得到100%的分离效率,超声有机溶剂溶解法其次,分离效率可以达到68%,热处理法分离效率最低,仅仅只有57%。
2 火法回收工艺
火法回收工艺是采用高温冶炼的方式将废旧锂离子电池中的有价金属转化为合金或者金属化合物的形式分离回收。火法回收工艺一般不需要对废旧电池材料提前进行处理,工艺简单且处理量大,同时避免了酸碱废液的产生,在电池回收行业占有一定的市场。根据使用反应剂的不同,工业上将火法回收工艺分为造渣还原熔炼法、碳热还原法和盐辅助焙烧法,如图2所示。
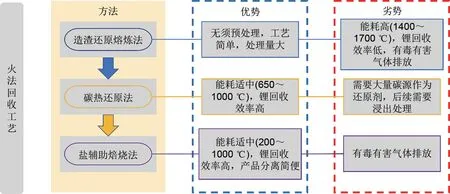
图2 火法回收工艺各方法的优势与劣势Fig.2 Advantages and disadvantages of each method of the fire recovery process
2.1 造渣还原熔炼法
造渣还原熔炼法是利用基础渣系使废旧锂离子电池中有价金属在高温下发生物理或者化学变化富集沉淀,同时电池中的有机成分还可充当还原剂促使Cu、Co、Fe、Ni 等合金化合物的形成。Ren等[42]使用MnO-SiO2-Al2O3渣型替代传统CaO-SiO2-Al2O3渣型高温熔炼废旧镍钴锰酸锂(LNCM)离子电池,在1475 ℃最佳物料比下熔炼30min,Ni、Co、Cu在金属合金中以99%的高产率回收,但Li的回收率仅仅只有2.63%,这是由于Li自身还原性较强,常常以氧化物的形式与Mn 熔融形成渣相,需要对渣相进行进一步的浸出和萃取才能得到Li和Mn。在此基础上,Hu 等[43]通过优化炉渣系统和收集烟道粉尘进一步提高了Li的回收率,并在电弧炉中完成了10000 kg 废旧电池材料的中试,为该工艺的工业实施提供了参考。
2.2 碳热还原法
为了提高Li在火法回收工艺中的回收率,常常采用碳热还原的方式将不溶性锂转化为水溶性锂来选择性提取Li。碳热还原法(CTR)通常采用木炭、石墨、焦炭等碳源作为还原剂,在650~1000 ℃范围内加热1 h 左右将正极材料转化为金属和过渡金属氧化物。与传统高温熔炼法相比,CTR所需的温度更低,并且CTR 中的Li 转化为易于回收的Li2CO3或Li2O,而不是像熔炼中那样在炉渣中损失。Huang等[44]提出一种石墨与正极材料在氮气气氛下进行碳热还原的原位回收废旧三元锂离子电池的新组合工艺,Li的回收效率显著提高到95.57%。Jiang 等[45]在碳热还原的基础上提出一种“以废治废”的方法,利用废旧电池中的导电剂乙炔黑充当碳源进行还原反应,分析了不同乙炔黑用量下三元正极材料热还原前后的物相结构转化、化合物元素价态变化及离子浸出效率,结果表明,在最佳条件下,Li 的回收效率可以达到95.67%。除此之外,Ma 等[46]利用Al 协同碳作为焙烧过程中的还原剂,焙烧后超过97%的Li 被回收,Al 的加入不仅降低了CTR 的反应温度,还规避了Al 箔作为废弃组分后续处理的问题。
2.3 盐辅助焙烧法
盐辅助焙烧法(SAR)是以盐为反应核心,通过将各种金属元素转化为水溶性产物提高回收效率。与CTR 相比,SAR 可以选择性地回收废旧正极材料中的各种元素,并且反应温度一般低于CTR。由于无机盐的多样性,SAR 又可以分为硫酸化焙烧、氯化焙烧。Lin 等[47]创新性地采用NiSO4·6H2O 选择性硫化焙烧NCM111,在550 ℃空气气氛下,NCM111 在1 h 内完全转化为LiSO4和Ni-Co-Mn 氧化物,其中,LiSO4通过水浸提取,浸出残渣可以与Li2CO3进行固相合成重新构建层状结构。为保证电荷守恒,不稳定层状结构中的Li+被释放出来并与SO混合生成LiSO4,晶格氧逸出并与Ni2+发生转化生成NiO,硫在整个闭环过程中以SO的形式保持,因此不会造成污染,在此基础上再合成的正极材料电化学性能与商业化的NCM523相当。
氯化焙烧是采用包括HCl(g)、NaCl、NH4Cl、Cl2(g)在内的氯化剂与各种金属及金属氧化物发生氯化反应生成金属氯化物,最终根据金属氯化物水溶性的差异来分离回收。Yang等[48]将三元正极材料与NH4Cl以1∶2的质量比在350 ℃下煅烧20 min,最终Li、Ni、Co 和Mn 在水中的浸出率均超过97%。相较于硫酸化焙烧,氯化焙烧的反应温度更低,但反应过程中易产生腐蚀设备的HCl气体,对环境造成严重污染。
火法回收工艺作为废旧锂离子电池回收的重要技术方法,目前已实现了从熔炼到焙烧,CTR 到SAR的转变以降低反应温度和提高各金属离子的回收率,但反应过程中产生的有毒有害气体仍需要进行后续处理。
3 湿法回收工艺
湿法冶金是从电池中提取有价金属的常用方法,其主要是利用液体溶剂对正极材料进行浸出,使有价金属以离子形式溶解在溶剂中,后续通过溶剂萃取[49]、化学沉淀[50]、离子交换[51]和电化学沉积[52]来进行金属离子的分离提纯,但此途径存在分离周期长和部分金属离子损失等问题。为最大化利用浸出后的正极材料,再生工艺无疑会成为未来的发展趋势。湿法回收工艺总体流程如图3所示。
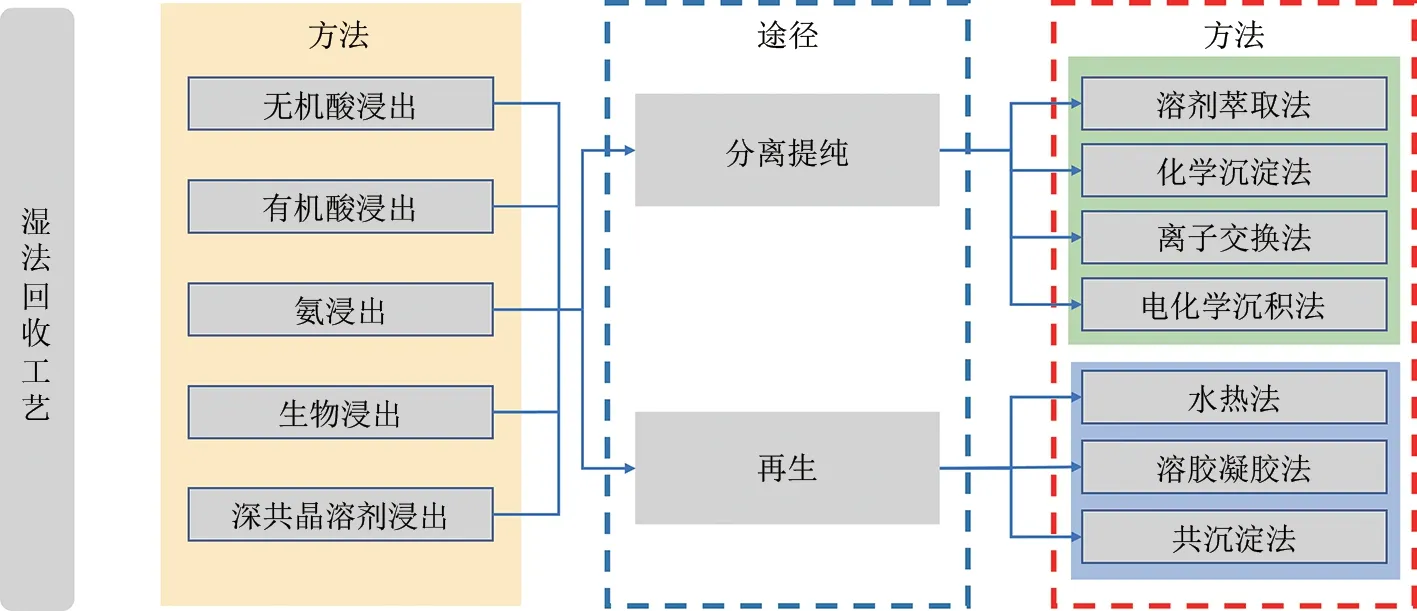
图3 湿法回收工艺总体流程Fig.3 Overall flow of the wet recovery process
3.1 浸 出
在湿法回收工艺中,浸出是必不可少的重要一环。根据浸出剂选择的不同,可以将浸出分为酸浸出、氨浸出、生物浸出和深共晶溶剂浸出,通过改变浸出条件(浓度、时间、固液比、温度、搅拌速率)来实现有价金属的最佳浸出,同时,超声波、机械化学等辅助措施也常常运用于强化浸出过程。
3.1.1 酸浸出
酸浸出主要分为无机酸浸出和有机酸浸出2种路线,无机酸主要有硫酸(H2SO4)[53-55]、盐酸(HCl)[56-57]和硝酸(HNO3)[58-59]等,此类无机酸可以溶解绝大多数的金属氧化物,但考虑到待提取的贵重金属离子以难溶的高价态形式存在,通常使用双氧水(H2O2)[60]、葡萄糖(C6H12O6)[61]和硫代硫酸钠(Na2S2O3)[62]等还原剂来实现活性物质中各高价金属离子向低价态金属离子的转变,以达到最高的浸出效率。虽然无机酸由于其强酸性,可以溶解大多数的金属离子,但是在工业运用中会产生大量的酸性废水以及Cl2和NOX等有毒气体,对环境造成极大的危害。
有机酸浸出相较于无机酸浸出,其反应体系更加温和,在同等浸出效率情况下,其对环境也更加友好。常用的有机酸有柠檬酸[63]、苹果酸[64]、甘氨酸[65]、马来酸[66]等。Wang等[67]开发了一种以DL-苹果酸为浸出剂,d-葡萄糖为还原剂,从废旧三元正极材料中回收有价金属的绿色浸出工艺,并系统地研究了浸出动力学和界面反应,结果表明,在最佳浸出条件下,Li、Ni、Co和Mn的浸出过程主要受表面化学反应模型控制,Li、Ni、Co和Mn的浸出效率分别达到98.53%、 90.14%、 90.58% 和98.66%。有机酸的浸出能力通常比无机酸弱,可以将2种酸混合通过额外的酸来影响酸和离子之间的络合来提高浸出效率。Zhuang 等[68]提出了一种新的磷酸和柠檬酸混合酸体系,以磷酸为浸出剂,柠檬酸为浸出剂和还原剂浸出三元正极材料,通过使用0.2 mol/L的磷酸和0.4 mol/L的柠檬酸(固液比为20 g/L)在90 ℃下浸出30 min,将100%的Li、93.4%的Ni、91.6%的Co 和92%的Mn 浸出到溶液中,并且柠檬酸作为一种可生物降解的有机酸,它的废液在厌氧和好氧环境下都很容易处理,磷酸又是一类温和性酸,此体系下的废液排出几乎对环境没有影响。
目前,在低固液比条件下,有机酸浸出的效率是令人满意的。然而,由于有机酸的成本相对较高,以及对有机酸复杂浸出机理的认识尚不成熟,有机酸在工业生产中的实际运用受到了限制,工业生产仍以无机酸浸出为主。
3.1.2 氨浸出
区别于酸浸出策略对于各金属离子不加选择的浸出行为,氨浸出是利用氨水、碳酸铵、氯化铵和硫酸铵为代表的溶液,通过NH4+与不同离子之间的络合作用选择性浸出过渡金属,这种选择性浸出行为可归因于过渡金属与氨配体形成的络合物溶解度和稳定性的差异。Liu 等[69]使用氨水(NH3·H2O)、碳酸铵[(NH4)2CO3]和亚硫酸铵[(NH4)2SO3]浸出三元正极活性物质。(NH4)2SO3作为还原剂增强Ni和Co的浸出效率,(NH4)2CO3作为pH缓冲液控制浸出溶液的pH 值变化,以便[Co(NH3)6]2+、[Ni(NH3)6]2+络合物的形成,Mn和Al由于络合能力差而留在残渣中。然而,此法存在氨介质回收困难以及亚硫酸盐产生的废水排放问题。Yu等[70]提出溶剂萃取结合氨浸出回收废旧锂离子电池中的有价金属,采用NH3·H2O和(NH4)2CO3对预处理之后的正极活性物质进行选择性浸出,避免了亚硫酸盐作为还原剂的使用;同时通过氨精馏法实现了N的闭环循环。相较于酸浸出策略,氨浸出巧妙地利用其选择性提取有价金属而不含其他杂质金属,简化了浸出液中金属离子的后续分离和回收过程。此外,配合氨精馏法避免了资源浪费和废液排放,同时进一步降低了工业成本。
3.1.3 生物浸出
生物浸出是利用细菌和真菌等微生物的代谢物将不可溶金属转化为可溶性金属盐,实现目标组分与杂质的分离,最终回收有价金属。生物浸出由于其环境友好性和低成本,被认为是传统酸浸的有力替代。Jegan 等[71]通过自养细菌酸化氧化亚铁硫杆菌来实现有价金属的最佳浸出,结果表明,在最佳条件下,可实现对不同贵金属的高效回收。Do等[72]采用酸性氧化亚铁硫酸杆菌浸出废旧三元锂离子电池,在6 h 内浸出了85.5%的Ni、91.8%的Mn、90.4%的Co和89.9%的Li;并通过空气氧化和pH 调节去除Cu、Al 和Fe 等杂质,避免了浸出液中杂质元素分离提纯困难的问题。
与昂贵的有机酸直接浸出相比,廉价环保的生物浸出也可用于废旧锂离子电池的回收。然而,在重金属丰富复杂的环境中,细菌难以繁殖和生存。此外,生物浸出动力学缓慢且只能在低固液比条件下进行,进一步限制了其在工业中的运用。
3.1.4 深共晶溶剂浸出
深共晶溶剂(DES)是由2 种或3 种化合物通过氢键作用合成的一类低熔点共晶混合物。由于其制备简单、来源广泛、具有生物降解性和超高溶解金属氧化物的能力,目前在废旧锂离子电池回收领域受到广泛关注。大多数DES 都具有还原性,这意味着它们既可以作为浸出剂也可以作为还原剂。Luo 等[73]提出了一种由盐酸甜菜碱和乙二醇形成的新型DES,系统研究了其详细的浸出机理:首先,溶剂中电离的氢与LNCM中的氧发生反应,从而破坏晶体结构;随后,DES中的Cl-与过渡金属络合,导致LNCM溶解;最终,在无任何还原剂添加的情况下,Li、Ni、Co 和Mn 的浸出率都可达到99%。此外,Tran 等[74]还研究了DES 的可回收性,发现二次回收的DES 对正极材料仍有溶解作用且浸出效率几乎没有明显下降。从经济和可持续发展的角度来看,DES回收废旧锂离子电池正极材料是一项非常有意义的研究。
3.2 再生
使用浸出剂浸出金属离子之后,下一步就是采取合适工艺从浸出液中回收金属。与传统选择性沉淀法存在回收路线复杂、分离周期长等问题相比,再生法直接从浸出液中合成正极材料或前驱体,大大提高了电极材料的利用率,实现了废旧锂离子电池的闭环回收。更重要的是,再生后的正极材料在充分利用回收的有价金属元素的基础上,性能未发生明显的衰退,仍可满足三元锂离子电池对正极材料能量密度和循环性能的要求。典型的再生方法主要有水热法、共沉淀法和溶胶凝胶法。再生方法对比如图4所示。

图4 再生工艺各方法的优势与劣势Fig.4 Advantages and disadvantages of each method of regeneration process
3.2.1 水热法
水热法是将废旧正极材料在特殊的密闭反应容器内通过溶解再结晶机制再生正极材料。具体流程如图5 所示,将回收的正极材料与含锂溶液混合,将溶液在120~220 ℃低温下加热,制备出新的正极材料。采用水作为反应介质以确保再锂化过程是均匀的,此外,通常需要一个短的退火过程来提高结晶度。Liu 等[75]通过建立剪切应变与电荷状态的关系来快速准确地计算残余锂含量,在此基础上,结合水热锂化和可控气氛下短时间退火成功再生了具有理想化学计量和微观结构的三元正极,该正极具有高容量、良好的循环稳定性和高倍率性能,结果表明即使高镍含量正极,也能达到原始材料的水平。
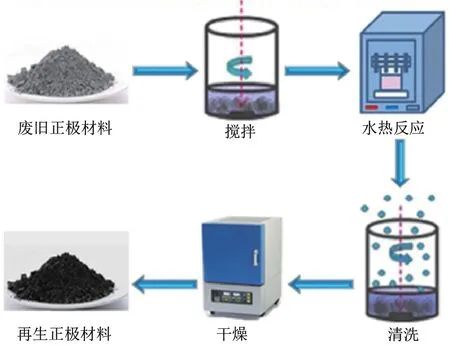
图5 水热法流程图[76]Fig.5 Flow chart of the hydrothermal method [76]
3.2.2 共沉淀法
共沉淀法是常用的再生三元正极的方法。其主要步骤如图6所示,首先将预处理之后的样品进行酸浸得到溶液,通过沉淀法或者萃取法进行杂质离子的去除,添加对应的金属盐调节溶液中各金属离子的比例,然后添加沉淀剂共沉淀合成三元前驱体,最后将前驱体与锂盐混合通过高温固相法再生为新的正极材料。常用的沉淀剂有氢氧化物、碳酸盐和草酸盐。Yang 等[76]以混合废碱性锌锰电池和废锂离子电池为原料,采用氢氧化物共沉淀法成功地合成了锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2,电化学结果表明,再生正极材料在0.1 C 倍率下可以提供160.2 mAh/g的容量。为了避免Mn(OH)2中Mn2+被氧化成Mn3+和Mn4+而从混合氢氧化物中分离出来,He 等[77]采用NaCO3作为沉淀剂合成三元前驱体,CO32-的加入很难改变金属离子的氧化态,可以保留Mn2+的化学价态,最终再生成具有有序层状结构和优异电化学性能的LiNi1/3Co1/3Mn1/3O2的正极材料。Chen等[78]通过改变烧结温度研究了温度对再生材料物理和电化学性能的影响,发现830 ℃下再生的LiNi0.5Co0.2Mn0.3O2在0.2C倍率下循环100次后仍能提供149.2mAh/g 的容量,证实了优化烧结温度对于废旧三元正极材料的再生至关重要。然而,氢氧化物和碳酸盐共沉淀法都存在需严格控制pH 值、温度和络合剂等参数问题,Septia Refly等[79]采用草酸作为沉淀剂,在900 ℃空气气氛下热处理成功制备LiNi1/3Co1/3Mn1/3O2,其在0.2 C 倍率下初始放电比容量达到164.9 mAh/g,除此之外,循环100次后容量保持率为91.3%,表现出非常稳定的性能。
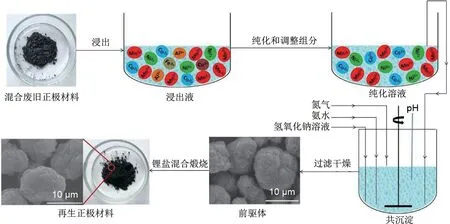
图6 共沉淀法流程图[80]Fig.6 Flow chart of the co-precipitation method [80]
3.2.3 溶胶凝胶法
溶胶凝胶法是以有机酸为浸出剂和络合剂,在浸出液的基础上发生水解聚合反应,经加热蒸发水分得到溶胶,煅烧后制备正极材料。典型溶胶凝胶法步骤如图7所示,将预处理之后的样品经有机酸浸出之后,在浸出液中加入对应的金属盐和氨水以调节金属元素物质的量比和反应过程中pH 值,不断加热搅拌直至水分完全蒸发生成具有三维网状结构的凝胶,将凝胶煅烧处理以分解有机组分得到再生正极。Yao 等[81]采用DL-苹果酸为浸出剂和络合剂,通过溶胶凝胶法成功再生LiNi1/3Co1/3Mn1/3O2正极材料。经电化学性能测试发现,在0.2 C倍率下,再生正极材料的初始充放电容量为152.9 mAh/g和147.2 mAh/g,第100 次循环时的容量保持率为初始值的95.06%。Lee等[82]对溶胶凝胶前驱体的煅烧条件进行了详细的研究,探究了煅烧温度和煅烧气氛对LiNi0.6Co0.2Mn0.2O2结构和电化学性能的影响,发现在850 ℃条件下煅烧的样品具有更好的有序层状结构和更高的结晶度;在氧气气氛中热处理提高了Ni2+在LiNi0.6Co0.2Mn0.2O2表面和本体之间氧化态的均匀性,抑制了表面LiOH 和Li2CO3的形成,从而改善了电化学性能。在850 ℃,氧气气氛下煅烧再生的LiNi0.6Co0.2Mn0.2O2的放电容量为174 mAh/g且100 次循环之后容量保持率为89%。此外,Li等[83]比较了柠檬酸、葡萄糖酸和蔗糖浸出液中再生LiNi0.6Co0.2Mn0.2O2的性能,结果表明,以葡萄糖酸为络合剂时,再生正极阳离子混合程度低,六方晶体结构完整,具有良好的电化学性能。
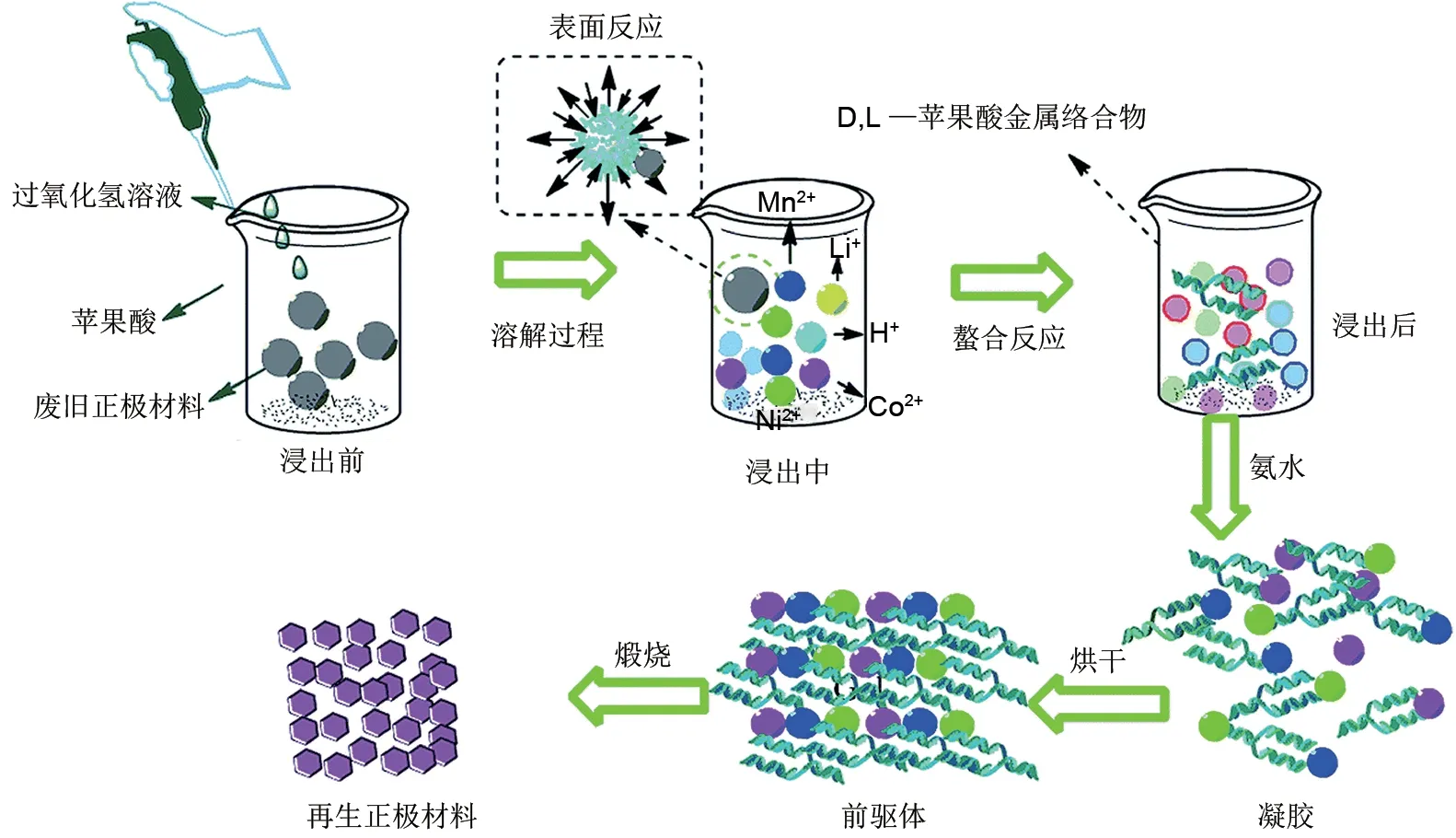
图7 溶胶凝胶法流程图[81]Fig.7 Flow chart of the sol-gel method[81]
与共沉淀法相比,溶胶凝胶法中浸出液的Li+无须分离即可再次利用,最大程度上利用了样品中的金属元素,且再生后的正极材料颗粒均匀、粒径更小。
4 结语与展望
随着全球电动汽车领域的蓬勃发展,三元锂离子电池关键原材料的供应关系日益紧张,同时对环境的潜在污染和破坏使得废旧三元锂离子电池回收势在必行。本文综述了废旧三元锂离子电池正极材料回收利用的必要性以及不同回收工艺的研究现状。目前,火法回收工艺和湿法回收工艺均已进入工业化规模应用,但仍存在有毒有害气体产生及酸碱废液排放等弊端。因此,开发一种绿色环保、短流程和低能耗的回收工艺刻不容缓,建议从以下几个方面着手:
(1)活性物质高效分离。预处理通过去除PVDF或铝箔可以实现活性物质的分离,但传统热处理法、碱溶法和有机溶剂溶解法不可避免地对环境造成污染。因此可以开发水溶性黏结剂代替PVDF,用水替代碱性溶剂和有机溶剂分离活性物质,缩短工艺流程的同时显著降低工业成本。
(2)活性物质绿色浸出。湿法回收工艺需要将活性物质浸出后,才能进行各金属元素的分离提纯,因此浸出剂的选择非常重要。传统酸浸法和氨浸法高效浸出的同时,酸碱废液的排放会对环境造成极大的负担;而生物浸出和深共晶溶剂浸出则存在浸出效率低等问题,开发兼顾浸出效率和环境友好的新型浸出剂可以大大提高回收的经济效益和环保效益。
(3)正极材料闭环再生。目前废旧三元锂离子电池正极材料再生主要是基于湿法回收工艺,虽然浸出液中的Al、Cu和Fe等杂质元素会提升再生正极材料的电化学性能,但在再生过程中仍要控制杂质元素的含量以提高再生正极的质量。因此,需要开发出一种更为简单有效的正极直接修复技术实现真正可持续的闭环电池经济。

