瓦尼木层孔菌培养基优化及抗炎作用研究
乔 奕,郑美辰,盛鑫如,张 帅,周君宣,李 萌,周 鑫,王 硕,陈 芳
(聊城大学 药学院,山东 聊城 252059)
1 引言
杨黄隶属于担子菌门,层菌纲,非褶菌目,锈菌科,木(叶)层孔菌属,是一种附生于杨树、柳树、桦树等阔叶树干的多年生真菌。我国是杨黄菌出口大国,拥有世界上非常丰富的药用真菌资源,东北、云南和川西是我国著名的三大真菌产地。杨黄具有重要的药用价值,名气虽逊于冬虫夏草,但其功效非常显著。有相关研究表明,杨黄提取物能够诱导癌细胞进入死亡程序,同时具有较强的抑制癌细胞转移作用[1-5]。结肠炎(colitis)是指各种原因引起的结肠炎症性病变。致病原因主要由细菌、真菌、病毒、寄生虫、原虫等生物与变态反应及理化因子引起,而杨黄多糖在治疗溃疡性结肠炎方面具有可观的作用[6]。杨黄菌大多为野生,在人工林中难以找到,要获取子实体人工栽培为可行途径。但杨黄菌菌丝体的培养特性少见报道。为了更好地发挥其经济、生态和社会价值,故选择山东聊城临清市杨黄菌对其固体、液体培养基进行优化,以便获得更高产量、更优品质的杨黄菌。通过建立溃疡性结肠炎模型来研究杨黄菌中活性物质对结肠炎的抑制作用。
2 材料与方法
2.1 实验材料
2.1.1 材料。杨黄菌(Phellinus Vaninii),分离自杨黄子实体。
2.1.2 原种培养基配方。
2.2 实验方法
按照原种配方制备固体培养基(需添加1.5%琼脂),将培养皿与配置好的培养基进行高压蒸汽灭菌,条件为115 ℃、20 min;在超净工作台中将培养基倒入培养皿,等待其冷却凝固;用接种针取适量临清杨黄的孢子接种到平板中,做好标记。注意全程无菌操作,避免杂菌入侵、污染杨黄菌。将接种好的平板放于恒温培养箱内,在28 ℃下培养3天,可观察到明显的白色丝状物。取适量制成临时装片置于显微镜下观察,确定为杨黄菌丝。继续培养1~2天,菌丝由白色变为黄色,约7天左右颜色加深,显黄褐色。各个时期菌丝形态如图1所示。
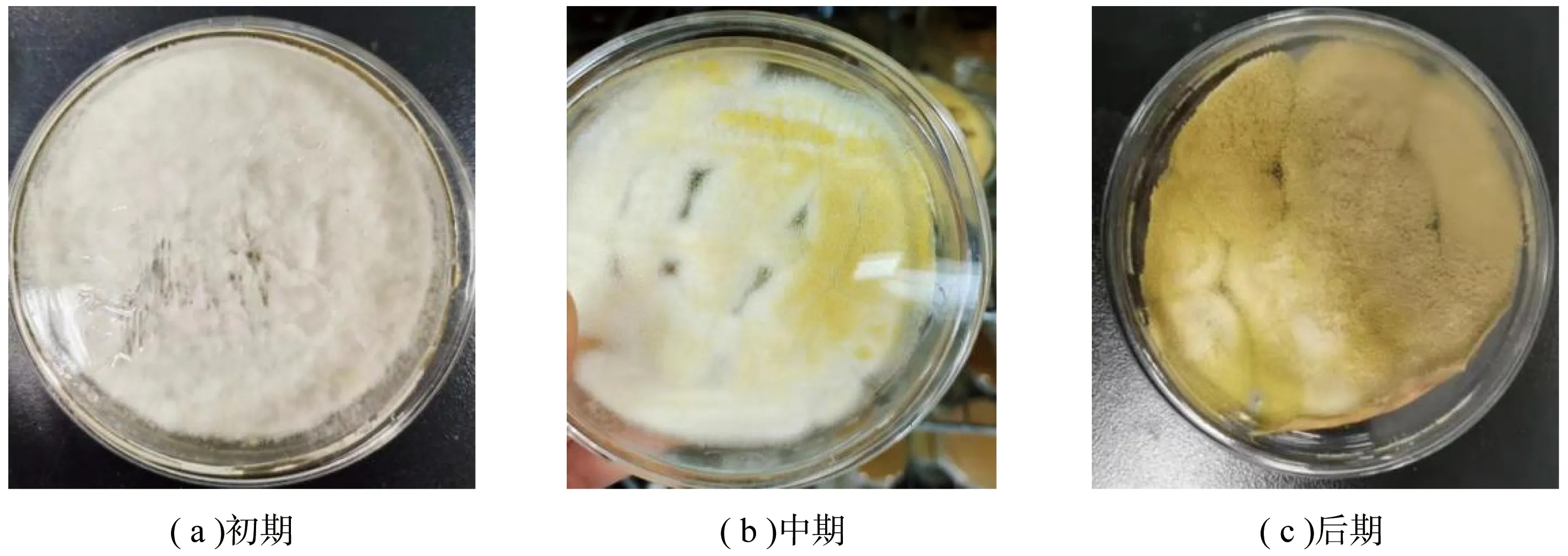
图1 不同培养时期的菌丝初期形态
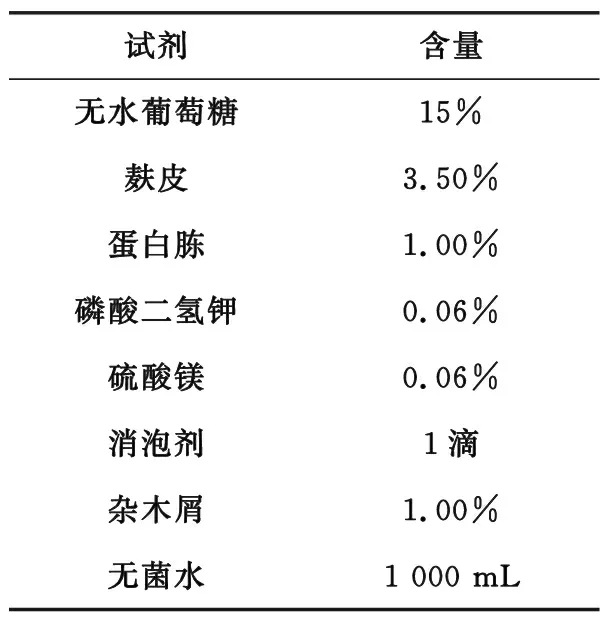
表1 原种培养基配方
将杨黄菌接入液体培养基中进行扩大培养,28 ℃、200 r/min下在摇床内避光培养7天,形成白色菌丝球。使用原种配方固体培养基培养的杨黄菌不仅生长缓慢,且后期易老化,由此考虑到该培养基配方是否为培养杨黄菌的最佳配方,进而对培养基配方进行更改优化,以便缩短培养周期、获得高质量的杨黄菌。
2.2.1 固体培养基优化。选择最优的碳源和氮源:实验选用4种原料(麸皮、杂木屑、蔗糖、无水葡萄糖)作碳源比较, 如表3所示;选择4种原料(麸皮、蛋白胨、豆粕粉、玉米粉)作氮源比较,如表4所示。选取常用的磷酸二氢钾和硫酸镁作为无机离子,消泡剂1滴,使用无菌水溶解。配方用量及培养基分装、灭菌照2.2方法进行。每组三个固体培养基,分别转接在原种平板上生长的杨黄菌,放入28 ℃恒温培养箱中培养10天。采用L9(3)4正交实验设计,根据上述筛选出来的最优碳源和氮源以及无机离子的质量浓度进行实验

表2 疾病活动指数(DAI)评分标准

表3 碳源比较
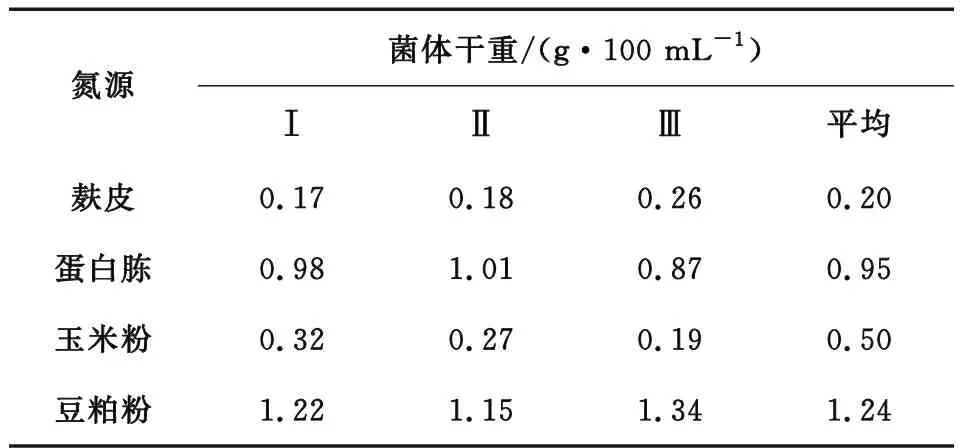
表4 氮源比较
2.2.2 液体培养基优化。豆粕是大豆经浸提或预压浸提制油工艺后经适当热处理与干燥而制成的产品[7]。豆粕经过进一步加工生产得到的豆粕粉具有较高的蛋白含量和较好的利用率,广泛应用于饲养业中。豆粕粉与其他同等作用的材料相比,具有营养丰富、价格较低、易储存且能够促生长的优点,由此选择豆粕粉作为备选氮源之一进行实验。评价指标为菌丝体干重、胞外多糖、胞内多糖。
选择无水葡萄糖、蔗糖、淀粉、玉米粉为碳源,蛋白胨、豆粕粉、牛肉膏、酵母粉为氮源,进行杨黄菌液体培养碳源和氮源的选择性试验,选择出液体培养基最优碳源和氮源。
对正交实验极差进行分析,因素A即无水葡萄糖的影响最大,其次为B(蛋白胨+豆粕粉)、C(硫酸镁)和D(磷酸二氢钾),综合考虑各评价指标平均值以及主要影响因素,确定了最优组合为A3B1C3D2。
2.2.3 杨黄菌丝体多糖对溃疡性结肠炎的抑制作用研究。有相关研究表明,用杨黄提取物处理大鼠的实验中发现,杨黄提取物能够降低患肺炎大鼠体内的炎症细胞,包括中性粒细胞的数量和白介素(IL)-1β的水平[8]。本实验通过建立小鼠结肠炎模型来进一步探究杨黄菌多糖的抗炎作用。
2.2.3.1 杨黄菌丝体多糖的提取。将杨黄菌培养液在200 r/min离心15 min,取菌丝体置于干燥箱中烘干,研磨获得杨黄菌丝体干粉。用无菌水进行二次提取,将水提结束后的溶液并液浓缩。提取时水的用量相当于有效成分的50倍,90 ℃下煎煮两次,每次煎煮2 h。在此工艺条件下提取水溶性多糖操作简单、易行,方法重现性好[9-11]。
2.2.3.2 结肠炎模型的建立。健康昆明小鼠适应性喂养后10只一组随机分为5组:空白对照组(Control组),结肠炎模型组(DSS组)、杨黄多糖低剂量组(L组)、高剂量组(H组)、阳性对照组(SASP组)。连续14天空白组灌胃给予无菌蒸馏水,L、H组分别灌胃给予杨黄多糖溶液107CFU/(mL·kg)-1和109CFU/(mL·kg)-1,SASP组每天灌胃给予SASP 100 mg/kg,第8~14天除对照组为无菌蒸馏水外,其余组均用含3%葡聚糖硫酸钠(DSS)的无菌水灌胃。饲养过程中每3天记录体重和疾病活动指数。在第15天,将以上5组小鼠禁食,取眼球血后颈椎脱臼处死,取出结肠,测量其长度,取一部分结肠经多聚甲醛固定,一部分保存于-80 ℃进行生化分析。
2.2.3.3 疾病活动指数(DAI)的评估。对造模后小鼠的体重、粪便黏度和便血等情况进行评分如2表所示,每3天记录一次疾病活动指数(DAI)评分,以评估结肠炎的严重程度,评分的每一项指数均按0~4分进行评分,0分表示无疾病症状,4分表示严重疾病症状。
2.2.3.4 小鼠结肠长度及结肠组织病理学分析。测量每组小鼠从盲肠到肛门的结肠长度;采用HE染色法分析结肠组织病理变化。取出的小鼠的结肠组织,用4%多聚甲醛溶液固定,24 h后乙醇脱水,再经乙醇和二甲苯脱水,用石蜡包埋制成蜡块。将蜡块用切片机制备5 μm切片并用苏木精和伊红染色,在光学显微镜下观察各组小鼠结肠组织的病理变化。
2.2.3.5 小鼠炎症因子、肝肾系数指标的测定。取小鼠眼球血在4 ℃下3 000 r/mim离心10 min,取上清液在-80 ℃保存用于生化分析。对收集的血清使用酶联免疫吸附法进行炎症因子、肝肾功能指标测定,检测每组小鼠血清中的炎症因子(TNF-α,IFN-γ,IL-1β和IL-6)水平,同时采用ELISA检测试剂盒检测(上海纪宁实业有限公司)谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清肌酐(CR)、血尿素氮(BUN)水平来检测肝肾系数指标。
3 结果与分析
3.1 不同碳源、氮源对固体培养基优化的影响
表3、表4分别为不同碳源、氮源的固体培养基中杨黄菌的菌体干重,通过比较可以看出,以无水葡萄糖为碳源菌丝体干重最高,以豆粕粉为氮源菌丝体干重最高、以蛋白胨为氮源菌丝体干重较高。
设计L9(3)4正交实验,根据筛选出来的最佳碳源、氮源以及无机离子的质量浓度进行实验,结果如表5所示。
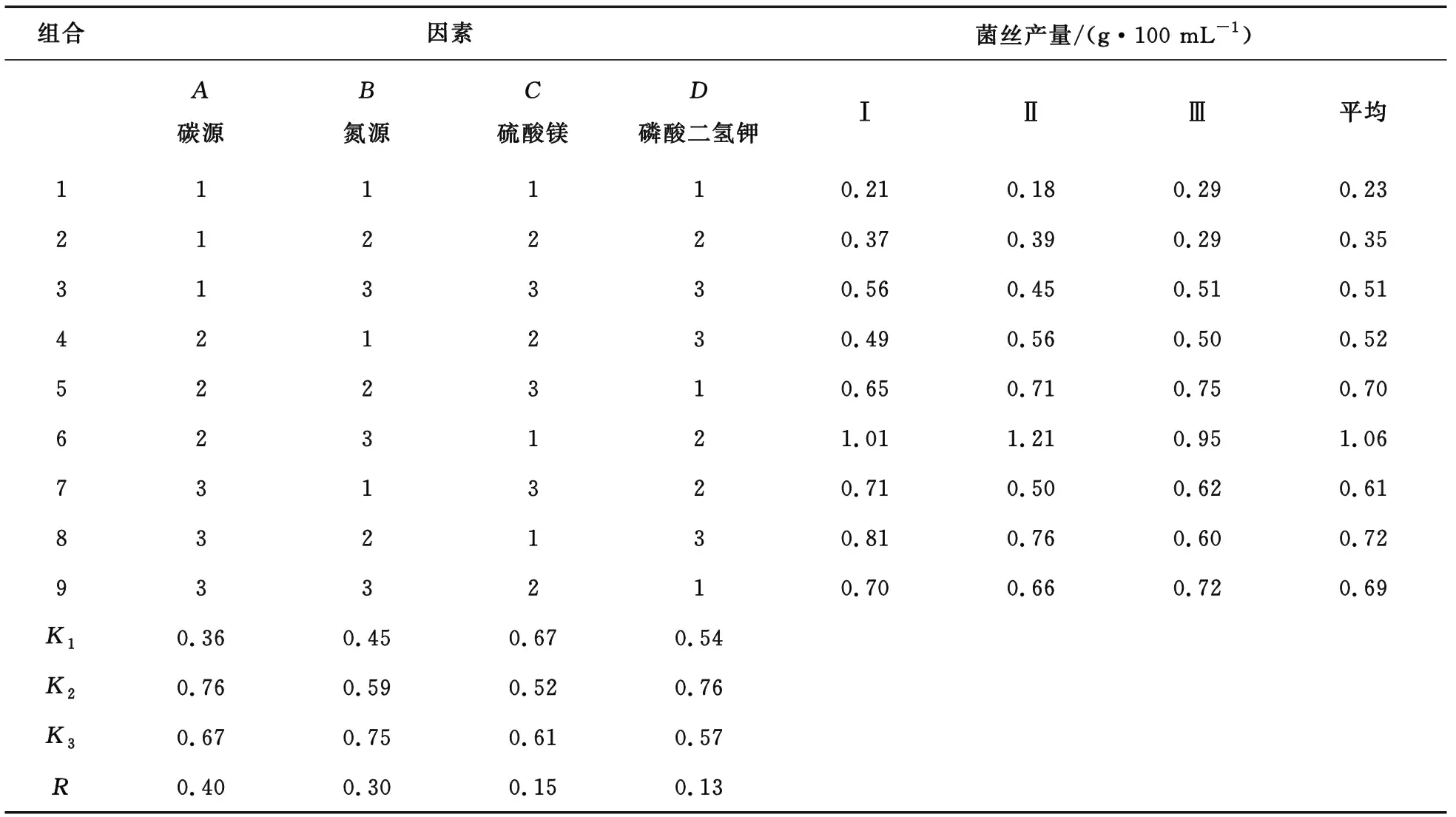
表5 固体培养基优化正交实验
采用直观分析法分析表5显示的正交实验结果,按照统计方法计算方差得到较优组合是A2B3C1D2。从R极差的大小来看,A>B>C>D,说明在4个因素中影响菌丝生长发育的最主要的因素是碳源,其他因素依次是氮源、硫酸镁和磷酸二氢钾。对于杨黄菌固体培养基,最优的碳源、氮源组合为无水葡萄糖+蛋白胨。
3.2 液体培养基优化分析
选择不同碳源、氮源制备液体培养基对杨黄菌进行培养,通过测定菌丝体干重、胞外多糖浓度胞内多糖的浓度来分析最佳碳源和氮源,结果如图2所示。无水葡萄糖组和玉米粉组的评价指标明显高于其他组,且葡萄糖组更高;蛋白胨组和豆粕粉组的评价指标高于其他组,且差别不大。

注:* p <0.05; * * p <0.01。图2 (a)备选碳源; (b)氮源的选择结果
综合考虑,选择无水葡萄糖为碳源、蛋白胨+豆粕粉为氮源进行L9(3)4正交实验设计优化杨黄菌液体培养基,如表6所示。

表6 液体培养基优化正交实验
对正交实验极差进行分析,因素A即无水葡萄糖的影响最大,其次为B(蛋白胨+豆粕粉)、C(硫酸镁)和D(磷酸二氢钾),综合考虑各评价指标平均值以及主要影响因素,确定了最优组合为A3B1C3D2。
3.3 杨黄菌多糖能抑制DSS诱导的溃疡性结肠炎
3.3.1 降低结肠炎小鼠DAI。溃疡性结肠炎小鼠最具典型的病理特征表现为体重下降,如图3(a)所示,结肠炎组小鼠在第9天体重开始明显下降,第15天,其体重虽略有增加,但与空白组相比其体重下降显著。与结肠炎组相比,杨黄菌多糖低剂量、高剂量组小鼠在第9天体重下降,但体重均高于结肠炎组小鼠的体重;第12天两组小鼠的体重均开始缓慢恢复,第15天杨黄菌多糖组小鼠体重明显高于结肠炎组且差异明显。
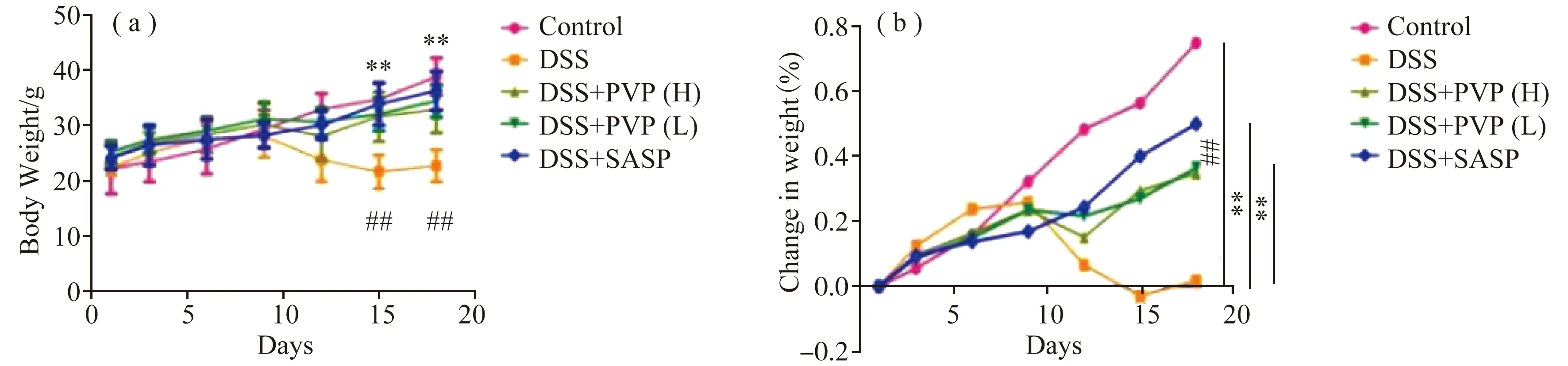
注:* p <0.05; * * p <0.01,治疗组vs DSS组。图3 (a)不同组小鼠体重变化; (b)及体重变化率
小鼠疾病指数变化(DAI)如图4所示,在整个试验期间空白组小鼠体重日渐增加(评分0),粪便情况正常(评分0),无粪便隐血情况(评分0),总计DAI值为0。与空白组相比,其他各组DAI值自实验第2天起均显著升高,其中以DSS组DAI值最高。造模期间模型组、杨黄菌多糖高剂量组和低剂量组、阳性对照组的DAI评分均高于空白组。在经杨黄菌多糖(高、低剂量)和药物的灌胃干预后,该两组DAI评分明显下降,与结肠炎组相比具有显著性差异。
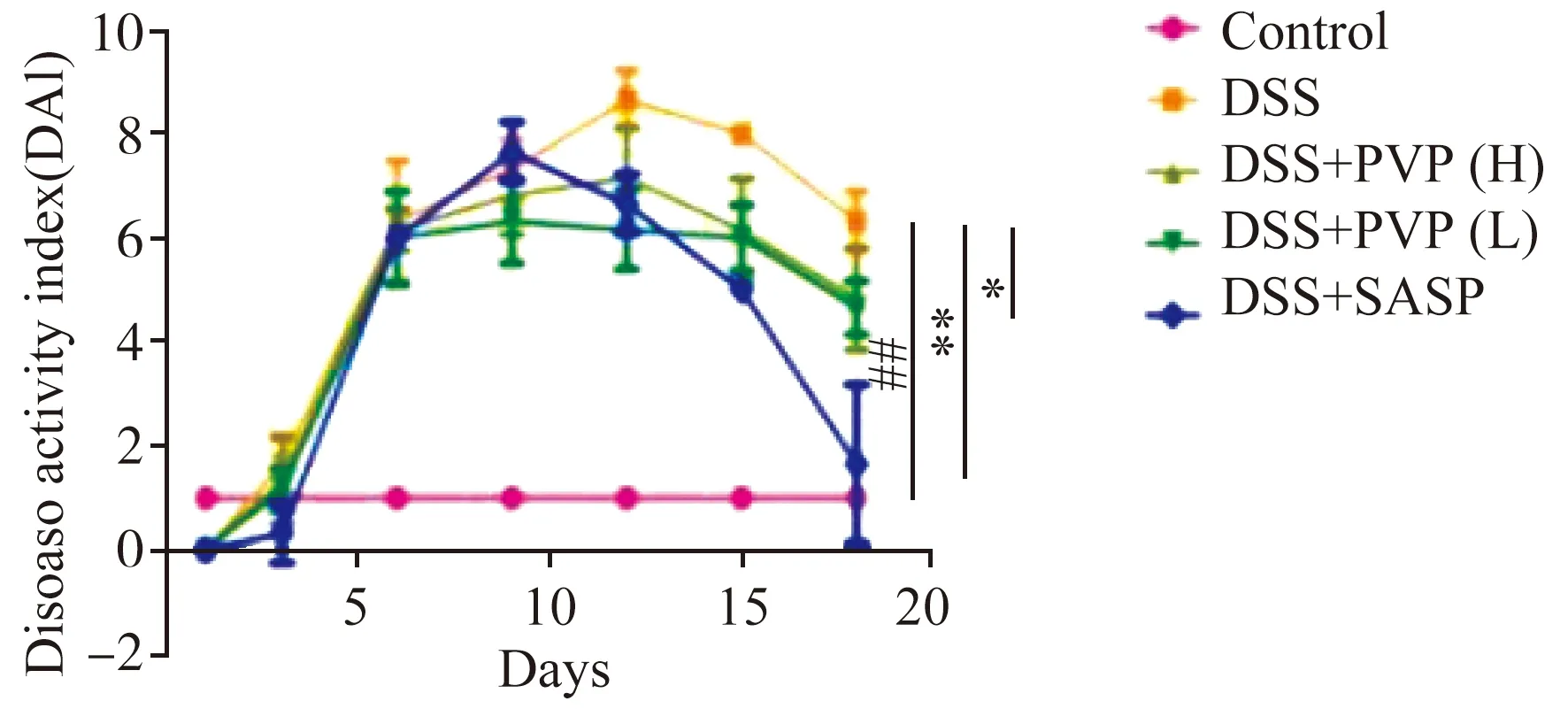
注:* p <0.05; * * p <0.01,治疗组vs DSS组。图4 不同组小鼠DAI变化
3.3.2 对小鼠结肠长度变化的影响以及组织病理学分析。DSS诱导小鼠产生结肠炎引起的结肠充血、水肿,结肠肠壁增厚、生成溃疡面等都会使结肠长度缩短,本实验选用结肠长度为测量指标,小鼠结肠长度变化如图5所示,DSS组结肠长度明显缩短,平均长度为(6.75±0.43) cm,空白组为(8.51±0.30) cm。与DSS组相比,杨黄菌多糖低剂量和高剂量组的结肠长度明显长于空白组,平均长度分别为(8.45±0.24) cm和(8.13±0.35) cm,阳性对照组为(7.52±0.51) cm。由此表明,杨黄多糖能减缓肠道炎症使结肠长度减少的趋势且能够有效抑制结肠缩短,并具有一定的促生长作用。
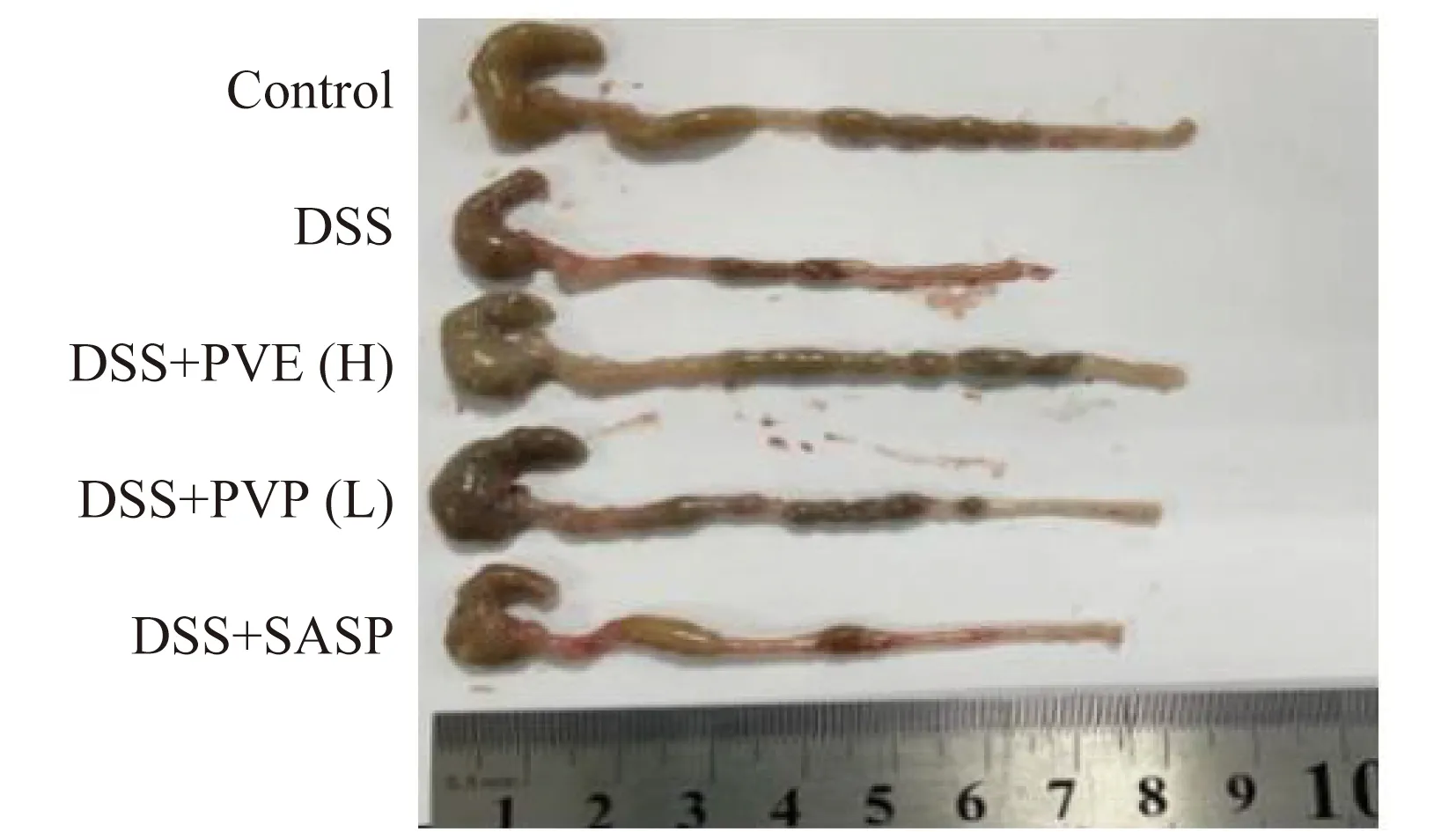
图5 结肠长度
对结肠组织进行HE染色,结果如图6所示,空白组小鼠结肠上皮细胞微绒毛整齐致密,含丰富杯状细胞,无炎症细胞浸润。DSS组小鼠的结肠组织有明显的隐窝变形、杯状细胞丢失、炎症细胞浸润以及黏膜损伤。与DSS组相比,杨黄多糖低剂量组和高剂量组小鼠结肠的隐窝上皮变形、杯状细胞丢失情况较轻,黏膜炎症程度明显下降,炎症细胞浸润减少,病变程度有所减轻。
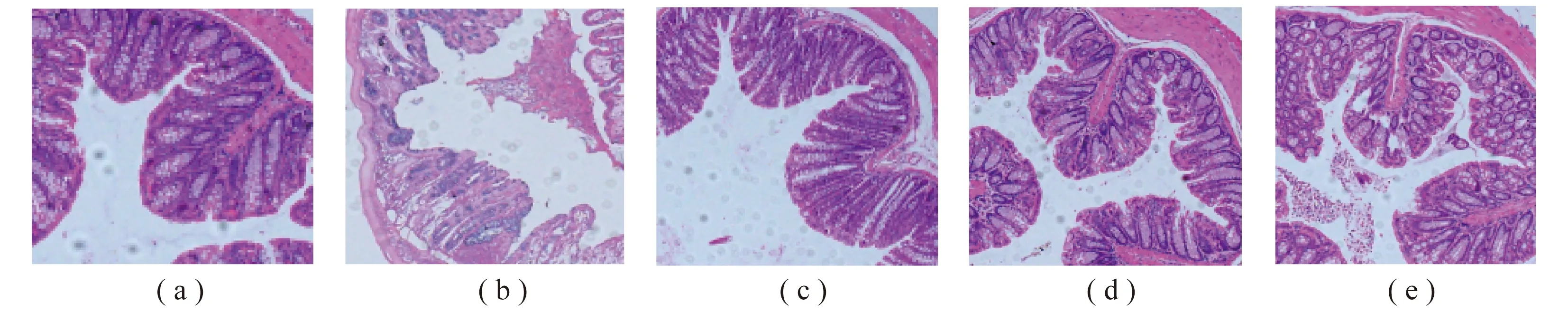
注:(a) Control; (b) DSS; (c) DSS+PVP(H); (d) DSS+PVP(L) ; (e) DSS+SASP; (a~e):DSS结肠炎小鼠结肠组织切片HE染色(200×)。图6 结肠HE染色法切片
3.3.3 对小鼠炎症因子、肝肾系数指标的影响。结肠炎与促炎细胞因子的调节作用有关[12],包括TNF-α, IL-6, IL-1β, IFN-γ。对小鼠结肠组织上清液的测定结果如图7所示,DSS诱导后的小鼠血清中四种炎症因子水平与空白组相比明显增加。杨黄多糖低剂量、高剂量组以及阳性对照组小鼠血清中该四种因子水平较DSS组低。表明DSS诱导的小鼠水平明显增加,而杨黄菌可在一定程度下调节血清中IL-1β、IL-6、IFN-γ、TNF-α的含量,说明杨黄可通过对炎症因子的调节改善由于DSS诱导的溃疡性结肠炎。

注:杨黄多糖对炎症因子(a) Ifn-γ; (b) IL-1β; (c) IL-6; (d) YNF-α; *p<0.05; **p<0.01。图7 对炎症因子分泌的影响
图8为不同处理对小鼠肝肾系数的影响,DSS组谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清肌酐(CR)、血尿素氮(BUN)水平与对照组相比明显升高。杨黄多糖组与模型组相比则降低。由此可知DSS组结肠炎小鼠ALT、AST、CR、BUN的活力明显增加,而用杨黄菌干预后,小鼠ALT、AST、CR、BUN活力明显减少,说明杨黄菌对小鼠肝肾功能无显著不良影响。

注:杨黄多糖对ALT、AST、CR、BUN的影响;(a) ALT含量; (b) AST含量; (c) CR含量; (d) BUN含量; * p <0.05, * * p <0.01,治疗组vs DSS组。图8 对肝肾系数的影响
4 讨论
本研究采用山东聊城临清市的杨黄菌子实体为材料,探索适合杨黄菌菌株培养的优化培养基配方,所得优化固体培养基配方为:无水葡萄糖2%、蛋白胨2%、磷酸二氢钾0.06%、硫酸镁0.06%、琼脂1.5%。以豆粕粉为主要氮源的豆粕粉综合培养基更适合杨黄菌液体培养:无水葡萄糖2%、蛋白胨0.1%、豆粕粉0.35%、磷酸二氢钾0.06%、硫酸镁0.06%、消泡剂1滴。各培养基成分应用常温无菌水溶解,不要用温水。将杨黄菌转接后使用优化培养基对其进行固体培养和液体培养,不仅缩短了传统培养的培养周期,而且获得的杨黄菌质量更高,为后续的扩大培养以及应用奠定基础。
杨黄菌在抗炎、抗肿瘤、提高免疫力等方面表现出良好的药理活性,其中对炎症的缓解能力非常可观。本研究通过分析杨黄菌丝体多糖对结肠炎小鼠体重变化、DAI评分、结肠长度、炎症因子、肝肾系数、组织病理学等指标的影响,证实了杨黄菌丝体多糖的抗炎作用。基于此,有望通过用杨黄菌活性提取物代替传统抗生素治疗结肠炎,避免毒副作用和耐药性,具有良好的治疗效果。
以杨黄菌丝体干重、胞外多糖浓度、胞内多糖浓度为指标,筛选出最适合杨黄菌菌株的液体培养基。以无水葡萄糖为碳源,以豆粕粉+蛋白胨为氮源的豆粕粉综合培养基更适合杨黄的扩大培养。豆粕粉中存在能促进菌丝体生长的效应因子,将豆粕粉做为氮源和蛋白胨复合使用在28 ℃恒温培养条件下,采用正交试验设计优化所得该培养基的优化配方如下:液体培养基配方为无水葡萄糖2%、蛋白胨0.1%、豆粕粉0.35%、磷酸二氢钾0.06%、硫酸镁0.06%、消泡剂1滴。从培养得到的杨黄菌中提取菌丝体多糖,通过建立小鼠的结肠炎模型研究证实其良好的抗溃疡性结肠炎活性。
杨黄菌的药用价值最早可以追溯到两千年前《神农本草经》中的“桑耳”,具有提高人体免疫力、抗肿瘤、保肝护肝、抗脂质过氧化、治疗痛风、降血糖、抗血管生成等作用[13-15]。近年来,对野生杨黄资源的过度开发和利用,使得野生杨黄菌资源面临枯竭的现状。我国虽然早期就对杨黄菌进行开发与利用,但对其研究仍然处于初期,大众社会对于杨黄菌的认知度低,而日韩两国对其的研究早于我国[16,17]。
为了挽救这一珍稀的药用真菌,开发其药用价值,惠及大众,对其进行各方面的研究具有重大意义。将固体培养和液体培养结合,将传统栽培方法与现代人工培育相结合,缩短原种培养基的培养周期,更快速地得到高质量杨黄,提高杨黄菌人工培养和生产效率,积极研究其药理活性,同步发挥杨黄菌的经济、社会以及生态价值,使这一个古老的药用真菌——杨黄菌焕发出新的活力。

